Под воздействием физиологически активных веществ клетки могут претерпевать изменения в морфологии, скорости клеточного роста, времени гибели и степени дезинтеграции, поэтому для каждого вещества, являющегося потенциальным фармакологическим агентом, необходимо выполнять оценку влияния на выживаемость клеток. Существуют различные методы определения цитотоксичности продуктов органического синтеза, природных соединений и экстрактов. Эти методы можно разделить на три группы:
1) измерение митохондриальной активности;
2) оценка выделения лактатдегидрогеназы или аденилаткиназы вследствие нарушения целостности цитоплазматической мембраны;
3) определение количества АТФ в клетках и активности киназы 3/7 как индикаторов клеточного некроза и апоптоза [14].
Первая группа методов особенно популярна в экспериментальных фармакологических исследованиях. Определение изменений в митохондриальной активности может быть определено с использованием МТТ (бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) и ресазурина (натриевой соли 7-гидрокси-3Н-феноксазин-3-он-10-оксида) (рис. 1).
Метод МТТ, который был впервые описан Mosmann более 30 лет назад [15], широко используется как скрининговый метод измерения выживаемости клеток и включен в большинство протоколов методов молекулярной биологии и медицины [10; 7]. В его основе лежит реакция восстановления желтой соли тетразолия (МТТ) митохондриальными дегидрогеназами живых клеток до пурпурных кристаллов формазана, которые нерастворимы в водной среде обитания клеток. Кристаллы формазана (МТТ-ф) растворяют в ДМСО или в смеси HCl-изопропанол и определяют колориметрически. Эта процедура убивает живые клетки, то есть МТТ-тест является конечной точкой исследования. Кроме того, метод определения цитотоксичности с помощью МТТ плохо реализуется при использовании суспензионных культур, так как подразумевает полное удаление среды культивирования на стадии растворения кристаллов формазана. Однако преимуществами данного метода является экономичность и отличная воспроизводимость результатов.
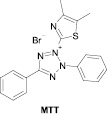
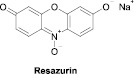
Рис. 1. Химические формулы использованных красителей
Ресазурин представляет собой водорастворимый прижизненный краситель, который используется с 1950-х годов для оценки бактериального и дрожжевого загрязнения биологических жидкостей и молока [9; 11]. Метод определения с его участием основан на способности живых клеток восстанавливать голубой нефлуоресцирующий ресазурин до розового флуоресцентного ресоруфина, который можно определить колориметрически или флуориметрически (последний способ более чувствителен) [4]. Ресазурин, в отличие от МТТ, восстанавливается более широким спектром ферментов: кроме митохондриальных дегидрогеназ его восстанавливают также цитохромы и дегидрогеназы, находящиеся в цитоплазме клетки [17]. Методологические особенности эксперимента с ресазурином позволяют использовать в исследовании суспензионные культуры и дают возможность в дальнейшем использовании культуры; то есть измерение выживаемости клеток при использовании ресазурина может быть первой, но не конечной, точкой эксперимента.
Целью данной работы является сравнение двух методов определения цитотоксичности – МТТ-теста и теста с участием ресазурина. Для решения задачи мы исследовали антипролиферативную активность 10 модифицированных производных природного эпоксиалантолактона по отношению к опухолевым линиям клеток человека RD (рабдомиосаркома) и НСТ116 (карцинома кишечника).
Материалы и методы исследования
В работе использовано оборудование Центра коллективного пользования научным оборудованием для создания генно-модифицированных линий животных и изучения эффективности соединений на оригинальных клеточных и трансгенных моделях нейродегенеративных заболеваний человека.
Исследуемые соединения
В качестве исследуемых соединений нами были выбраны аминопроизводные природного сесквитерпенового лактона – эпоксиалантолактона (1), который является минорным вторичным метаболитом растения Inula helenium L. Сведения о препаративной наработке исходного соединения и последующем модифицировании были опубликовано нами ранее [2; 1]. Мы также показали, что производные 2–11, сконструированные на основе эвдесманового сесквитерпенового лактона путем модифицирования рядом фармакофорных аминов, проявляют ингибирующую активность в отношении линии аденокарциномы молочной железы человека MCF7 [3]. Общая химическая структура исследуемых соединений приведена на рис. 2.
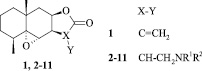
Рис. 2. Общая формула исследуемых соединений
Культуры клеток
Культуры клеток человека RD (АТСС® CCL-136™) и НСТ116 (АТСС® CCL-247™) выращивали в среде DMEM (НПП ПанЭко) с добавлением 10 % эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2мM L-глутамина (НПП ПанЭко), 1 % гентамицина (ОАО Биохимик) в качестве антибиотика и инкубировали при 37 °C в атмосфере CO2 (5 %).
Общая методика
Клетки сеяли в 96-луночный планшет (CELLTREAT™) в количестве 1·104 клеток/200 мкл и культивировали при 37 °C в атмосфере CO2 (5 %). После 24 часов инкубации к культурам клеток были добавлены тестируемые соединения в различных концентрациях (100; 50; 25; 12,5; 6,25; 3,12 и 1,56 мкМ), и далее клетки культивировали в тех же условиях 48 часов. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все вещества растворяли в ДМСО (PANREAC QUÍMICA S.L.U), конечная концентрация ДМСО в лунке не превышала 1 % и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 1 %.
Определение цитотоксичности МТТ-тестом
Цитотоксичность синтезированных соединений была определена с помощью МТТ-теста [12]. После инкубации с соединениями в каждую лунку было добавлено 20 мкл MTT (бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) (5 мг/мл) (Sigma-Aldrich) и планшеты дополнительно инкубировали в течение 2 часов. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм за вычетом измеренного фонового поглощения при 620 нм.
Определение цитотоксичности с помощью ресазурина
Цитотоксичность синтезированных соединений была определена по тесту Alamar Blue [16]. После инкубации с соединениями в каждую лунку было добавлено 22 мкл ресазурина (7-гидрокси-3Н-феноксазин-3-он-10-оксида натриевой соли) (Sigma-Aldrich) с конечной концентрацией 50 мкМ. Планшеты инкубировали в течение 2 часов. Флуоресценцию восстановленного красителя определяли с помощью планшетного ридера (Victor3, PerkinElmer) (возбуждение при 530 нм, эмиссия при 590 нм).
Значение концентрации, вызывающее 50 %-е ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0.
Результаты исследования и их обсуждение
Цитотоксический эффект сесквитерпеновых лактонов, определенный МТТ-тестом и с помощью ресазурина, по отношению к двум опухолевым линиям клеток человека имеет выраженный дозозависимый характер, индивидуальный для каждого соединения (рис. 3 и 4).




Рис. 4. Восстановление ресазурина до ресоруфина клетками RD и HCT116 при воздействии исследуемыми соединениями. Значения флуоресценции представлены в относительных единицах. Для контроля (без соединений, 1 % ДМСО) значения для линий RD и HCT116 составляют 6∙105 ± 1∙104 и 9∙105 ± 2∙104 соответственно. Для приведенных данных отображены значения ± SD (n = 3)
Проведенные исследования позволили определить эффективные концентрации соединений, вызывающие 50 % ингибирование выживаемости клеток (IC50). Значения IC50 всех тестируемых соединений приведены в таблице.
Значения IC50 (мкМ) модифицированных производных эпоксиалантолактона
|
Соединение |
МТТ-тест |
Тест с помощью ресазурина |
||
|
RD |
HCT116 |
RD |
HCT116 |
|
|
L05-0003 (2) |
12,79 ± 0,78 |
16,14 ± 1,82 |
46,69 ± 1,11 |
59,69 ± 0,30 |
|
L05-0619 (3) |
17,07 ± 1,00 |
10,97 ± 0,41 |
43,19 ± 2,51 |
82,52 ± 2,10 |
|
L05-5272n (4) |
24,94 ± 0,50 |
36,07 ± 0,82 |
33,38 ± 0,40 |
47,86 ± 1,50 |
|
L05-6640 (5) |
11,94 ± 0,33 |
10,04 ± 1,64 |
44,94 ± 1,04 |
42,61 ± 1,87 |
|
L05-0218 (6) |
18,10 ± 0,90 |
17,62 ± 0,06 |
36,12 ± 0,45 |
46,40 ± 1,78 |
|
L05-5702 (7) |
18,04 ± 0,09 |
23,91 ± 6,17 |
70,29 ± 1,89 |
85,83 ± 6,96 |
|
L05-6605 (8) |
4,21 ± 0,01 |
6,04 ± 0,09 |
21,36 ± 0,26 |
23,79 ± 0,32 |
|
L05-0140 (9) |
5,38 ± 0,01 |
20,36 ± 0,42 |
37,65 ± 0,25 |
46,76 ± 0,58 |
|
L05-6747 (10) |
2,86 ± 0,06 |
11,09 ± 1,83 |
35,85 ± 0,04 |
23,49 ± 1,34 |
|
L05-5418 (11) |
5,54 ± 0,13 |
12,20 ± 0,05 |
51,10 ± 0,62 |
60,29 ± 0,86 |
Из таблицы видно, что в целом значение ингибирующей концентрации IC50, полученное в результате использования МТТ, является более низким, чем полученное с помощью ресазурина. Разница между IC50 также варьируется в зависимости от клеточной культуры. В случае с культурой НСТ116 она менее выражена и составляет от 1,3 раза (для соединения L05-5272n) до 7,5 раз (для соединения L05-0619). В случае с культурой RD она составляет от 1,3 раза (для соединения L05-5272n) до 12,5 раз (для соединения L05-6747).
Можно предположить, что полученная разница в значениях IC50 при использовании двух красителей является закономерной. Как было указано выше, ресазурин восстанавливается более широким спектром ферментов, чем МТТ. Кроме митохондриальных дегидрогеназ ресазурин восстанавливают также цитохромы и дегидрогеназы, находящиеся в цитоплазме клетки, а именно диафоразы [13; 5] и флавинредуктазы [8]. В то время как митохондриальная активность клеток угасает из-за проявления цитотоксичности соединений, цитоплазматические ферментные системы еще остаются в рабочем состоянии и определяются по восстановлению ресазурина. Более низкие значения IC50, получаемые с помощью красителя МТТ, предпочтительнее при переходе на исследование специфической противоопухолевой активности и острой токсичности в моделях in vivo. Кроме того, из литературных данных следует, что МТТ-тест показывает бóльшую воспроизводимость результатов, оцениваемую по коэффициенту вариации и отношению сигнал/фон [6].
Таким образом, на примере 10 физиологически активных производных эпоксиалантолактона нами было проведено сравнительное определение цитотоксичности с использованием двух красителей. Было установлено, что для рутинных скрининговых исследований на адгезионных культурах клеток актуальным остается МТТ-тест. Однако при мультиплексной задаче исследования и при использовании суспензионных культур более предпочтительным становится метод с участием ресазурина в качестве прижизненного красителя.
Рецензенты:Григорьев В.В., д.б.н., заведующий лабораторией нейрорецепции, ФГБУН «Институт физиологически активных веществ» Российской академии наук, г. Черноголовка;
Серков И.В., д.х.н., ведущий научный сотрудник лаборатории специального органического синтеза, ФГБУН «Институт физиологически активных веществ» Российской академии наук, г. Черноголовка.
Работа поступила в редакцию 27.12.2014.



