Волнообразность числа пролетающих птиц была отмечена В.Р. Дольником при ежедневной регистрации осенних миграций на Куршской косе и в пяти пунктах Прибалтики [3]. Далеко не все регистрируемые максимумы числа пролетающих птиц можно было связать с динамикой погодных условий. Автором указывается на совпадение календарных дат миграционных волн в разные годы. В период наблюдений с 1958 по 1962 гг. на Куршской косе максимальное число мигрирующих птиц зарегистрировано: 17–18, 21–22, 25–27, 29–30 сентября, 3–4, 7–8 октября [4]. Однако практически нет работ по изучению многодневных (инфрадианных) ритмов локомоторной активности птиц в сезон миграции.
Целью работы было исследование инфрадианных ритмов уровня локомоторной активности самцов зябликов в период осенней миграции.
Материалы и методы исследования
Эксперимент проведен на самцах зябликов (Fringilla coelebs). Взрослые особи (n = 6) были пойманы весной, а молодые (n = 8) – в июле, в птенцовом (ювенальном) оперении. При работе с экспериментальными животными руководствовались приказом Минздрава СССР № 755 от 12.08.1977 г. Локомоторную активность птиц, отражающую миграционное беспокойство, как и другие исследователи, оценивали по числу прыжков на жердочку за сутки [3]. Птиц содержали в отдельных клетках 40×25×30 с двумя жердочками. Один конец жердочки крепился неподвижно и имел на себе противовес, на другом подвижном конце имеющем ограничитель сверху и снизу располагался счетчик (Sigma-500, Германия), регистрирующий отклонение этого конца жердочки при прыжке птицы. Исследование проводили в двух разных комнатах: в одной поддерживалось искусственное освещение полного спектра (5600 К) в 2200 лк на уровне жердочек с режимом освещения, имитирующим естественное для этого сезона, в другой было естественное освещение. Температура в обеих комнатах поддерживалась в пределах +20–23 °С. В кормушках всегда присутствовали семена рапса и разрезанного пополам подсолнечника. Показатели счетчика регистрировали после прекращения птицами дневной активности ежедневно с 14 сентября по 28 октября 2011 г. Всего было проведено за 45 дней 630 измерений.
Статистическую обработку полученных результатов проводили с использованием программы «Statistica 6.0». Достоверность различий между показателями определяли по U-критерию Манна‒Уитни. Различия считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
В динамике показателей локомоторной активности у 4-х птиц, содержавшихся в условиях естественного освещения, а также у 7 птиц в условиях искусственного освещения был выявлен 8-суточный биоритм. У трех взрослых птиц, не завершивших линьку к 15 сентября, локомоторная активность была на низком уровне и достоверных ритмических колебаний этого показателя не наблюдалось.
Выявленный 8-суточный биоритм локомоторной активности у птиц, содержавшихся в условиях естественного освещения, был синхронен у всех особей, за исключением одного (№ 1) (рис. 1). У этого зяблика после 10-го октября наблюдалось смещение фазы 8-суточного ритма локомоторной активности на 4 сут.
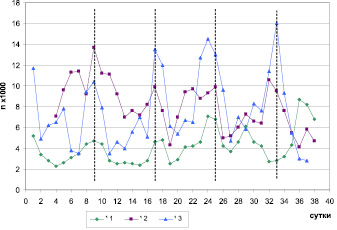
Рис. 1. Динамика уровня локомоторной активности трех самцов зябликов (№ 1 – ad; № 2 и № 3 – sad) в период с 14 сентября по 21 октября 2011 г., содержавшихся в условиях естественного освещения. По оси абсцисс – порядковый номер суток от начала исследования. По оси ординат – число прыжков за сутки
У птиц, содержавшихся в условиях искусственного освещения, 8-суточный ритм локомоторной активности либо совпадал по фазе, либо находился в противофазе по отношению к фазе этого ритма в группе зябликов, находившихся при естественном освещении. Таким образом, относительно фазы 8-суточного ритма локомоторной активности зябликов, находившихся при естественном освещении, птицы, содержавшиеся в условиях искусственного освещения, разделились на 2 группы: совпадающие по фазе – 1-я группа (n = 4) и находящиеся в противофазе – 2-я группа (n = 3).
С целью выявления статистической значимости различий показателей в акрофазе и батифазе у птиц, содержавшихся в условиях искусственного освещения, был применен метод наложения эпох. Ни одна птица не была исключена из анализа по причине отклонения фазы ритма локомоторной активности. Весь исследуемый период был разбит на 8-суточные периоды. Значения процентного отклонения от индивидуального среднего уровня локомоторной активности за 14, 22, 30 сентября, 8 и 16 октября были отнесены к первому дню 8-суточного периода; 15, 23 сентября, 1, 9 и 17 октября – ко второму дню 8-суточного периода; 16, 24 сентября, 2, 10 и 18 октября – к третьему дню 8-суточного периода; 17, 25 сентября, 3, 11 и 19 октября – к четвертому дню 8-суточного периода; 18, 26 сентября, 4, 12 и 20 октября – к пятому дню 8-суточного периода; 19, 27 сентября, 5, 13 и 21 октября – к шестому дню 8-суточного периода; 20, 28 сентября, 6 и 14 октября – к седьмому дню 8-суточного периода; 21, 29 сентября, 7 и 15 октября – к восьмому дню 8-суточного периода (рис. 2).
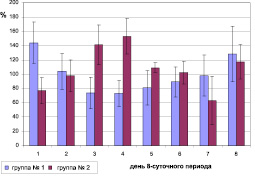
Рис. 2. Распределение локомоторной активности по дням 8-суточного периода у двух групп птиц, содержащихся в условиях искусственного освещения (группа № 1 – биоритм локомоторной активности совпадает по фазе с птицами, содержавшимися при естественном освещении, группа № 2 – биоритм локомоторной активности которых был в противофазе с птицами, содержавшимися при естественном освещении). По оси абсцисс – день 8-суточного периода. По оси ординат – % от индивидуального среднего уровня локомоторной активности
Использованный метод наложения эпох позволил установить, что у 1-й группы зябликов из числа птиц, содержавшихся в условиях искусственного освещения, значения уровня локомоторной активности в акрофазе (максимальные значения) приходились на 1-й день этого 8-суточного периода и статистически значимо различались со значениями в батифазе (минимальные значения – 5-й день 8-суточного периода). Для 2-й группы, наоборот, акрофаза уровня локомоторной активности приходилась на 5-й день 8-суточного периода и статистически значимо различалась с ее значениями в батифазе (1-й день 8-суточного периода). Таким образом, все максимумы локомоторной активности приходились либо на 14, 22, 30 сентября, 8 и 16 октября (первая группа), либо на 18, 26 сентября, 4, 12 и 20 октября (вторая группа).
У трех птиц (две молодые при естественном и одна взрослая при искусственном освещении) во вторую половину периода осеннего миграционного беспокойства проявился 4-суточный ритм локомоторной активности с максимумами 7–8, 12, 16, 19–20 и 24 октября (рис. 3).
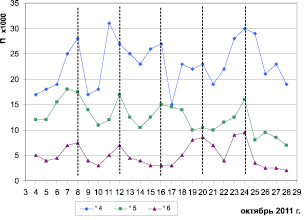
Рис. 3. Динамика уровня локомоторной активности трех самцов зябликов (№ 4 – sad, № 6 – ad при естественном освещение; № 5 – sad при искусственном освещении) в период с 4 по 28 октября 2011 г. По оси абсцисс – порядковый номер суток от начала исследования. По оси ординат – число прыжков за сутки
Рассуждая о возможных внешних синхронизаторах установленного 8-суточного ритма локомоторной активности для птиц, находившихся на естественном освещении, можно предположить чередование ясной и пасмурной погоды. Однако, судя по группе птиц, находившихся в условиях искусственного освещения, в синхронизации миграционной активности птиц участвует неизвестный внешний регулятор. В обоих случаях стимуляция беспокойства возможна только у подготовленных к миграции особей. Этим, вероятно, и объясняется наличие двух групп птиц, динамика локомоторной активности которых находится в противофазе, а акрофазы различаются между собой на четверо суток. Таким образом, каждые 4 суток возникает новая волна пролета мигрирующих птиц, наблюдаемая в природе.
Для многих видов птиц показано, что при миграции отмечается сезонное повышение уровня кортикостерона в сыворотке крови, так как этот гормон необходим для формирования физиологического статуса и мобилизации энергии в этот период [7, 12, 13]. Вероятнее всего, многодневное (инфрадианное) изменение уровня кортикостерона, подчиняющиеся влиянию внешних синхронизаторов, включено в регуляцию волнообразного изменения числа птиц, готовых к перелету.
Немногочисленные исследования многодневной динамики уровня глюкокортикоидных гормонов у млекопитающих указывают на существование около 4-суточного биоритма [5, 9, 11].
Ранее нами был выявлен 4-суточный инфрадианный ритм изменения уровня кортизола у человека и кортикостерона у лабораторных крыс, проявляющийся синхронно у разных особей и видов (с учетом формы суточной активности). Было установлено, что каждые 68–72 сут акрофаза инфрадианного ритма глюкокортикоидных гормонов у всех исследованных видов переходит на сутки вперед, обеспечивая кратность выявленного периода длине астрономического года [1]. Синхронность биоритмов позволила нам создать универсальный календарь наступления акрофаз и батифаз глюкокортикоидных гормонов. Установленная закономерность проявления биоритма у разных особей и видов указывает на наличие внешнего синхронизатора уровня глюкокортикоидных гормонов, природу которого пока трудно установить. Необходимо отметить, что в данном исследовании максимальный уровень локомоторной активности самцов зябликов наблюдался в дни, соответствующие расчетным датам акрофаз выявленного нами 4-суточного ритма изменения уровня глюкокортикоидных гормонов в сыворотке крови у крыс и человека.
При изучении колебаний уровня локомоторной активности у крыс-самцов Вистар нам удалось выявить 4-суточный период и положительную корреляцию с колебаниями уровня кортикостерона в сыворотке крови [2]. Несмотря на то, что птицы эволюционно разошлись с классом млекопитающих около 310 млн лет назад [9], можно предположить, что оба класса имеют сходные физиологические механизмы эндокринной регуляции локомоторной активности. В частности, в работе M.M. Landys и соавт. [10] выявлена положительная корреляция между уровнем кортикостерона и миграционной активностью, определяемой в неволе по уровню локомоторной активности. В качестве одного из претендентов на внешний синхронизатор I. Henshaw и соавт. [6] рассматривают геомагнитное поле, изменяющее гормональную секрецию кортикостерона, являющегося одним из наиболее важных гормональных факторов, обеспечивающих формирование и реализацию миграционного поведения.
Таким образом, в динамике уровня локомоторной активности самцов зябликов, содержавшихся в условиях неволи, во время осеннего миграционного состояния выявлен достоверный, регулярно проявляющийся инфрадианный ритм локомоторной активности с периодом 8 суток и наблюдающийся независимо от условий содержания – при естественном или искусственном освещении. У птиц, содержавшихся при естественном освещении, этот ритм синхронен у разных особей. У птиц, содержавшихся в условиях искусственного освещения, 8-суточный ритм локомоторной активности либо совпадал по фазе, либо находился в противофазе по отношению к фазе этого ритма в группе зябликов, находившихся при естественном освещении. У части птиц в конце миграционного периода установлена ритмичность изменения уровня локомоторной активности с периодом 4 суток. Выявленный характер динамики локомоторной активности птиц объясняет явление волнообразности пролета, наблюдаемое в природе при ежедневной регистрации числа летящих птиц.
Рецензенты:
Корабельникова Н.И., д.м.н., руководитель научно-организационного отдела, ФГБУ «Научно-исследовательский институт морфологии человека» РАМН, г. Москва;
Кондашевская М.В., д.б.н., руководитель группы функциональной морфологии стресса Научно-исследовательского института морфологии человека РАМН, г. Москва.
Работа поступила в редакцию 14.02.2013.
Библиографическая ссылка
Диатроптов М.Е. ИНФРАДИАННЫЙ РИТМ ЛОКОМОТОРНОЙ АКТИВНОСТИ У САМЦОВ ЗЯБЛИКОВ (Fringilla coelebs) В ПЕРИОД ОСЕННЕЙ МИГРАЦИИ // Фундаментальные исследования. 2013. № 4-5. С. 1139-1143;URL: https://fundamental-research.ru/ru/article/view?id=31376 (дата обращения: 01.02.2026).



