Для усовершенствования процессов растворения актуальным является накопление экспериментального материала по кинетике растворения оксида d-металла (оксида кобальта) [1, 2].
В химической и нефтехимической промышленности оксид кобальта используют в качестве катализаторов различных высокотемпературных химических процессов – гидрогенизации жиров, дегидрирования парафинов, синтеза бензина, метана, в производстве азотной кислоты, соды, сульфата аммония, при окислении метана и угарного газа [3, 4].
В металлургии оксид кобальта применяют при изготовлении постоянных магнитов с высокими показателями магнитной энергией и коэрцитивной силой; в производстве сверхтвердых, жаропрочных, инструментальных и износостойких сплавов для авиа-, машино- и ракетостроения, электротехнической и атомной промышленности [5–7].
Литированный оксид кобальта входит в материал катода в литий-ионных и литий-полимерных аккумуляторах для портативных устройств, дающих рабочее напряжение свыше 3 В [8, 9].
Для улучшения экологических характеристик окружающей среды оксид кобальта используют как катализатор при очистке дымовых газов от оксидов азота [10].
В новых технологиях CTL (gas to liquids technologies) по производству жидкого синтетического топлива (синтетической нефти, дизельного топлива, смазочных масел, парафинов) применяют гранулы носителя, пропитанные кобальтом [11].
В связи с ростом потребления и сокращением природных запасов кобальтовых руд и богатых сульфидных месторождений, источником отечественного производства кобальта и его соединений все в большей степени являются обедненные латеритные (окисленные никелевые) руды, содержащие кобальт в виде примеси [12].
Цель исследования состоит в исследовании влияния ионов минеральных кислот (SO42-) на скорость растворения оксида кобальта, а также в описании этого процесса с помощью моделей Бартона – Странского, сжимающегося объема, моделей Ферхюльста и Хоугена – Ватсона.
Материалы и методы исследования
При изучении кинетики растворения порошкообразных образцов кобальта использовали Со3O4 (размер частиц 80…100 мкм). Навеску оксида 0,5 г вводили в реакционный термостатированный сосуд, содержащий 0,5 л водного обескислороженного раствора серной кислоты известной концентрации. Перемешивание раствора осуществляли в режиме (скорость вращения мешалки – 500 об/мин), который обеспечивал движение частиц оксида во взвешенном состоянии, что позволяло устранить диффузные затруднения. Эксперимент проводили при 363 К. Из раствора через фильтр Шотта № 4 (средний диаметр пор 5...15 мкм) периодически отбирали пробы фильтрата объемом 2 мл и фотоколориметрическим методом с помощью роданида калия (ч.д.а.) определяли в них содержание Со2+.
В предварительно проведенных опытах установлено, что скорость растворения оксида металла слабо зависит от скорости вращения мешалки. Для устранения возможных внешних диффузионных затруднений опыты проводили в режиме свободного взвешенного состояния частиц оксида. Раствор перемешивали мешалкой (частота вращения составляла 600–700 об/мин). Кинетические кривые процесса растворения получали при различных значениях рН кислого раствора.
Результаты исследования и их обсуждение
Экспериментальные данные кривых растворения оксида в серной кислоте, представленные на рис. 1, анализировали в координатах α – t, где α – доля растворенного образца, вычисляемая по формуле (α = А/Аχ (А, Аχ – соответственно, оптическая плотность фильтрата в момент времени отбора пробы и при полном растворении навески оксида кобальта)).
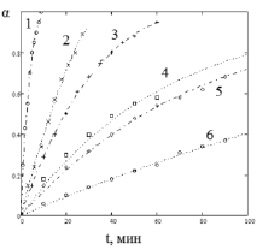
Рис. 1. Зависимость степени растворенного образца (Со3О4) от времени при различной концентрации сульфат-ионов (моль/л): 1 – 10,0; 2 – 5,93; 3 – 2,97; 4 – 1,0; 5 – 0,57; 6 – 0,12 при Т = 363,2 К. Точки – экспериментальные значения, линии – расчет по уравнению (2)
Кинетические кривые α – t растворения оксида в минеральной кислоте имеют S-образный вид (рис. 1), что не противоречит литературным данным [13, 14]. При этом наблюдается полное растворение оксида.
Вычисление кинетических данных. Представляет интерес рассчитать кинетические параметры процесса растворения твердого образца в серной кислоте. Скорость взаимодействия оксидов с минеральной кислотой согласно принципам гетерогенной кинетики лимитируется стадией перехода ионов в раствор электролита. Это позволяет выразить скорость растворения оксида d-металла в виде функции с разделяющимися переменными [14, 15]:
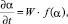 (1)
(1)
где W – удельная скорость растворения оксида, которая определяется концентрациями H+ и SO42- и температурой, f(α) – функция изменения реакционной поверхности в процессе растворения.
Уравнение (1) позволяет объяснить S-образный вид кинетических кривых, согласующихся с экспериментальными данными на рис. 1. Процесс растворения оксида идет по активным центрам (точечные дефекты, дислокации), распределение которых определяется плотностью вероятности на поверхности образца.
Представляют интерес кинетические обоснования процесса растворения. В данной работе мы используем дискретный биномиальный закон распределения вероятностей перехода ионов в раствор.
Интерпретация полученных данных с использованием критерия Фишера показала, что наиболее оптимально описывают исследуемые процессы модели Бартона – Странского и сжимающегося объема [14]. На рис. 2 представлены результаты растворения твердого образца в неорганической кислоте.
Как следует из рис. 2, две предложенные модели идентично описывают кинетические кривые α-τ при определенных значениях (Еа, порядки реакции).
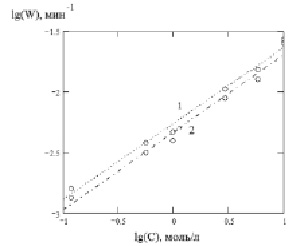
Рис. 2. Зависимость lg(W) от lg(C) для моделей Бартона – Странского (1) и сжимающегося объема (2) при растворении оксида Со3О4 в серной кислоте
Для объяснения процесса растворения d-металлов можно использовать также дискретный биномиальный закон распределения вероятностей перехода ионов в раствор.
В каждом из вероятных переходов ионов случайное событие (А) может осуществиться с вероятностью (р). Тогда случайная величина Х – число появлений события А в данной серии испытаний, имеет биномиальное распределение и соответствует вероятности Бернулли:
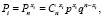 (2)
(2)
где n – число независимых переходов ионов с поверхности оксидов в раствор, p – вероятность перехода ионов в раствор (события А) в каждом испытании; q = 1 – p – вероятность неперехода ионов с поверхности в раствор; С – представляют собой члены бинома Ньютона.
Для описания кинетики растворения оксидов d-металлов в минеральных кислотах применима модель Ферхюльста. Для анализа эмпирических данных использовали уравнение Ферхюльста:
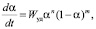 (3)
(3)
где m и n – эмпирические константы.
Уравнение (3) позволяет рассчитать зависимость доли растворенного оксида d-металла от времени (рис. 1). Использование критерия Фишера показывает, что зависимость скорости растворения от доли растворенного образца описывается уравнением логистического типа (3).
Модель Ферхюльста применима для описания кинетики растворения оксидов d-металлов в минеральных кислотах.
Данная модель растворения может быть использована для описания кинетических процессов растворения любых оксидов d-металлов, в том числе для нашего образца – Со3О4. Кривые будут иметь вид аналогичный, представленному на рис. 3.
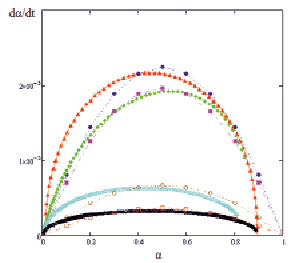
Рис. 3. Скорость растворения оксида d-металла (на примере Fe3O4) (W, мин-1) от α при разных концентрациях серной кислоты. Точками обозначены экспериментальные значения, линиями – графическое изображение уравнения (3)
По Хоугену – Ватсону скорость растворения объекта описывается уравнением [14, 15]:
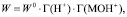 (4)
(4)
где 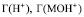 – поверхностные концентрации ионов Н+ и соответствующей частицы на поверхности оксида.
– поверхностные концентрации ионов Н+ и соответствующей частицы на поверхности оксида.
На рис. 4 представлены результаты моделирования процесса растворения оксида кобальта в минеральной кислоте по модели Хоугена – Ватсона. При увеличении концентрации сульфат-ионов 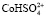 будет определять скорость процесса [13, 14].
будет определять скорость процесса [13, 14].
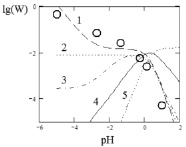
Рис. 4. Модель Хоугена – Ватсона для растворения Со3О4 в серной кислоте. Точками обозначены экспериментальные данные; линиями – графическое решение уравнения (4): 1 – 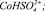 2 –
2 – 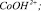 3 –
3 – 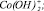 4 –
4 – 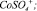 5 –
5 – 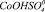
Для определения значений удельной скорости растворения оксида применяли методы нелинейной регрессии с помощью программы MathCad.
Полученные экспериментальные данные (таблица) показали, что порядок реакции по H+ для оксида Co3O4 равен приблизительно 0,5. Зависимость lg W – lg C является линейной, что согласуется с экспериментальными данными, представленными на рис. 2.
Зависимость удельной скорости растворения объекта Co3O4 от концентрации SO42-
|
[SO42-], моль/л |
lg W, мин-1 |
|
Co3O4 |
|
|
0,12 |
–2,9 |
|
0,57 |
–2,5 |
|
1,00 |
–2,4 |
|
2,97 |
–2,1 |
|
5,93 |
–1,9 |
|
10,00 |
–1,6 |
Уравнение (4) показывает связь удельной скорости растворения образца Со3O4 с концентрацией [SO42-]:
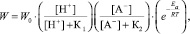 (4)
(4)
где [A-]*[HSO4-], W0 – константа скорости растворения, К1, К2 – постоянные.
Выводы
1. Анализ полученных экспериментальных данных показал, что логистическое уравнение (3) позволяет рассчитать кинетические параметры растворения оксидов в кислых растворах с позиций неравновесной термодинамики.
2. Результаты моделирования процесса растворения оксида кобальта в серной кислоте по модели Хоугена – Ватсона показали, что активными центрами являются частицы 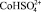 .
.
3. Для объяснения кинетических процессов растворения оксида кобальта неорганических кислотах наиболее оптимальной (по критерию Фишера) является модель Бартона – Странского.



