На территории Томской области расположено одно из крупнейших в мире Бакчарское месторождение железной руды. Вымывание ионов Mn2+ и Fe3+ из железосодержащих минералов приводит к превышению их предельно допустимой концентрации в питьевой воде. ПДК Mn2+ и Fe3+ составляет 0,1 и 0,3 мг/л соответственно [1]. Существует потребность контроля содержания ионов Mn2+ и Fe3+ в большом числе источников питьевой воды с последующей ее очисткой. Современные аналитические методы позволяют решить эту проблему с помощью простых и недорогих тест-систем для контроля качества воды самим потребителем во внелабораторных условиях (on-site) [2, 3]. Таким образом, актуальна как разработка новых способов очистки воды от ионов Mn2+ и Fe3+, так и их тест-определения. Эффективным материалом для этих целей могут служить малоизученные синтетические сорбенты – сульфо- и карбоксильные катиониты гелевой – Токем-140, макропористой – Токем-250, макросетчатой – КБ-2Э-16 структуры. Катиониты синтезированы Кемеровским ООО ПО «Токем». Сильнокислотный сульфокатионит марки Токем-140 является аналогом известного катионита КУ-2-8. Синтезирован на основе стирола и дивинилбензола (ДВБ) по двухступенчатой технологии, позволившей получить монозернистый сорбент с диаметром частиц ~ (0,65 ± 0,05) мм. Катионит может использоваться в широкой области рН, что важно при сорбции легко гидролизующихся ионов Fe3+. Карбоксильные катиониты макропористой – Токем-250 и макросетчатой – КБ-2Э-16 структуры синтезированы на основе полиакриловой кислоты и сшивающих агентов ДВБ и дивинилового эфира диэтиленгликоля (ДВЭДЭГ) соответственно. Основная часть исследований, представленных в литературе, связана с изучением сорбции двухзарядных катионов [4–6]. Менее изучено ионообменное поглощение трехзарядных катионов, особенно сильносшитыми карбоксильными катионитами. Имеющиеся в литературе сведения не дают представления о поглощении ионов из растворов с низкой концентрацией (порядка ПДК в природных водах).
Цель работы – исследование сорбционных свойств катионитов, их избирательности по отношению к ионам Mn2+ и Fe3+ в равновесных и динамических условиях для дальнейшего применения сорбентов.
Материалы и методы исследования
Исследование сорбционных свойств проводили в статических и динамических условиях на Na-форме катионитов КБ-2Э-16, Токем-250 и Н-форме Токем-140 из растворов хлоридов Fe3+ и Mn2+ с рН ~ 4,5 и I = 0,1 (NaCl). Чистота использованных реактивов соответствовала марке ч.д.а. Сорбцию ионов в статических условиях изучали в интервале концентраций (1÷6)·10–3 ммоль/мл. Концентрацию Mn2+ и Fe3+ в равновесных растворах определяли спектрофотометрически по поглощению их комплексов с формальдоксимом и сульфосалициловой кислотой [7, 8] соответственно на спектрофотометре ПЭ-5400уф «ЭКРОС». Время сорбции составляло 24 часа.
Динамику сорбции исследовали методом построения выходных кривых ионов. Скорость фильтрования раствора регулировали с помощью перистальтического насоса типа BT100-2J «Longerpump». Начальная концентрация ионов в растворах составляла 2•10–2 моль/л, ионная сила 0,1 (NaCl), рН ~ 4,5. Содержание Mn2+ и Fe3+ в порциях фильтрата определяли комплексонометрически. Выходные кривые представляли в координатах С/Со=f(Vф), где Vф – объем раствора, прошедшего через колонку, С/Со – отношение концентраций ионов в порции фильтрата и исходном растворе.
Электронные спектры диффузного отражения ионных форм катионитов регистрировали на спектрофотометре UV-2501 PC фирмы «Shimadzu». Катиониты насыщали ионами Mn2+ и Fe3+ из растворов с концентрацией 0,02 моль/л и рН 4,5 и 2,0 соответственно в течение 24 часов. Образцы исследовали во влажном состоянии, т.е. близком к состоянию ионов в растворе.
Результаты исследования и их обсуждение
Для установления рабочего диапазона рН ионитов было проведено потенциометрическое титрование их водородной формы раствором NaOH. Кривые титрования представлены на рис. 1.
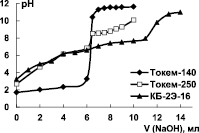
Рис. 1. Кривые титрования Н-формы катионитов Токем-140, Токем-250 и КБ-2Э-16
Ход кривых согласуется с различием в кислотности функциональных групп сорбентов. Рабочий диапазон рН катионитов Токем-140 и КБ-2Э-16, в котором проявляется максимальная емкость, шире, чем Токем-250, и составляет ~2–12 и 3–14 ед. соответственно.
Значения эффективных констант диссоциации функциональных групп (рКа) катионитов рассчитаны с помощью уравнения Гендерсона – Гассельбаха:
рН = рКа – nlg(1 – α)/α,
где α – степень нейтрализации функциональных групп, n – параметр, связанный с изменением электростатической свободной энергии макромолекулы при ее нейтрализации. Полученные значения рКа и соответствующие литературные данные для ионитов подобного типа приведены в табл. 1.
Таблица 1
Значения эффективных констант ионизации функциональных групп и параметра n катионитов
|
Ионит |
рКа |
n |
Примечание |
|
Токем-140 |
2,17 |
– |
– |
|
Токем-250 |
6,59 |
1,29 |
– |
|
КБ-2Э-16 |
6,70 |
2,40 |
– |
|
КБ-2-20 |
7,10 |
– |
[8] |
Значения рКа свидетельствуют о существенном различии кислотного характера функциональных групп сульфо- и карбоксильных катионитов. Сопоставление значений рКа для карбоксильных катионитов различных марок (табл. 1) показывает, что КБ-2Э-16 и Токем-250 обладают более сильными кислотными свойствами по сравнению с их аналогом – сильносшитым катионитом КБ-2-20. Различия кислотных свойств карбоксильных ионообменников обусловлены их структурой.
Для характеристики избирательности поглощения Mn2+ и Fe3+ на Na-форме катионитов КБ-2Э-16, Токем-250 H-форме Токем-140 были построены изотермы сорбции (рис. 2).
Изотермы ионов Mn2+ и Fe3+ имеют выпуклую форму, характерную для избирательного обмена. На кривых изотерм сорбции Mn2+ катионитами КБ-2Э-16 и Токем-250 отмечаются, хотя и не очень явные, точки перегиба. Ступенчатость изотерм может быть признаком существования в ионите нескольких типов функциональных групп с различной избирательностью к поглощаемым ионам [8]. Наибольшая крутизна начальных участков и выпуклость изотерм отмечается для катионита КБ-2Э-16. Это обусловлено повышенной избирательностью поглощения Mn2+. Изотермы сорбции ионов Mn2+ и Fe3+ сульфокатионитом Токем-140 в изученном диапазоне концентраций практически линейны, что может объясняться энергетической однородностью сорбционных центров. Кривая сорбции Fe3+ расположена выше изотермы сорбции Mn2+ вследствие более высокой избирательности поглощения ионов железа (III). По равновесным данным проведен расчет коэффициентов распределения (D) ионов Mn2+ и Fe3+ (табл. 2).
Таблица 2
Значения коэффициентов распределения (D, мл/г) ионов Mn2+ и Fe3+
|
Ион |
D,·104 |
||
|
Токем-140 |
Токем-250 |
КБ-2Э-16 |
|
|
Mn2+ |
0,03 |
0,13 |
0,19 |
|
Fe3+ |
1,9 |
– |
– |
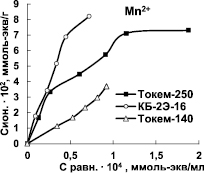
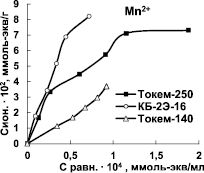
Рис. 2. Изотермы сорбции Mn2+ и Fe3+ на катионитах Токем-140, Токем-250 и КБ-2Э-16
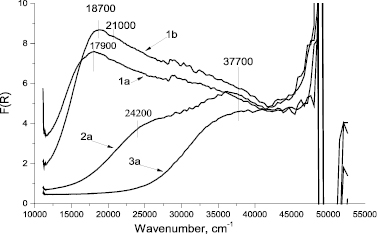
Рис. 3. Спектры ЭСДО образцов катионитов Токем-140 (1), Токем-250 (2), КБ-2Э-16 (3) содержащих ионы a – Mn2+, b – Fe3+
а) б) в)
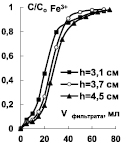
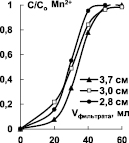
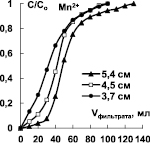
Рис. 4. Выходные кривые сорбции ионов Mn2+ и Fe3+ при различной высоте слоя катионитов Токем-140 (а, б), Токем-250 (в)
Порядок значений коэффициентов распределения (~104) свидетельствует о высокой избирательности поглощения Mn2+ и Fe3+. При этом карбоксильные катиониты Токем-250 и КБ-2Э-16 отличаются повышенным сродством к ионам Mn2+. Такой характер избирательности ионообменников согласуется с химической природой ионов. В соответствии со структурой валентного уровня (d5) ионы Mn2+ имеют симметричное распределение электронной плотности, поэтому они проявляют сродство к кислородсодержащим лигандам – карбоксильным группам, а не к сульфогруппам, как в Токем-140 [9]. Катионит Токем-140 предпочтительнее сорбирует ионы Fe3+ по сравнению с Mn2+, что, вероятно, связано с их большим зарядом и устойчивостью полученного соединения.
Для объяснения различий в избирательности сорбции ионов были зарегистрированы электронные спектры диффузного отражения (ЭСДО) металлсодержащих образцов катионитов КБ-2Э-16, Токем-250 и Токем-140 (рис. 3).
В спектрах ЭСДО марганецсодержащих образцов катионитов Токем-140 и Токем-250 отмечается присутствие полос поглощения 17900 см-1 и 24200 см-1, соответствующих d-d-переходам ионов Mn2+ в октаэдрической координации по кислороду. Для катионита КБ-2Э-16 такие полосы поглощения отсутствуют. Это может быть связано с большим количеством ассоциированных ионов Mn2+ в образцах катионитов. Координацию ионов позволяет определить присутствие широкой полосы поглощения в области 37700 см-1, которая относится к ППЗ лиганд-металл ионов Mn2+ в октаэдрической координации по кислороду.
В спектре ЭСДО катионита Токем-140, содержащем Fe3+, присутствуют полосы поглощения 18700 см-1 и 21000 см-1, соответствующие d-d-переходам катионов в тетраэдрической координации по кислороду. Образование устойчивой тетраэдрической структуры Fe3+ в катионите Токем-140 объясняет большую избирательность поглощения ионов по сравнению с Mn2+.
Выбор сорбента для создания тест-систем, таких как индикаторная трубка, основывается на избирательности сорбции ионов и способности катионита формировать четкие хроматографические зоны в динамических условиях. В этом случае возможно получение линейной зависимости между длиной окрашенного слоя сорбента и концентрацией поглощаемых ионов. Образование зон связано с формированием стационарного фронта сорбции, поэтому его установление явилось одной из задач динамических исследований.
Для установления высоты слоя катионитов Токем-140, Токем-250 и КБ-2Э-16, на которой формируется стационарный фронт, была построена серия выходных кривых ионов Mn2+ и Fe3+. Ход кривых показан на примере катионитов Токем-140 и Токем-250 (рис. 4).
Из рисунка видно, что стационарный фронт сорбции формируется на небольшой высоте слоя катионитов - 2,6÷3,7 см и переносится параллельно. Это согласуется с избирательностью поглощения ионов [10]. Выходные кривые сорбции на карбоксильных катионитах: макропористом Токем-250 и макросетчатом КБ-2Э-16 отличаются от сульфокатионита Токем-140 гелевой структуры меньшим размытием участков в начальной области. Форма выходных кривых на карбоксильных катионитах позволяет предположить, согласно [11], что процесс сорбции лимитируется внутренней диффузией ионов, так как сорбционный фронт размыт в верхнем участке слоя (где концентрация поглощаемых ионов высока), образуя «хвост». В случае сульфокатионита Токем-140 процесс контролируется смешанной диффузией, поскольку размытие фронта имеет место на обоих участках работающего слоя. Выходная кривая близка к симметричной S-образной форме. Сравнение кривых Mn2+ и Fe3+ при сорбции на Токем-140 особых отличий не выявило. Вероятно, механизм кинетики сорбции на катионитах Токем-250, КБ-2Э-16 и Токем-140 связан в первую очередь, с избирательностью поглощения ионов, а не структурой сорбентов.
Выводы
Установлено, что катиониты КБ-2Э-16, Токем-250, Токем-140 обладают широким рабочим диапазоном рН. Исследована избирательность сорбции ионов Mn2+ и Fe3+ катионитами. Коэффициенты распределения, рассчитанные по изотермам сорбции ионов Mn2+ и Fe3+ из разбавленных растворов (10-4–10-3 моль/л), составляют ~ 102–104. Карбоксильные катиониты КБ-2Э-16, Токем-250 проявляют высокую избирательность к ионам Mn2+, а сульфокатионит Токем-140 – к Fe3+. Среди карбоксильных катионитов наибольшая избирательность поглощения Mn2+ отмечается на макросетчатом сорбенте КБ-2Э-16. Различия в избирательности, согласно ЭСДО спектрам солевых форм катионитов, связаны со структурой формирующихся ионитных комплексов металлов.
По выходным кривым сорбции ионов Mn2+ и Fe3+ катионитами показано, что стационарный фронт сорбции формируется на небольшой высоте слоя ~ 3–4 см. Механизм сорбции ионов является смешаннодиффузионным с высоким вкладом внутренней диффузии. Роль внутридиффузионной стадии выше в случае карбоксильного катионита КБ-2Э-16 макросетчатой структуры.
Высокая избирательность катионитов к ионам Mn2+ и Fe3+, формирование стационарного хроматографического фронта ионов позволяет рекомендовать катиониты Токем-140, Токем-250 и КБ-2Э-16 для разработки тест-индикаторных трубок для определения ионов и в качестве фильтров очистки воды.
Работа выполнена при финансовой поддержке РФФИ (грант № 16-33-00374-мол_а).



