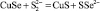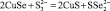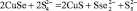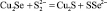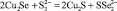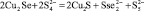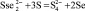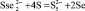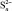Глубокое извлечение селена из сернокислотных растворов, образующихся при переработке медного и медно-никелевого сульфидного сырья, достигается цементацией с использованием медного порошка, в результате чего образуется кек, содержащий до 50 % селена, преимущественно в виде селенидов меди [1–3, 5, 6]. С целью создания эффективного метода для извлечения селена из элементарных и селенидных форм, характеризующегося замкнутостью цикла растворов, исследовано выщелачивание селенсодержащего материала в щелочных серосодержащих растворах, где окислителем селена выступает сера различной степени окисления.
Для принципиальной оценки метода и выбора реагента выполнены термодинамические расчеты вероятности протекания процессов взаимодействия селенидов меди с серосодержащими соединениями в растворах при температурах 298 и 373 К. Ввиду отсутствия в литературе данных о термодинамических характеристиках селенидов меди и селеносульфатов натрия, они были рассчитаны при помощи метода Келли и правила Киреева. Данные методы относятся к аддитивным схемам расчета термодинамических данных, основанным на допущении постоянства инкрементов (составляющих рассматриваемого свойства или параметра), относящихся к определенным атомным группировкам, или на допущении постоянства разности инкрементов, соответствующих замещению данного атома или атомной группировки на другой определенный атом или атомную группировку в разных соединениях.
Согласно [4] были определены значения инкрементов энтропии для ионов Cu+, Cu2+ и Se2– , которые составляют 49,37; 45,61 и 35,56 Дж/моль·К соответственно. С учетом стехиометрии реакции были рассчитаны значения энтропии для селенидов меди 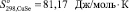 и
и 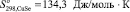 .
.
Энтропия селеносульфита натрия была определена по методу Киреева. Основой сопоставления в методе Киреева является однотипность соединений, то есть аналогичная формула, различающаяся лишь одним элементом, принадлежащим к одной подгруппе периодической системы и находящимся в одинаковом валентном состоянии. Для однотипных соединений двух аналогичных рядов наблюдается постоянство разностей значений энтропий.
Так как соединения Na2SeSO3 и Na2SSO3 являются однотипными, изменение энтропии при реакции (1) равно нулю:
Na2SeSO3 + S = Na2SSO3 + Se; (1)
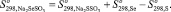 (2)
(2)
Соответственно, по формуле (2) значение энтропии Na2SeSO3 составляет 131,59 Дж/моль·К.
Значения энергии Гиббса и энтальпии для селеносульфата натрия были определены исходя из того, что константа равновесия реакции растворения селена в сульфите натрия (3) близка к единице, поэтому величины 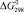 и
и 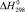 для Na2SO3 и Na2SeSO3 отличаются мало и в первом приближении соответственно равны –1121,81 и –1010,98 кДж/моль.
для Na2SO3 и Na2SeSO3 отличаются мало и в первом приближении соответственно равны –1121,81 и –1010,98 кДж/моль.
Na2SO3 + Se = Na2SeSO3. (3)
Анализ расчетных данных свидетельствует о термодинамической вероятности взаимодействия селенидов меди с серой и полисульфидами. Изменение энергии Гиббса в пересчете на 1 моль селенида незначительно зависит от степени полисульфидности; термодинамическая вероятность вытеснения селена из Cu2Se больше, чем из CuSe. Повышение температуры в свою очередь способствует сдвигу равновесия реакции в сторону вытеснения селена из селенидов серой. Взаимодействие селенидов меди с тиосульфатом маловероятно, а с моносульфидом практически невозможно.
Возможность выделения селена из селеносульфидов, образующихся в результате взаимодействия полиселенидов меди с серой в различных степенях окисления, описывается реакциями 13 и 14 (табл. 2). Равновесие этих реакций сдвигается вправо при понижении температуры и введении серы в раствор из расчета на образование пентасульфида натрия.
Таблица 1
Значения термодинамических констант, принятые в расчетах
|
Вещество |
Фазовое состояние |
|
|
|
|
CuSe Cu2Se CuS Cu2S S2–
Se2–
SSe2–
S Na2SO3 Na2SeSO3 Se |
кр. гекс. к. куб. к. гекс. к. ромб. р-р H2O – – – – – – – – – – к. ромб. р-р ст. р-р ст. к. гекс. |
–39,54 –59,29 –53,14 –79,50 35,35 31,59 28,58 26,40 25,40 132,21 117,99 105,86 97,91 62,76 92,47 0 –1121,81 –1121,81 0 |
– – –53,57 –85,65 91,88 82,63 75,19 69,54 65,65 155,64 125,52 99,58 81,59 81,59 73,22 0 –1010,98 –1010,98 0 |
81,17 134,3 66,53 100 –26,57 23,05 69,79 113,47 154,98 83,68 184,10 271,96 396,82 154,81 322,17 31,80 70,54 131,59 41,84 |
Таблица 2
Расчет изменения энергии Гиббса в процессах взаимодействия серосодержащих соединений с селенидами меди в водных растворах
|
№ п/п |
Реакция |
|
|
|
|
|
Реакции разложения селенидов меди |
|||||
|
1 |
CuSe + S = CuS + Se |
–3,25 |
–1 |
–2,95 |
–2,88 |
|
2 |
CuSe + S 2– = CuS + Se 2– |
19,9 |
23,0 |
13,05 |
11,32 |
|
3 |
|
4,2 |
28,09 |
–4,17 |
–6,58 |
|
4 |
|
8,77 |
53,52 |
–7,18 |
–11,19 |
|
5 |
|
9,05 |
53,0 |
–6,74 |
–10,72 |
|
6 |
CuSe + Na2S2O3 = CuS + Na2SeSO3 |
3,17 |
–1,00 |
3,47 |
3,54 |
|
7 |
Cu2Se + S = Cu2S + Se |
–4,3 |
0 |
–4,3 |
–4,3 |
|
8 |
Cu2Se + S 2– = Cu2S + Se 2– |
18,85 |
23,95 |
11,71 |
9,92 |
|
9 |
|
3,15 |
29,09 |
–5,52 |
–7,70 |
|
10 |
|
5,61 |
55,52 |
–10,93 |
–15,10 |
|
11 |
|
5,89 |
55,0 |
–10,5 |
–14,62 |
|
12 |
Cu2Se + Na2S2O3 = Cu2S + Na2SeSO3 |
1,59 |
–0,705 |
1,79 |
1,82 |
|
Реакции выделения элементарного селена из сульфоселенидных растворов |
|||||
|
13 |
|
–15,79 |
–52,68 |
–0,092 |
3,86 |
|
14 |
|
–16,03 |
–48,2 |
–1,67 |
1,95 |
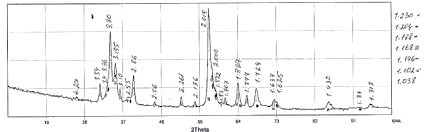
Рис. 1. Данные рентгенодифракционного анализа медного цементата
Эксперименты по выщелачиванию селена в полисульфидных растворах осуществлялись с использованием медного цементата, полученного при цементации селена медным порошком из чистого раствора селенистой кислоты при температуре 25 °С. Согласно данным рентгенодифракционного анализа (использовался дифрактометр ДРОН-6 в FeKα1α2 – излучении с использованием монохроматора (кристалла графита) на первичном пучке) цементатов основной фазой в них является умангит Cu3Se2 и берциалинит Cu2-х Se (рис. 1).
Исходные полисульфидные растворы готовили путем растворения элементарной серы в сернистом натрии, причем количество серы соответствовало заданной степени полисульфидности, которая варьировалась от 2 до 4 [3]. Для придания устойчивости растворам в них вводился едкий натрий в количестве 5–10 г/дм3. Расчет теоретически необходимого количества полисульфида производился на основании следующих реакций:
Cu3Se2 + 3Na2S2 = 3CuS + 3Na2SSe0,7; (4)
2Cu3Se2 + 3Na2S3 = 6CuS + Na2SSe2 + 2Na2SSe; (5)
Cu3Se2 + Na2S4 = 3CuS + 2Na2SSe2. (6)
Из представленных реакций очевидно, что расход реагента на 1 в.ч. селена снижается с повышением степени полисульфидности. Эксперименты осуществлялись в открытых стаканах, при механическом перемешивании, с аналитическим контролем растворов и остатков по селену. Выборочно твердые остатки подвергались рентгеноструктурному анализу.
Результаты экспериментов (табл. 3) свидетельствуют, что извлечение селена в раствор увеличивается от 48 до 61 % при увеличении степени полисульфидности от 2 до 3 (опыты 1 и 6). Дальнейшее увеличение извлечения селена обусловлено не столько ростом полисульфидности, сколько увеличением расхода реагента при неизменном Ж:Т пульпы (оп. 7 и 21, 8 и 22). Поэтому преимущественно эксперименты проводились на растворе полисульфида натрия со степенью полисульфидности 3 (Na2S3).
Установлено, что увеличение концентрации реагента при одинаковом его расходе не сказывается на полноте извлечения селена (оп. 8, 16, 17).
Из сопоставления результатов опытов 17 и 18 следует, что понижение температуры с 90 до 70 °С приводит к снижению извлечения селена с 79 до 70 %. Увеличение продолжительности выщелачивания с одного до трех часов незначительно сказывается на результатах, увеличивая извлечение селена с 81 до 86 % (оп. 7, 8, 10), что свидетельствует о достижении равновесного состояния системы практически за один час.
С использованием всей совокупности экспериментальных данных было оценено влияние на извлечение селена степени полисульфидности и расхода реагента в программе Statistica 10 (Statsoft Inc) (рис. 2).
Соответствующее уравнение регрессии, математически описывающее влияние данных параметров на извлечение селена, имеет вид
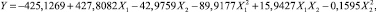 (6)
(6)
где Y – извлечение селена в раствор; Х1 – степень полисульфидности; Х2 – расход полисульфида.
Таблица 3
Разложение селенида меди растворами полисульфидов натрия
|
Номер опыта |
Условия выщелачивания |
Конечный раствор |
Кек |
|||||||||
|
m, г |
CSe, % |
Форма |
Расх., от т.н. |
C, м/л |
ж:т |
εSe, % |
V, мл |
СSe, г/л |
m, г |
Вых., % |
CSe, % |
|
|
1 6 7 8 10 12 16 17 18 21 22 |
5 5 5 5 2,5 2,5 5 10 5 5 2,5 |
49,6 42,0 42,4 49,6 49,6 49,6 49,6 42,4 42,0 42,0 42,0 |
Na2S2 Na2S3 Na2S3 Na2S3 Na2S3.5 Na2S4 Na2S3 Na2S3 Na2S3 Na2S3 Na2S3 |
2,0 2,0 4,5 8,5 10 12 8,5 8,5 8,5 8,5 17 |
0,9 1,7 1,8 1,8 1,8 1,8 3,6 3,6 3,6 3,6 3,6 |
20 5 10 20 20 20 10 10 10 10 20 |
48 61 62 81 83* 74* 81 79 70 86 85 |
100 28 50 100 50 50 50 100 50 50 50 |
11,7 44,5 27,3 18,5 20,6* 18,4* 32,0 34,0 29,2 35,0 16,6 |
4,7 4,51 4,59 4,24 1,69 2,07 4,37 8,89 4,55 4,32 2,07 |
96 90 92 85 68 83 87 89 91 86 83 |
27,0 17,5 18,6 14,2 12,6 15,3 8,49 10,36 14,0 6,81 7,5 |
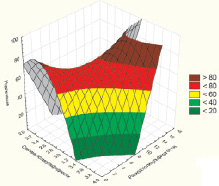
Рис. 2. Зависимость извлечения селена от степени полисульфидности и расхода реагента
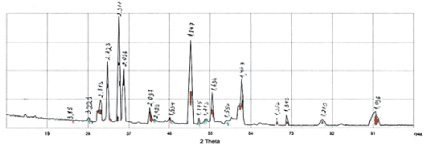
Рис. 3. Дифрактограмма осадка полисульфидного выщелачивания
Таблица 4
Выделение селена из селеносульфидов
|
№ п/п |
Условия разложения |
Нерастворимый остаток |
Конечный раствор |
||||
|
V р-ра, мл |
СSe, г/л |
mS, г |
εSe, % |
m, г |
СSe, г/л |
V, мл |
|
|
1 |
100 |
18,5 |
1,5 |
57 |
1,11 |
7,8 |
98 |
|
2 |
50 |
20,6 |
0,83 |
58 |
0,62 |
8,7 |
50 |
|
3 |
50 |
18,4 |
0,74 |
60 |
0,55 |
7,4 |
49 |
Полученные экспериментальные данные подтверждают принципиальную возможность разложения селенида меди полисульфидными растворами. Для выяснения причины неполного извлечения селена и определения его форм в нерастворимом остатке был выполнен их рентгеноструктурный анализ (рис. 3).
Установлено, что в соответствии с реакциями 2–4 преимущественной фазой в твердом остатке является сульфид меди в гексагональной модификации, а именно – ковеллин CuS. Линии селенида меди расплывчаты и четко не идентифицированы. Возможно изоморфное вхождение селена в структуру ковеллина и наоборот – серы в структуру селенида меди. Последнее предположение объясняет неполное выщелачивание селена с извлечением его в остаток 15–20 %.
Снижение температуры сульфодиселенидного раствора до 20 °С с введением серы из расчета образования пентасульфид-ионов сопровождается извлечением не более 60 % селена в нерастворимый остаток (табл. 4).
Резюмируя, можно сделать следующие выводы:
1. Расчет изменения изобарно-изотермического потенциала реакций гидрохимического взаимодействия селенидов меди различной валентности с серой и полисульфидами свидетельствует об образовании в щелочной среде устойчивых сульфоселенид- и сульфодиселенид- ионов в интервале температур 298–373 К.
2. Закономерности поведения селенида меди в щелочной сернистой среде определяются степенью ее полисульфидности; применение тетрасульфидного раствора обеспечивает максимальный переход селена (до 86 %) в щелочной раствор (90 °С, 8,5-кратный избыток от теоретически необходимого, при продолжительности 3 часа) с концентрированием меди в нерастворимом остатке.
3. Согласно данным дифрактометрического анализа неполное выщелачивание селена из медного цементата обусловлено изоморфным вхождением серы в структуру селенида меди с образованием ковеллина, и наоборот – селена в структуру ковеллина, являющегося преимущественной минеральной фазой кека полисульфидного выщелачивания.
4. Снижение температуры сульфодиселенидного раствора до 20 °С с введением серы из расчета образования пентасульфид-ионов сопровождается извлечением не более 60 % селена в нерастворимый остаток.
Рецензенты:
Бричкин В.Н., д.т.н., заведующий кафедрой металлургии, ФГБОУ ВПО «Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург;
Бажин В.Ю., д.т.н., декан факультета переработки минерального сырья, ФГБОУ ВПО «Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург.




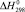 , кДж/моль
, кДж/моль
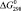 , кДж/моль
, кДж/моль
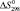 , кДж/моль∙град
, кДж/моль∙град
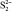
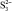
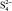
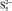
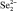
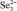
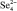
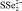
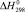 , кДж/моль
, кДж/моль
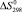 , кДж/моль∙град
, кДж/моль∙град
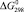 , кДж/моль
, кДж/моль
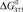 , кДж/моль
, кДж/моль