Вирусные инфекции представляют серьезную угрозу современной цивилизации в связи с чрезвычайно высокими темпами изменчивости вирусов, способности их к длительному персистированию в организме, влиянии на иммунную систему, что делает эрадикацию таких инфекций затруднительной. Летальность от некоторых видов вирусных инфекций остается довольно высокой, несмотря на форсированную разработку вакцин и противовирусных агентов. Актуальность проблемы коморбидности некоторых инфекций, связанной с путями их распространения, в частности ВИЧ и вирусных гепатитов, делает очевидной необходимость поиска соединений, способных оказывать одновременное действие на несколько вирусных мишеней [8].
В качестве исходного билдинг-блока для создания новых потенциальных противовирусных агентов нами предложен фрагмент дифенилового эфира. Диарилэфирный фармакофор является одним из характерных структурных элементов ингибиторов РНК-содержащих вирусов семейства Flaviviridae, таких как вирусы лихорадки Денге, лихорадки Западного Нила (соединение 1) [13], а также вируса гепатита С (2-3) [11, 12].
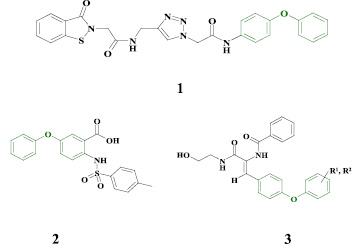
На основе диароматического каркаса были разработаны различные семейства ненуклеозидных ингибиторов обратной транскриптазы (РНК-зависимой ДНК-полимеразы) ВИЧ (ННИОТ), обладающие активностью в диапазоне от микро- до пикомолярного уровня концентраций (4-5) [5, 6, 9, 10].
Замещенные производные 2-тиоурацила зарекомендовали себя как высокоэффективные ингибиторы репродукции ВИЧ [1]. На основе гетероциклического фрагмента 2-тиоурацила разработана группа ННИОТ – S-DABO (дигидроалкилтиобензилокспиримидины), содержащие арильный заместитель в положении 6 и замещенные по атому серы вторым ароматическим фрагментом через ацетамидный линкер (6). Среди производных данного класса известны противовирусные агенты двойного действия, активные в отношении ВИЧ и вируса гриппа (подтипов H1N1 и H3N2) [14, 15].
Целью настоящего исследования является синтез новых 5- и 6-замещенных производных тиоурацила, содержащих диарилэфирный фармакофор, связанный ацетамидным линкером с атомом серы, в качестве потенциальных антивирусных агентов широкого спектра действия.
Результаты исследования и их обсуждение
Синтез целевых S-замещенных производных 2-тиоурацила был проведен в два этапа. На первом этапе взаимодействием тиомочевины и замещенных производных ацетоуксусного эфира (7-15) в растворе метанола в присутствии метилата натрия в качестве основания в соответствии с известной методикой [2, 3] были получены соответствующие 2-тиоурацилы. На втором этапе обработкой тиоурацилов (16-24) 2-хлор-N-(4-феноксифенил)ацетамидом (25), полученным по ранее описанной методике [7], были синтезированы целевые S-(4-феноксифенил)ацетамидные производные 2-тиоурацилов (26-34) [4] (рисунок).
Физико-химические характеристики и выходы целевых продуктов приведены в таблице.
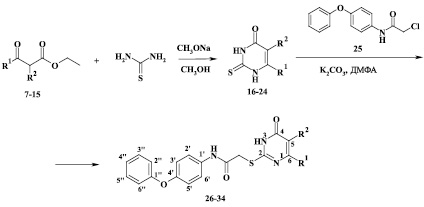
Схема синтеза S-(4-феноксифенил)ацетамидных производных 6-замещенных 2-тиоурацилов
Физико-химические характеристики S-(4-феноксифенил)ацетамидных производных 6-замещенных 2-тиоурацилов
|
Соединения |
R1 |
R2 |
Выход, % |
Тпл, ºC |
Rf* |
|
26 |
CH3 |
H |
76 |
218–220 |
0,21 |
|
27 |
CH3 |
CH3 |
67 |
239–241 |
0,56 |
|
28 |
н–C3H7 |
H |
73 |
218–220 |
0,55 |
|
29 |
CH3 |
C6H5–CH2 |
64 |
220–221 |
0,68 |
|
30 |
CH3 |
C6H5–O– (CH2)2 |
63 |
212–213 |
0,67 |
|
31 |
4–CH3–C6H4–O–CH2 |
H |
72 |
252,5–254,5 |
0,61 |
|
32 |
4–CH3–C6H4–CH2–O–CH2 |
H |
68 |
220–221 |
0,63 |
|
33 |
(C6H5)2–CH–O–CH2 |
H |
75 |
194–195 |
0,66 |
|
34 |
C6H5–O–(CH2)2–O–CH2 |
H |
66 |
198–199 |
0,57 |
Примечание. * толуол-ацетон 1:2.
Материалы и методы исследования
Спектры ЯМР 1H- и 13С регистрировали на спектрометре Bruker Avance-400 (400 МГц для 1H-, 100 МГц для 13С) в ДМСО-D6, внутренний стандарт ТМС. Тонкослойную хроматографию выполняли на пластинах Merck TLC Silica gel 60 F254, проявление в УФ-свете с помощью УФ-лампы VL-6.LC (Франция). Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
2-[(4-Метил-6-оксо-1,6-дигидропиримидин-2-ил)сульфанил]-N-(4-феноксифенил)-ацетамид (26). К раствору 1,00 г (7,00 ммоль) 6-метил-2-тиоксо-2,3-дигидропиримидин-4(1H)-она (16) в 15 мл диметилформамида добавляли 1,16 г (8,40 ммоль) прокаленного калия карбоната. Полученную смесь перемешивали при 80 °С в течение 1 часа, затем охлаждали до комнатной температуре, после чего прибавляли 1,92 г (7,35 ммоль) 2-хлор-N-(4-феноксифенил)ацетамида (25). Полученную смесь перемешивали при комнатной температуре в течение 12 часов, фильтровали, фильтрат упарили в вакууме. К полученному остатку прибавляли 50 мл воды и 5 мл ледяной уксусной кислоты. Выпавший осадок отфильтровали и перекристаллизовывали из смеси изопропанол-диметилформамид (3:1). 1Н ЯМР-спектр, δ, м.д., J (Гц): 2;14 с (3H, CH3), 4;06 с (2H, CH2), 5,99 c (1H, H-5), 6,94–7,00 м (4H, H-2′, H-3′, H-5′, H-6′), 7,07–7,11 м (1H, H-4″), 7,33–7,37 м (2H, H-3″, H-5″) 7,58–7,60 м (2H, H-2″, H-6″), 10,31 c (1H, CO–NH). 13C ЯМР-спектр, δ, м.д.: 23,47; 35,37; 107,05; 118,21; 119,80; 121,20; 123,32; 130,27; 135,10; 152,22; 157,62; 166,12,
Соединения 27-34 были получены аналогично из соответствующих 2-тиоурацилов 17-25 и 2-хлор-N-(4-феноксифенил)ацетамида (25).
2-[(4;5-Диметил-6-оксо-1;6-дигидропиримидин-2-ил)сульфанил]-N-(4-феноксифенил)-ацетамид (27). 1Н ЯМР-спектр, δ, м.д., J (Гц): 1,86 c (3H, C5–CH3), 2,16 с (3H, C6–CH3), 4,03 c (2H, SCH2), 6,94–7,01 м (4H, H-2′, H-3′, H-5′, H-6′), 7,07–7,11 т (1H, J = 7,46; H-4″), 7,34-7,38 м (2H, H-3″, H-5″), 7,57–7,59 м (2H, H-2″, H-6″), 10,28 c (1H, CO–NH), 12,54 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 10,71; 35,21; 118,22; 119,80; 121,18; 123,33; 130,28; 135,12; 152,21; 157,62; 166,18,
2-[(6-Оксо-4-пропил-1;6-дигидропиримидин-2-ил)сульфанил]-N-(4-феноксифенил)-ацетамид (28). 1Н ЯМР-спектр, δ, м.д., J (Гц): 0,73–0,77 т (3H, J = 7,34; CH3), 1,50–1,55 м (2H, CH2–CH3), 2,31-2,34 т (2H, J = 7,34; CH2-C6), 4,04 c (2H, SCH2), 5,95 уш. с (1H, H-5), 6,92–7,01 м (4H, H-2′, H-3′, H-5′, H-6′), 7,07–7,10 т (1H, J = 7,34; H-4″), 7,32–7,38 м (2H, H-3″, H-5″), 7,57–7,61 м (2H, H-2″, H-6″), 10,26 c (1H, CO-NH), 12,56 уш. c (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 13,76; 20,88; 35,37; 118,12; 119,81; 121,04; 123,28; 130,26; 135,31; 152,06; 157,69; 166,00,
2-[(5-Бензил-4-метил-6-оксо-1;6-дигидропиримидин-2-ил)сульфанил]-N-(4-фенокси-фенил)ацетамид (29). 1Н ЯМР-спектр, δ, м.д., J (Гц): 2,15 с (3H, CH3), 3,73 c (2H, CH2–C6H5), 4,06 c (2H, SCH2), 6,93–7,00 м (4H, H-2′, H-3′, H-5′, H-6′), 7,07–7,17 м (4H, H-4″, H-2‴, H-4‴, H-6‴), 7,22–7,25 м (2H, H-3‴, H-5‴), 7,33–7,37 м (2H, H-3″, H-5″), 7,56–7,60 м (2H, H-2″, H-6″), 10,29 c (1H, CO–NH), 12,73 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 30,34; 35,26; 118,23; 119,78; 121,20; 123,34; 126,19; 128,32; 128,63; 130,28; 135,09; 140,08; 152,23; 157,60; 166,08,
2-{[4-Метил-6-оксо-5-(2-феноксиэтил)-1;6-дигидропиримидин-2-ил]сульфанил}-N-(4-феноксифенил)ацетамид (30). 1Н ЯМР-спектр, δ, м.д., J (Гц): 2,24 с (3H, CH3), 2,80–2,83 т (2H, J = 6,8; CH2–С5), 4,00–4,03 т (2H, J = 7,0; CH2O), 4,06 c (2H, SCH2), 6,87–7,01 м (7H, H-2′, H-3′, H-5′, H-6′, H-2‴, H-4‴, H-6‴), 7,07-7,11 т (1H, J = 7,34; H-4″), 7,22-7,26 т (2H, J = 7,83; H-3‴, H-5‴), 7,33–7,37 т (2H, J = 7,95; H-3″, H-5″), 7,58–7,61 м (2H, H-2″, H-6″), 10,30 c (1H, CO-NH), 12,73 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 21,77; 25,61; 35,24; 65,57; 114,60; 118,24; 119,78; 120,77; 121,20; 123,33; 129,78; 130,27; 135,11; 152,25; 157,61; 158,66; 166,11,
2-{[6-Оксо-4-((4-метилфенокси)метил)-1;6-дигидропиримидин-2-ил]сульфанил}-N-(4-феноксифенил)ацетамид (31). 1Н ЯМР-спектр, δ, м.д., J (Гц): 2,20 с (3H, CH3), 4,09 c (2H, SCH2), 4,81 c (2H, CH2–С6), 6,12 уш. с (1H, H-5), 6,78–6,80 д (2H, J = 8,56; H-3′, H-5′), 6,92–6,94 д (2H, J = 7,83; H-2‴, H-6‴), 6,98–7,00 м (2H, H-2′, H-6′), 7,03–7,10 м (3H, H-4″, H-3‴, H-5‴), 7,31–7,35 м (2H, H-3″, H-5″), 7,61–7,63 д (2H, J = 9,05; H-2″, H-6″), 10,30 c (1H, CO–NH), 12,81 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 20,37; 35,50; 68,68; 114,77; 118,19; 119,81; 121,19; 123,31; 130,25; 135,15; 152,24; 155,76; 157,61; 166,00,
2-{[4-(((4-Метилбензил)окси)метил)-6-оксо-1;6-дигидропиримидин-2-ил]сульфанил}-N-(4-феноксифенил)ацетамид (32). 1Н ЯМР-спектр, δ, м.д., J (Гц): 2,26 с (3H, CH3), 4,04 c (2H, SCH2), 4,24 c (2H, CH2–С6), 4,50 c (2H, CH2–C1‴), 6,13 уш. с (1H, H-5), 6,94–6,98 м (4H, H-2′, H-3′, H-5′, H-6′), 7,08–7,14 м (3H, H-4″, H-3‴, H-5‴), 7,20–7,22 м (2H, H-2‴, H-6‴), 7,33–7,37 м (2H, H-3″, H-5″), 7,54–7,56 м (2H, H-2″, H-6″), 10,24 c (1H, CO–NH), 12,70 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 21,06; 35,37; 70,72; 72,27; 118,22; 119,76; 121,23; 123,34; 128,04; 129,21; 130,28; 153,03; 137,15; 152,24; 157,61; 165,96,
2-{[4-((Дифенилметокси)метил)-6-оксо-1;6-дигидропиримидин-2-ил]сульфанил}-N-(4-феноксифенил)ацетамид (33). 1Н ЯМР-спектр, δ, м.д., J (Гц): 4,00 c (2H, SCH2), 4,23 c (2H, CH2-C6), 5,59 c (1H, CH), 6,21 уш. с (1H, H-5), 6,94–6,98 м (4H, H-2′, H-3′, H-5′, H-6′), 7,09-7,13 м (1H, H-4″), 7,21–7,25 м (2H, H-3″, H-5″), 7,30–7,40 м (10H, ароматические H), 7,47–7,50 м (2H, J = 8,8; H-2″, H-6″), 10,18 c (1H, CO-NH), 12,77 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 35,35; 69,54; 82,80; 118,31; 119,71; 121,24; 123,39; 126,82; 127,80; 128,78; 130,29; 134,94; 142,24; 152,29; 157,58,
2-[(6-Оксо-4-((2-феноксиэтокси)метил)-l,6-дигидропиримидин-2-ил]сульфанил}-N-(4-феноксифенил)ацетамид (34). 1Н ЯМР-спектр, δ, м.д., J (Гц): 3,79–3,82 дд (2H, J = 5,38 и 3,67; C6–CH2–O–CH2), 4,06 c (2H, SCH2), 4,08–4,10 дд (2H, J = 5,38 и 3,42; C6H5–O–CH2), 4,33 c (2H, CH2–C6), 6,17 уш. с (1H, H-5), 6,90–7,00 м (7H, H-2′, H-3′, H-5′, H-6′, H-2‴, H-4‴, H-6‴), 7,07–7,11 м (1H, H-4″), 7,24–7,28 м (2H, H-3‴, H-5‴), 7,33–7,37 м (2H, H-3″, H-5″), 7,57–7,61 м (2H, H-2″, H-6″), 10,27 c (1H, CO–NH), 12,74 уш. с (1H, N3H). 13C ЯМР-спектр, δ, м.д.: 35,38; 67,23; 69,50; 71,76; 114,73; 118,23; 119,78; 120,95; 121,21; 123,34; 129,80; 130,28; 135,08; 152,26; 157,59; 158,71; 165,95,
Выводы
Осуществлен синтез 9 новых, не описанных в литературе S-ацетанилидных производных 2-тиоурацила, содержащих диарилэфирный фармакофор. Полученные соединения рассматриваются как перспективные противовирусные агенты.
Рецензенты:
Ганичева Л.М., д.фарм.н., доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения, Волгоградский государственный медицинский университет, г. Волгоград;
Симонян А.В., д.фарм.н., профессор кафедры фармацевтической технологии и биотехнологии, Волгоградский государственный медицинский университет, г. Волгоград.



