Первопричиной коррозии металлов является их термодинамическая неустойчивость в различных средах при данных внешних условиях, поэтому роль термодинамики в теории коррозии достаточно велика [1]. Однако методы классической термодинамики с использованием термодинамических потенциалов не могут адекватно описать сложный и многостадийный процесс коррозии металла. Поэтому привлекаются методы химической кинетики [7], статистические [10], стохастические [9] и другие методы.
В настоящей работе мы используем метод неравновесной термодинамики для описания коррозии металла. Метод является довольно общим и зарекомендовал себя неплохо при рассмотрении процессов различной природы, где наблюдается отклик системы на внешнее воздействие [4–6].
Термодинамическая модель
Мы рассмотрим, следуя работе [5], вопрос отклика подсистемы дефектов (центров коррозии) в металлах на внешнее воздействие (окислительный процесс на поверхности металла) с позиций неравновесной статистической термодинамики.
Дефекты поверхности металла (центры коррозии) будем рассматривать как систему невзаимодействующих частиц, погруженную в термостат. Квантовые переходы, обусловленные взаимодействием дефектов с термостатом, будут диссипативными (с вероятностью Р) в отличие от взаимодействия с внешним полем (с вероятностью F). Поскольку в процессе коррозии подсистема дефектов обменивается с термостатом только энергией, то соответствующий им ансамбль частиц будет каноническим. В этом случае выражение для статистической энтропии имеет вид
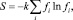 (1)
(1)
где fi – функция распределения; k – постоянная Больцмана.
Дифференцируя (1) по времени и преобразуя, получим
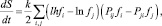 (2)
(2)
где Pij – вероятность перехода из начального i (с энергией Ei) в возбужденное состояние j (с энергией Ej).
Для диссипативных процессов принцип детального равновесия имеет вид
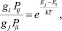 (3)
(3)
где gi, gj – статистические веса для уровней Ei и Ej.
Тогда (2) примет вид
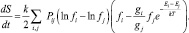 (4)
(4)
Опуская промежуточные вычисления (см. [5]), пренебрегая малыми членами и заменяя в (4) сумму интегралом, получим
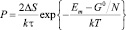 , (5)
, (5)
где ΔS – изменение энтропии в диссипативном процессе; Em – среднее значение энергии основного состояния дефектов; τ – время релаксации; N – среднее число дефектов; G0 – энергия Гиббса термостата.
Для функции отклика Ф системы на внешнее поле имеем
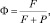 (6)
(6)
где Р – вероятность диссипативного процесса и определяется (5); F определяет вероятность перехода в возбужденное состояние за счет первичного внешнего поля, причем F = 1/τр, где τр – время жизни возбужденного состояния. С учетом (5) выражение (6) примет вид
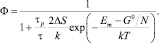 (7)
(7)
Коррозионная стойкость чистых металлов
Если в качестве функции отклика Ф взять площадь коррозионного пятна S, то после линеаризации (7), получим
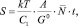 (8)
(8)
где А – работа «внешних сил»; Т – температура; G0 – потенциал Гиббса массивного образца металла; 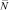 – среднее число центров коррозии; t – время протекания процесса коррозии (t = τ); k – постоянная Больцмана, С1 – постоянная.
– среднее число центров коррозии; t – время протекания процесса коррозии (t = τ); k – постоянная Больцмана, С1 – постоянная.
Работа «внешних сил» равна изменению стандартного термодинамического потенциала ΔGT, который является основой термодинамики коррозии и может быть определен через константу химического равновесия Кp по формуле [1]:
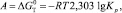 (9)
(9)
Потенциал Гиббса массивного образца металла совпадает с его химическим потенциалом или энергией Ферми, т.е. G0 = EF. Для расчета энергии Ферми воспользуемся моделью Зоммерфельда, в которой распределение электронов по скоростям описывается статистикой Ферми – Дирака [2]:
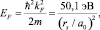 (10)
(10)
где kF – волновой вектор Ферми; rs – радиус сферы, объем которой равен объему, приходящемуся на один электрон проводимости; m – масса электрона; а0 – радиус атома водорода.
В соответствии с этой моделью rs вычисляется по формуле
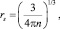 (11)
(11)
где n – плотность электронов проводимости, которая равна: 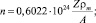 А – относительная атомная масса металла; Z – число электронов на внешнем уровне металла; rm – массовая плотность метала (г/см3).
А – относительная атомная масса металла; Z – число электронов на внешнем уровне металла; rm – массовая плотность метала (г/см3).
Результаты расчета энергии Ферми представлены в табл. 1.
Таблица 1
Энергия Ферми некоторых металлов
|
Металл |
EF, эВ |
Металл |
EF, эВ |
Металл |
EF, эВ |
Металл |
EF, эВ |
|
Na |
3,54 |
Ba |
4,01 |
Pb |
6,67 |
W |
10,42 |
|
K |
2,30 |
Al |
6,32 |
Cu |
7,93 |
Mn |
12,25 |
|
Rb |
2,00 |
Ga |
5,69 |
Ag |
6,15 |
Tc |
10,99 |
|
Cs |
1,73 |
In |
4,68 |
Au |
6,23 |
Re |
10,80 |
|
Be |
15,85 |
Tl |
4,38 |
Zn |
10,59 |
Fe |
12,72 |
|
Mg |
8,00 |
Si |
8,84 |
Cd |
8,42 |
Co |
13,22 |
|
Ca |
5,27 |
Ge |
8,04 |
Cr |
7,80 |
Ni |
13,22 |
|
Sr |
4,43 |
Sn |
7,26 |
Mo |
6,57 |
Ti |
8,53 |
Из формулы (8) и табл. 1 видно, что коррозионная стойкость наименьшая для щелочных и щелочноземельных металлов, имеющих наименьшую энергию Ферми. Однако в формулу (8) входит большее число параметров и судить о коррозионной стойкости только по величине энергии Ферми нельзя.
На самом деле коррозия начинается с поверхностного слоя и поэтому в формуле (8) следует сделать замену –
G0 = σ∙S0,
где σ – поверхностное натяжение; S0 – удельная поверхность.
Как показано в работе [8], величина поверхностного натяжения металла связана с его температурой плавления соотношением: σ = 10–4 Тпл. По данным работы [3], эти значения приведены в табл. 2.
Из табл. 2 следует, что коррозионная стойкость чистых металлов возрастает с ростом температуры плавления. Беря в качестве функции отклика в (8) толщину корродируемого слоя h, для скорости коррозии (vкор = h/t), которая определяется экспериментально, окончательно получим выражение
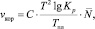 (12)
(12)
где постоянная С включает все постоянные величины из предыдущих формул.
Таблица 2
Температура плавления некоторых чистых металлов [10]
|
Металл |
Тпл, К |
Металл |
Тпл, К |
Металл |
Тпл, К |
Металл |
Тпл, К |
|
Na |
371 |
Tl |
576 |
Cd |
594 |
Ce |
1077 |
|
K |
337 |
Si |
1686 |
Hg |
234 |
Pr |
1208 |
|
Rb |
312 |
Ge |
1231 |
Cr |
2173 |
Nd |
1298 |
|
Cs |
302 |
Sn |
505 |
Mo |
2873 |
Sm |
1325 |
|
Be |
1558 |
Pb |
600 |
W |
3673 |
Eu |
1175 |
|
Mg |
923 |
Se |
493 |
Mn |
1517 |
Gd |
1585 |
|
Ca |
1118 |
Te |
725 |
Tc |
2473 |
Tb |
1631 |
|
Sr |
1030 |
Cu |
1356 |
Re |
3423 |
Dy |
1680 |
|
Al |
933 |
Ag |
1234 |
Fe |
1808 |
Ho |
1734 |
|
Ga |
302,8 |
Au |
1336 |
Co |
1763 |
Er |
1770 |
Заключение
Несмотря на простоту формул (8) и (12) они могут быть полезными для исследования процессов коррозии любых конструкционных материалов, поскольку включают в себя легко определяемые в эксперименте параметры.
Рецензенты:
Портнов В.С., д.т.н., профессор, начальник УПО, Карагандинский государственный технический университет, г. Караганда;
Жакатаев Т.А., д.т.н., старший преподаватель кафедры ММ и Н, Карагандинский государственный технический университет, г. Караганда.
Работа поступила в редакцию 17.03.2015.



