В современных условиях интенсивного ведения животноводства животные находятся под постоянным воздействием стресс-факторов. В связи с этим особый интерес вызывает разработка новых кормовых добавок, позволяющих повысить иммунитет и устойчивость животных к неблагоприятным факторам внешней среды. По сути, кормовые добавки – это реальная возможность улучшить усвоение питательных веществ организмом и организовать полноценное кормление животных в жестких условиях их эксплуатации.
В нашей стране около 30 % всех почв являются экологически неблагополучными. Как правило, ухудшение состояния почвы происходит за счет засоленности, поступления в нее тяжелых металлов и нефтепродуктов. Таким образом, кормовая база для сельскохозяйственных животных постоянно находится под угрозой экотоксикации [3]. Поэтому особого интереса заслуживают экологически чистые добавки природного происхождения.
Последнее время широко стали изучать кормовые препараты на основе гуминовых веществ. Гуминовые вещества входят в состав растительных тканей, торфа, различных углей, придонных органических остатков и др., выполняя ряд разнообразных функций [6]. Специфические свойства продуктов из гуминовых кислот позволяют применять их в промышленности, сельском хозяйстве, экологии и биомедицине [7].
В настоящее время отечественный рынок интенсивно пополняется гуминовыми препаратами, производимыми в России и за рубежом из бурого угля, торфа, сапропеля. Однако практически все гуминовые препараты не стандартизированы, так как содержание в различных партиях действующего вещества (ДВ) гуминовых кислот различается на 10–15 %. Поэтому в литературе часто публикуются разноречивые данные об эффективности того или иного гумата [4].
При использовании инновационных биологических добавок в кормлении животных важным показателем является санитарное благополучие, доброкачественность и нетоксичность получаемого продукта [2]. Гуминовые вещества, являясь биологически активными соединениями, при их обработке, специфической в каждом конкретном случае, могут быть источниками новых разнообразных биологически активных веществ [1]. Поэтому каждый отдельно взятый полученный гуминовый препарат требует тщательного изучения, в том числе и на предмет его токсичности по отношению к животному организму.
Материал и методы исследований
Целью данных исследований было определение острой токсичности гуминовой кормовой добавки «Питэр Пит», представляющей собой гумат калия, полученный из низинного торфа месторождения Рязанской области. Препарат отличается экологичностью и высокой концентрацией активных гуминовых кислот и фульвокислот (36,74 г/л), производится в виде гомогенной коллоидной суспензии темно-коричневого цвета, со специфическим запахом, влажностью около 80 %.
Работа проведена на белых беспородных мышах со средней живой массой 22 г. В каждой группе было по 10 животных (5 самцов и 5 самок). Всего было сформировано 6 групп (3 опытные и 3 контрольные). Животные содержались в стандартных клетках при 12-часовом режиме освещения и свободном доступе к корму и воде (автопоилки) в соответствии с нормами, утвержденными МЗ РФ. Контрольные животные содержались в аналогичных условиях.
Исследование острой токсичности кормовой добавки проводилось в соответствии с рекомендуемой методикой [5]. Изучаемый препарат вводили однократно перорально при помощи зонда, натощак, после двенадцати часов голодной выдержки. Корм животным давали через 3 часа после введения.
Схема введения препарата (водный раствор):
1 опытная группа – 0,5 мл на 1 кг живой массы;
2 опытная группа – 5 мл на 1 кг живой массы;
3 опытная группа – 50 мл на 1 кг живой массы.
Каждой опытной группе соответствовала контрольная, где мышам вводили стерильную питьевую воду в объеме, аналогичном дозе применяемого препарата для опытных животных.
После введения препарата животные находились под наблюдением в течение 2 недель. В первый день после введения наблюдение велось постоянно. В начале и конце эксперимента животных взвешивали.
По окончании опыта был проведен анализ морфологический и биохимический анализ крови мышей, произведено вскрытие с макроскопическим исследованием внутренних органов.
Определение раздражающего эффекта по кожной пробе проводилось на 10 кроликах-самцах при нанесении препарата на кожные покровы (метод испытания ГОСТ Р 52337-2005). Животные ранее не подвергались токсическому воздействию. Экстракт наносили двукратно, наблюдали за реакцией в течение 3 суток после повторного нанесения.
Результаты исследований и их обсуждение
При введении препарата в дозах, не превышающих 50 мл на 1 кг живой массы, летальности выявлено не было. Не было отмечено изменений общего клинического состояния, поведения, потребления корма и воды (за исключением 3 опытной группы, где потребление корма снизилось на 3,6 %). Все изучаемые показатели не отличались от соответствующих параметров у животных контрольной группы и соответствовали нормам.
За период исследований живая масса мышей, получавших кормовую добавку в количестве 0,5 мл/кг, увеличилась на 3,1 % (Р ≤ 0,01), во 2 опытной группе изменений живой массы практически не произошло. Мыши, получавшие препарат в количестве более 50 мл/кг, снизили живую массу на 11 % (Р ≤ 0,01). В контрольных группах существенных изменений не произошло, но проявилась тенденция к увеличению живой массы.
Изменение живой массы представлено на рисунке.
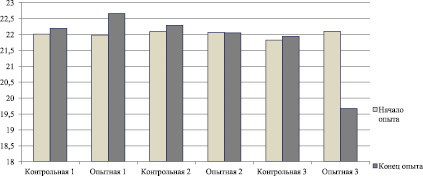
Изменение живой массы мышей в период исследований
Таблица 1
Морфологический состав крови мышей
|
Группа |
Показатель |
||
|
эритроциты, 1012/л |
лейкоциты, 109/л |
гемоглобин, г/л |
|
|
В начале опыта |
|||
|
1 контрольная |
7,1 ± 0,07 |
10,3 ± 0,13 |
95,3 ± 4,61 |
|
1 опытная |
7,3 ± 0,09 |
10,5 ± 0,11 |
96,1 ± 5,31 |
|
2 контрольная |
7,4 ± 0,06 |
10,7 ± 0,15 |
96,7 ± 5,22 |
|
2 опытная |
7,5 ± 0,08 |
10,6 ± 0,10 |
94,5 ± 4,93 |
|
3 контрольная |
7,4 ± 0,08 |
10,4 ± 0,12 |
95,8 ± 6,21 |
|
3 опытная |
7,2 ± 0,10 |
10,3 ± 0,14 |
94,6 ± 6,32 |
|
В конце опыта |
|||
|
1 контрольная |
7,2 ± 0,06 |
10,5 ± 0,12 |
95,7 ± 4,80 |
|
1 опытная |
7,6 ± 0,09*** |
11,3 ± 0,13*** |
102,1 ± 6,91 |
|
2 контрольная |
7,2 ± 0,08 |
10,6 ± 0,14 |
96,1 ± 5,70 |
|
2 опытная |
7,8 ± 0,12*** |
11,2 ± 0,11*** |
101,4 ± 7,70 |
|
3 контрольная |
7,4 ± 0,07 |
10,3 ± 0,09 |
95,5 ± 6,02 |
|
3 опытная |
7,5 ± 0,09 |
10,5 ± 0,11 |
96,7 ± 7,23 |
Примечание. *** Р ≤ 0,01.
Оценка морфологических показателей крови подопытных мышей показала, что содержание форменных элементов: эритроцитов, лейкоцитов и гемоглобина – было выше показателей контрольных групп, но в пределах физиологической нормы (табл. 1).
Изменения по уровню гемоглобина были недостоверны, то есть можно говорить только о тенденции к увеличению этого показателя в опытных группах.
Увеличение количества эритроцитов и лейкоцитов в крови мышей 1 и 2 опытных групп было существенным, так, по уровню эритроцитов разница по сравнению с контролем составила соответственно 5,6 и 8,3 %, по уровню лейкоцитов – 7,6 и 5,7 %.
Результаты исследований общего белка, его фракций и глюкозы в крови мышей представлены в табл. 2.
Как видно из данных таблицы, показатели белкового и углеводного обмена не выходили за пределы физиологической нормы и наблюдалась тенденция повышения общего количества белка, альбуминов и глюкозы в крови мышей опытных групп.
Таблица 2
Биохимический состав крови мышей
|
Группа |
Показатель |
||
|
общий белок, г/л |
альбумины, г/л |
глюкоза, ммоль/л |
|
|
В начале опыта |
|||
|
1 контрольная |
69,3 ± 0,91 |
31,8 ± 0,91 |
4,93 ± 0,72 |
|
1 опытная |
69,7 ± 1,22 |
33,1 ± 0,78 |
5,12 ± 0,63 |
|
2 контрольная |
69,4 ± 0,70 |
32,3 ± 0,90 |
5,03 ± 0,54 |
|
2 опытная |
69,2 ± 1,10 |
32,8 ± 1,04 |
4,96 ± 0,61 |
|
3 контрольная |
69,0 ± 1,30 |
32,2 ± 0,55 |
5,11 ± 0,69 |
|
3 опытная |
70,1 ± 1,11 |
33,2 ± 1,03 |
4,93 ± 0,42 |
|
В конце опыта |
|||
|
1 контрольная |
69,4 ± 1,02 |
31,5 ± 0,92 |
5,01 ± 0,69 |
|
1 опытная |
71,6 ± 1,41 |
36,2 ± 1,30*** |
5,35 ± 0,41 |
|
2 контрольная |
69,2 ± 0,80 |
32,6 ± 1,11 |
5,10 ± 0,70 |
|
2 опытная |
70,8 ± 1,34 |
33,9 ± 0,82 |
5,18 ± 0,72 |
|
3 контрольная |
69,3 ± 1,29 |
32,2 ± 0,68 |
5,16 ± 0,71 |
|
3 опытная |
70,4 ± 1,01 |
33,4 ± 1,10 |
4,97 ± 0,53 |
Примечание. *** Р ≤ 0,01.
Таблица 3
Масса внутренних органов мышей
|
Группа |
Доза препарата, мл/кг |
Масса, мг |
||
|
печень |
почки |
селезенка |
||
|
1 контрольная |
– |
1317 ± 102 |
149 ± 31 |
170 ± 34 |
|
1 опытная |
0,5 |
1322 ± 115 |
152 ± 35 |
171 ± 30 |
|
2 контрольная |
– |
1328 ± 118 |
153 ± 33 |
173 ± 29 |
|
2 опытная |
5,0 |
1392 ± 114 |
159 ± 28 |
177 ± 32 |
|
3 контрольная |
– |
1320 ± 104 |
151 ± 29 |
171 ± 32 |
|
3 опытная |
50,0 |
1570 ± 98* |
167 ± 31 |
183 ± 27 |
Примечание. *Р ≤ 0,1.
При вскрытии и макроскопическом исследовании внутренних органов у мышей 1 и 2 опытных групп патологических изменений внутренних органов обнаружено не было. Кожа и шерсть без видимых изменений, внутренние органы нормального размера, формы и топографического расположения, признаки отечности, раздражения и кровоизлияний отсутствовали. В 3 опытной группе, при введении препарата в дозе, превышающей рекомендуемую в 100 раз (50 мл/кг), у всех животных было обнаружено увеличение печени, почек и селезенки, у 3 мышей – гиперемия желудка и кишечника (табл. 3).
При местном накожном применении исследуемый препарат не оказал раздражающего действия. Воспалительная реакция отсутствовала, не было выявлено следов покраснений, шелушения, болезненности, уплотнений, отечности и других проявлений. Животные чувствовали себя нормально, не проявляя признаков беспокойства, не отмечено изменений в поведении, температуры тела и других показателей, характеризующих общее клиническое состояние животных.
Вывод
Таким образом, изучаемая гуминовая кормовая добавка при однократном пероральном введении в дозах до 50 мл/кг не вызывает летальности. В большем количестве ввести препарат внутрь не представляется возможным, что является основанием для установления IV класса опасности – малоопасные вещества.
Препарат положительно влияет на состояние организма животных при применении в малых дозах и может быть рекомендован к применению для сельскохозяйственных животных.
Рецензенты:
Коровушкин А.А., д.б.н., профессор, Рязанский государственный агротехнологический университет имени П.А. Костычева, г. Рязань;
Морозова Н.И., д.с.-х.н., профессор, Рязанский государственный агротехнологический университет имени П.А. Костычева, г. Рязань.
Работа поступила в редакцию 10.04.2015.



