В настоящее время в нашем регионе актуальным становится проблема загрязнения окружающей среды тяжелыми цветными металлами, в частности, кадмием. Основными источниками поступления в окружающую среду экотоксиканта кадмия являются промышленные предприятия, производство пестицидов, удобрений, теплоэнергетические предприятия мусоросжигательных установок, а также горнодобывающая промышленность [2, 4]. Кадмий – один из самых токсичных тяжелых цветных металлов, отнесен к 1-му классу опасности, обладает эмбриотоксичностью и канцерогенностью [3, 11]. При проникновении в клетки организма он накапливается в митохондриях, лизосомах и ядре, вызывая их ультраструктурные изменения, вступает во многие химические реакции, основными из которых является взаимодействие с сульфгидрильными группами белков и ферментов. При блокировании SH-групп энзимы теряют каталитическую активность, вызывая нарушение процессов метаболизма, снижение энергообразования и функционального состояния клеток. Основным из патогенетических механизмов, индуцирующих нефротоксическое действие ионов тяжелых металлов, является перекисное окисление липидов. Процесс пероксидации сопровождается деформацией липопротеиновых комплексов клеточных мембран, изменением физико-химических свойств и активности мембраносвязанных ферментов, в частности, Nа, К-АТФ-азы. Нарушение динамического равновесия системы ПОЛ – АОС сопровождается снижением содержания NO, одного из основных вазодилатирующих факторов. Oдной из причин сниженного содержания NO может быть его взаимодействие с О2-, с образованием пероксинитрита, а также нарушение функционирования фермента NO-синтазы – NOS(3). В результате этих изменений развивается дисфункция эндотелия, являющаяся фактором риска развития гемодинамических нарушений и функционального состояния внутренних органов [5, 6]. Как и многие другие металлы, кадмий имеет тенденцию к накоплению в организме, период его полувыведения составляет 10–35 лет. Кадмий, обезвреживаясь в печени, повреждает ее и выводится через почки, вызывая развитие нефропатии [1, 9].
Целью нашего исследования было изучение влияния сульфата кадмия на показатели системы ПОЛ – АОС, содержание суммарных метаболитов NO и активности мембранных ферментов.
Материалы и методы исследования
Исследования проводились на крысах-самцах линии Вистар, массой 200–280 гр. Эксперимент проводился на 2-группах животных: 1-я группа – контрольная, 2-я группа – животные с интоксикацией сульфатом кадмия разной дозировки и длительностью введения. Модель кадмиевой интоксикации создавали путем ежедневного подкожного введения сульфата кадмия в течение 1 месяца в дозах: 0,8 мг/кг, 1 мг/кг и 1,5 мг/кг массы тела.
Для выяснения метаболических изменений исследовали интенсивность ПОЛ в эритроцитах, гомогенатах коркового и мозгового слоев почечной ткани, которую оценивали по концентрации вторичного продукта ПОЛ – МДА; его определяли колориметрически с тиобарбитуровой кислотой по методу Asacawa (1980) [12]. О состоянии АОЗ судили по активности СОД, которую определяли методом аутоокисления адреналина, каталазы – методом Королюка М.И (1988) [8] и концентрации церулоплазмина (метод Равина) [7]. Содержание суммарных метаболитов оксида азота (NOх) определяли по реакции деазотирования с реактивом Грисса [10]. Индикаторами мембранных повреждений являлись ферменты – Na, K, АТФ-аза и ГГТП. Весь полученный материал обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента на ПК по программе Microsoft Excel 2006.
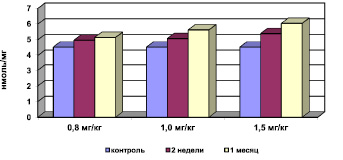
Рис. 1. Концентрация МДА в мембранах эритроцитов при хронической интоксикации, вызванной разными дозами сульфата кадмия
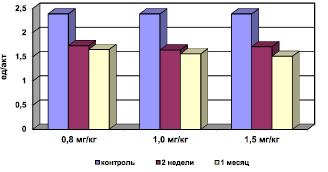
Рис. 2. Активность супероксиддисмутазы в сыворотке крови при хронической интоксикации, вызванной разными дозами сульфата кадмия
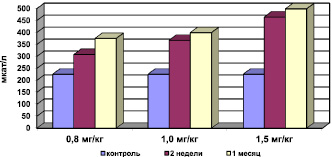
Рис. 3. Активность каталазы в сыворотке крови при хронической интоксикации, вызванной разными дозами сульфата кадмия
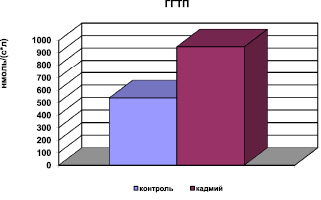
Рис. 4. Активность ГГТП в сыворотке крови при хронической интоксикации, вызванной сульфатом кадмия
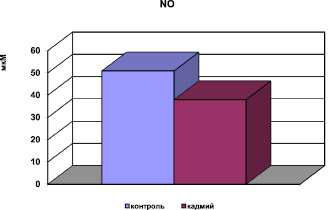
Рис. 5. Концентрация NO в сыворотке крови при хронической интоксикации, вызванной сульфатом кадмия
Результаты исследования и их обсуждение
Было выявлено, что на фоне интоксикации сульфатом кадмия отмечается активация процессов свободно-радикального окисления (СРО). Результаты исследований свидетельствуют о статистически достоверном повышении концентрации МДА в мембранах эритроцитов (рис. 1), снижении активности СОД (рис. 2) при компенсаторном возрастании активности каталазы (рис. 3), превращающей перекись водорода в молекулу воды и кислорода, и концентрации ЦП в сыворотке крови. Эти данные об изменениях в системе ПОЛ – АОС свидетельствуют о развитии окислительного стресса.
Изучая влияние сульфата кадмия на функциональное состояние почек, как основного экскреторного органа, мы исследовали процессы перекисного окисления липидов в гомогенатах коркового и мозгового слоев почечной ткани. Экспериментальные данные показали, что отмечается активация процессов СРО в обоих слоях почечной ткани (рис. 4). Доза 0,8 мг/кг массы вызывает увеличение концентрации МДА в корковом веществе при подкожном введении сульфата кадмия в течение 2 недель (р < 0,001) и в течение 1 месяца (р < 0,001), сравнительно с контролем. В мозговом веществе также увеличивается концентрация МДА при экспозиции в течение 2 недель и 1 месяца соответственно (р < 0,001; р < 0,001).
У животных, с введением сульфата кадмия в дозе 1,0 мг/кг массы, содержание МДА в корковом веществе увеличивается более значительно (р < 0,001), сравнительно с контролем. В мозговом веществе почечной ткани на фоне данной дозировки изменения достоверны относительно контроля (р < 0,001) и при введении в течение 1 месяца (р < 0,05) относительно 2 опытной группы. При введении дозы 1,5 мг/кг массы в течение 2 недель отмечается повышение концентрации МДА в корковом веществе почечной ткани (р < 0,001), а при интоксикации в течение 1 месяца ее степень повышается (р < 0,01). В мозговом веществе почечной ткани увеличение концентрации МДА высоко достоверно относительно контроля и относительно других опытных групп, как при введении сульфата кадмия в дозе 1,5 мг/кг массы при 2-недельной затравке, так и в течение 1 месяца.
В условиях окислительного стресса выявлено снижение в сыворотке крови содержания суммарных метаболитов оксида азота, основного вазодилатирующего фактора, вследствие нейтрализации NO АФК. Пероксинитрит, образующийся при этом, является сильным окислителем и повреждающим фактором для эндотелия сосудов. Таким образом, накопление продуктов пероксидации, нарушение метаболизма NO (рис. 5) приводит к дисфункции эндотелия. Биохимическими показателями измененной проницаемости мембран явились снижение активности фермента Na, K, АТФ-азы в мембранах клетки и повышение активности ГГТП в сыворотке крови (рис. 4).
Мы изучали взаимосвязь между изменением концентрации МДА и активностью Na+К+-АТФ-азы в обоих слоях почечной ткани и выявили отрицательную корреляционную связь между интенсивностью перекисного окисления липидов и активностью Na+, К+-АТФ-азы в корковом веществе почечной ткани (r = – 0,688 при введении в течение 2-х недель дозы 1,0 мг/кг массы животного, r = – 0,769 при введении этой же дозировки в течение 1 месяца, r = – 0,697 и r = – 0,788 соответственно при подкожном введении сульфата кадмия в течение 2-х недель и 1 месяца в дозе 1,5 мг/кг массы) и в мозговом веществе (r = – 0,673 и r = – 0,712 в течение 2-х недель и 1 месяца дозы 1,0 мг/кг массы соответственно; r = – 0,702 и r = – 0,725 соответственно при подкожном введении дозы 1,5 мг/кг массы).
Заключение
Таким образом, на фоне интоксикации сульфатом кадмия повышается содержание МДА в эритроцитах, гомогенатах коркового и мозгового вещества почек. Отмечается дисбаланс в АОС: снижение активности СОД в плазме крови и компенсаторное повышение активности каталазы и концентрации ЦП. Активные метаболиты кислорода нейтрилизуют оксид азота и отмечается снижение концентрации суммарных метаболитов NO в сыворотке крови, нарушение вазодилатации и дисфункции эндотелия. Продукты ПОЛ повреждают мембраны клеток, в частности, почек, выявлено снижение Na+К+-АТФ-азы в гомогенатах коркового и мозгового вещества почечной ткани и повышение активности ГГТП в сыворотке крови у крыс на фоне кадмиевой интоксикации.
Рецензенты:
Брин В.Б., д.м.н., профессор, зав. отделом физиологии и патологии висцеральных систем ФГБУН «Институт биомедицинских исследований Владикавказского научного центра РАН», г. Владикавказ;
Джиоев И.Г., д.м.н., профессор, зав. центральной научно-исследовательской лабораторией ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Владикавказ.



