Уретрогенные патогенные и условно-патогенные микроорганизмы в связи с высокой заболеваемостью в популяции и возможностью вызвать тяжелые осложнения, связанные с репродуктивной функцией, представляют серьезную медицинскую и социальную проблему в акушерстве и гинекологии [10].
Среди возбудителей инфекционно-воспалительных заболеваний мочеполовых органов особое место занимают микроорганизмы семейства Mycoplasmataceae (в частности, Ureaplasma urealyticum), роль которых в развитии патологического процесса на сегодняшний день остаётся предметом дискуссий [4]. Часть авторов относят микоплазмы к абсолютным патогенам, другие считают, что микоплазмы являются условно-патогенными, способными при определенных условиях вызвать воспалительные заболевания органов мочеполовой системы [9–10].
Риск неблагоприятных воздействий на плод может быть связан как с прямыми последствиями инфицирования, так и с опосредованным действием патологических изменений в организме матери вследствие развития инфекции, что определяет необходимость проведения эффективной антибактериальной терапии при бактериальных инфекциях у беременной женщины [8].
Антимикробные препараты занимают особое место в клинической практике, поскольку являются одними из наиболее часто назначаемых классов лекарственных средств у беременных, действие которых направлено непосредственно на возбудителя инфекции. При этом незамедлительная и адекватная антимикробная терапия зачастую играет ключевую роль в предотвращении серьезных осложнений и предупреждения дальнейшего распространения инфекций. При назначении антимикробных препаратов беременным важно обеспечить адекватное лечение инфекции, избегая при этом неблагоприятного воздействия на плод [8].
Наличие очагов внутриутробного инфицирования плода в организме беременной вносят значимый дисбаланс в систему мать ‒ плацента ‒ плод, вызывая нарушения в механизмах реализации программы внутриутробного развития и своевременных родов [9].
В децидуальной ткани плаценты главным клеточным компонентом служат децидуальные стромальные клетки, являющиеся основным «рабочим элементом» в плаценте, выполняя трофическую, гормональную, защитную, иммунорегулирующую и гемопоэтическую функции.
В результатах наших предыдущих исследований были установлены изменения морфологии и количества децидуальных клеток в плаценте при воздействии различных вариантов внутриутробных инфекций [7].
Цель исследования: оценить эффект лечения уреаплазмоза во время беременности в сравнении с уреаплазмозом, не леченным во время беременности, на примере реакции децидуальных клеток плаценты.
Материалы и методы исследования
Объектом исследования служили плаценты, полученные от родильниц, беременность которых была осложнена уреаплазменной инфекцией, пролеченной во время беременности антибиотиками и нелеченной. Все данные были получены из обменной карты и истории родов. Участвующие в эксперименте родильницы были информированы о проведении исследования и давали согласие на обработку полученного биоматериала и публикацию результатов в открытой печати. Нами было исследовано 3000 децидуальных клеток из трех зон плаценты: центральной (Ц) (около пуповины), краевой (К) (ближе к краю плаценты) и парацентральной (ПЦ) (между ними) зон, по стандартным гистологическим методикам с окраской гематоксилин-эозином. Основное рабочее увеличение – ×400. С помощью окуляра микрометра, определялись большой и малый диаметры децидуальных клеток и ядер базальной пластинки и септ, количество децидуальных клеток на мм2 площади базальной пластинки и септ. Используя полученные величины, вычисляли объемы децидуальных клеток, их цитоплазмы и ядер по формуле V = π/6∙LB2 (где L – больший диаметр ядра; В – меньший диаметр ядра), ядерно-цитоплазматическое отношение. В каждом препарате методом случайной выборки проводилось измерение каждого из исследуемых параметров 100 раз. На основании вычисленных диаметров стромальные децидуальные клетки базальной пластинки и септ были распределены по клеточным популяциям на К-клетки, малые и большие децидуальные клетки (МДК и БДК соответственно) [3]. Кроме того, были составлены вариационные кривые объёма ядер децидуальных клеток базальной пластинки и септ с шагом в 100 мкм3. Полученные результаты подвергались статистической обработке и сравнению с использованием программного продукта STATISTICA 6.0.
Результаты исследования и их обсуждение
Диаграммы распределения децидуальных клеток по стромальным популяциям на основе их среднего диаметра (рис. 1, 2) наглядно свидетельствуют, что в группе нелеченного уреаплазмоза средний объём децидуальной клетки значительно выше, преимущественно за счёт популяции малых децидуальных клеток, такового в группе корректируемого уреаплазмоза. При оценке децидуальных клеток в базальной пластинке каждой из групп патологии выявлено, что в парацентральной зоне количество малых децидуальных клеток самое высокое в группе нелеченного уреаплазмоза, в то время как в группе корректируемого уреаплазмоза оно самое низкое относительно всех остальных зон плаценты. В септах наибольшее количество малых децидуальных клеток зафиксировано в краевой зоне плаценты группы нелеченного уреаплазмоза, в то время как в группе леченного уреаплазмоза таковое характерно для центральной зоны. При нелеченном уреаплазмозе количество малых децидуальных клеток было значительно выше во всех зонах плаценты, относительно группы терапевтического уреаплазмоза. В связи с этим мы полагаем, что во всех зонах плаценты при нелеченном уреаплазмозе, а также в базальной пластинке краевой зоны плаценты терапевтического уреаплазмоза, идут секреторные процессы, сопровождающиеся продуцированием плацентарных белков и увеличением количества межклеточного вещества.
В группе нелеченного уреаплазмоза в краевой зоне базальной пластинки количество К-клеток приближено к значениям данного параметра в группе пролеченного уреаплазмоза. Увеличение данной популяции может свидетельствовать о том, что начинают устанавливаться иммунорегуляторные процессы, за которые в большей степени ответственны К-клетки [3]. В то же время сниженные удельные объёмы К-клеток в группе нелеченного уреаплазмоза подтверждают предположение о том, что при уреаинфицировании идёт нарушение развития локального иммунного ответа на инфекцию за счёт цитотоксического действия микоплазм на Т-лимфоциты [5].
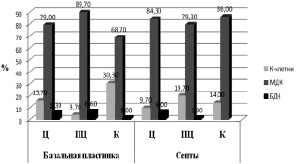
Рис. 1. Распределение по клеточным популяциям стромальных децидуальных клеток в группе нелеченного уреаплазмоза
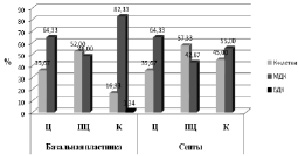
Рис. 2. Распределение по клеточным популяциям стромальных децидуальных клеток в группе терапевтического уреаплазмоза
Большие децидуальные клетки являются основным компонентом децидуальной оболочки физиологически протекающей беременности, активно секретирующие, продуцирующие пролактин и плацентарные белки. У женщин с физиологически протекающей беременностью доля больших децидуальных клеток уменьшается к миометрию и возрастает в месте контакта с хорионом [3]. Исходя из полученных результатов, можно полагать, что при нелеченном уреаплазмозе количество больших децидуальных клеток, наоборот, увеличивается в базальной пластинке по мере приближения к миометрию и снижается в септах, в то время как в группе пролеченной патологии большие децидуальные клетки практически не выражены.
Рассматривая количество ядер с увеличением их объёма, мы наблюдаем следующую ситуацию (рис. 3). Количество ядер с объёмом до 100 мкм3 довольно высокое во всех зонах плаценты как в базальной пластинке, так и в септах в группе леченного уреаплазмоза, относительно уреаплазмоза нелеченного, где наибольшее количество ядер выпадает на объём от 200 до 300 мкм3, следовательно, и средний объём ядер в этой группе будет увеличен. Кроме того, в группе нелеченного уреаплазмоза наблюдается 3 пика количества ядер с показательными значениями объёма (до 100, 201–300, 501–600 мкм3), в то время как в группе терапевтического уреаплазмоза мы наблюдаем лишь два пика (до 100, 201–300 мкм3).
Кроме того, из графика (рис. 3) видно, что в группе леченного уреаплазмоза средние объёмы ядер децидуальных клеток будут значительно ниже, чем в группе нелеченного.
Ядерно-цитоплазматическое отношение практически во всех зонах плаценты в группе терапевтического уреаплазмоза приближается к нормальным значениям, в то время как в группе нелеченного уреаплазмоза наблюдаются достоверно напряжённые показатели ядерно-цитоплазматического отношения, в особенности в центральной зоне базальной пластинки и септ, а также в краевой зоне базальной пластинки (табл. 1).
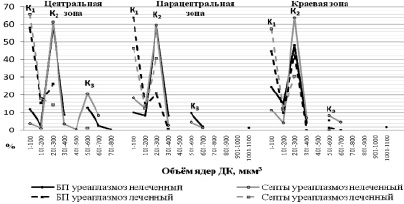
Рис. 3. Вариационная кривая объёма ядер децидуальных клеток
Таблица 1
Параметры ядерно-цитоплазматического отношения децидуальных клеток
|
Группа |
Зоны плаценты |
Фракции плаценты |
|
|
Базальная пластинка |
Септы |
||
|
Нелеченный уреаплазмоз |
Ц |
0,17 ± 0,01 |
0,18 ± 0,01 1)P < 0,1 |
|
ПЦ |
0,13 ± 0,005 3) |
0,14 ± 0,005 1)P < 0,1;3) |
|
|
К |
0,17 ± 0,01 5) |
0,15 ± 0,004 4)5) |
|
|
Пролеченный уреаплазмоз |
Ц |
0,09 ± 0,003 2) |
0,09 ± 0,004 2) |
|
ПЦ |
0,1 ± 0,003 2)3) |
0,12 ± 0,004 1)2)3) |
|
|
К |
0,1 ± 0,004 2)4) |
0,11 ± 0,004 2)4)5) |
|
Таблица 2
Показатели количества децидуальных клеток на 1 мм2 площади плаценты
|
Группа |
Зоны плаценты |
Фракции плаценты |
|
|
Базальная пластинка |
Септы |
||
|
Нелеченный уреаплазмоз |
Ц |
1252,6 ± 18,66 |
1476,04 ± 26,74 1) |
|
ПЦ |
1184,38 ± 13,17 3) |
1506,25 ± 27,66 1) |
|
|
К |
1504,69 ± 27,92 4)5) |
1296,35 ± 22,25 1)4)5) |
|
|
Пролеченный уреаплазмоз |
Ц |
1160,42 ± 14,01 2) |
1259,9 ± 19,92 1)2) |
|
ПЦ |
1224,48 ± 16,95 2)P < 0.1;3) |
1214,06 ± 16,17 2)3)P < 0.1 |
|
|
К |
1203,65 ± 17,1 2)4)P < 0.1 |
1257,81 ± 19,83 1) |
|
Примечания к табл. 1 и 2: наличие статистического уровня достоверности Р < 0,05 при сравнении: 1) базальной пластинки и септ по зонам внутри группы; 2) групп по зонам в пределах фракции; 3) Ц и ПЦ зон внутри группы в пределах фракции; 4) Ц и К зон внутри группы в пределах фракции; 5) ПЦ и К зон внутри группы в пределах фракции.
Таким образом, в группе нелеченной патологии наблюдаются явления полиплоидии с удвоением и четырехкратным увеличением объёмов ядер как в базальной пластинке, так и в септах. Это означает яркую выраженность пролиферативных и синтетических процессов в клетке, что подтверждается и общими значениями ядерно-цитоплазматического отношения в каждой из зон плаценты. Первичные полиплоидные ядра в группе нелеченной патологии встречаются в 3 раза чаще, чем в группе пролеченного уреаплазмоза.
Количество децидуальных клеток в пересчёте на 1 мм2 площади плаценты (табл. 2) в группе пролеченного уреаплазмоза особо не меняется во всех зонах, в то время как в группе нелеченного уреаплазмоза количество клеток базальной пластинки достоверно увеличивается в краевой зоне плаценты, а в септах – в центральной и парацентральной зонах относительно группы корректируемой патологии.
Заключение
Таким образом, в плаценте при нелеченном уреаплазмозе идут активные компенсаторно-приспособительные процессы, которые сопровождаются пролиферативными и белково-синтетическими процессами в децидуальных клетках материнской и плодной частей, функциональным набуханием ядер малых децидуальных клеток и К-клеток, полиплоидией ядер К-клеток. Все это может указывать на озлокачествление клеток, так как установлено, что в инфицированных микоплазмами клетках-эукариотах за счет создания определенных условий происходят процессы, ведущие к трансформации эукариотических клеток и в конечном счёте к развитию опухолевого процесса [2]. Вследствие этого определение уровня плоидности ядер клеток является объективным морфологическим критерием канцерогенеза [1].
В плаценте терапевтического уреаплазмоза изменения обусловлены в первую очередь почти полным исчезновением функционального набухания ядер и корректировкой патологического процесса, что выражается в возрастании количества К-клеток.
Кроме того, в краевой зоне базальной пластинки обеих групп реакция децидуальных клеток была практически противоположной остальным зонам, что может свидетельствовать о том, что данная зона плаценты несколько обособленно реагирует на возбудителя инфекции.
В результате можно заключить, что антибактериальная терапия уреаплазмоза во время беременности повышает в первую очередь иммунорегуляторную функцию и нормализует морфофункциональное состояние децидуальных клеток плаценты.
Рецензенты:Поливанова Т.В., д.м.н., профессор, ФГБНУ «Научно-исследовательский институт медицинских проблем Севера», ведущий научный сотрудник клинического отделения патологии пищеварительной системы у детей, г. Красноярск;
Горбунов Н.С., д.м.н., профессор, заведующий кафедрой оперативной хирургии и топографической анатомии, ГБОУ ВПО «КрасГМУ им. проф. В.Ф. Войно-Ясенецкого» Министерства здравоохранения Российской Федерации, г. Красноярск.
Работа поступила в редакцию 24.02.2015.



