Впервые синтезированы сульфиды из серы и хлорида железа. Процесс получения сульфидов из элементов сопровождается высокими температурами [5]. В данном случае сульфиды синтезированы при температуре 160 °С, поскольку при данной температуре устойчивые циклические формы элементной серы (S4, S6, S8) переходят в радикалы. А хлорид железа является кислотой Льюиса и способен выступать инициатором радикальных превращений серы [4]. Механизм протекающих процессов исследован посредством гибридного метода функционала плотности dft functional = PBE с базисным набором basis = 4.in, включающий релятивистские поправки four = 1, программой Priroda 6.
Цель: исследовать механизм процесса взаимодействия хлорида железа с серой с использованием квантово-химических расчетов.
Результаты исследования и их обсуждение
Для правильной оценки возможности протекания той или иной реакции с участием серы следует помнить, что у молекулярной серы возможны два электронных состояния: триплетное и синглетное с разной химической активностью. Так, для атомов S1, S2 и S4 термодинамически наиболее устойчиво триплетное состояние, это ярко выражено для одноатомной серы. Основное триплетное состояние атомарной серы с двумя неспаренными электронами лежит на 163,7 кДж/моль ниже возбужденного синглетного состояния без неспаренных электронов. Энергия перехода триплет – синглет для атомов S2 и S4 составляет 96,7 и 19,4 кДж/моль соответственно. Для атомов S6 и S8 энергия перехода близка к нулю. Изменение спинового состояния атомов серы S1, S2 и S4 приводит к ярко выраженным изменениям в геометрии и энергетике молекул, для атомов S6 и S8 эти изменения не су щественны [1, 7].
Для моделирования процесса синтеза сульфидов из серы и хлорида железа рассмотрена димерная форма хлорида железа, поскольку в парах до 440 °С хлорид железа существует в виде димера Fe2Cl6 (при 750 °С в избытке Cl2 – в виде мономера), строение которого аналогично Al2Cl6 [6]. Взаимодействие серы с хлоридом железа (III) в общем виде можно представить схемой
Fe2Cl6 + Sn → Fe2Cl5SnCl.
Механизм присоединения атомарной серы (синглет) к хлориду железа представлен на рис. 1. Присоединение одноатомной серы к хлориду железа идет безактивационно с выделением большого количества тепла.
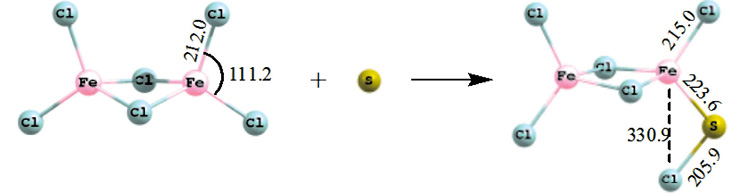
Рис. 1. Схема присоединения атомарной серы (М = 1) к гексахлориду дижелеза
Тепловой эффект процесса – 517,2 кДж/моль. Длина связи Fe–S в продукте составляет 223,6 пм, что характерно для связей в сульфидах железа. Длина связи Fe c дальним атомом Cl 330,9 пм.
Присоединение триплетной атомарной серы к Fe2Cl6 осуществляется по аналогичному механизму, незначительно меняются длины связей и углы, но в общем структура переходного состояния и продукта очень близки. Тепловой эффект присоединения одноатомной триплетной серы к гексахлориду дижелеза составляет –397,8 кДж/моль, процесс также идет безактивационно.
Не следует, однако, судить об одинаковой степени легкости присоединения синглетной и триплетной серы к хлориду железа. Один атом серы с закрытой оболочкой – это возбужденное состояние и Еакт присоединения S1 (m = 1) гексахлориду дижелеза посчитана, исходя из высокого уровня. По энергии атом S1 (m = 1) лежит выше на 163,7 кДж/моль относительно S1 (m = 3) и, соответственно, эффективная энергия активации процесса присоединения синглетной одноатомной серы будет порядка 164 кДж/моль.
Механизм присоединения двухатомной серы (синглет) к хлориду железа представлен на рис. 2.
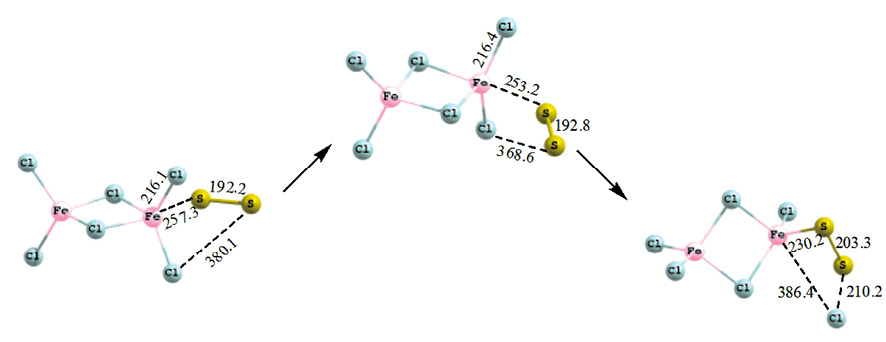
Рис. 2. Схема присоединения двухатомной серы (М = 1) к гексахлориду дижелеза
В переходном состоянии связь Fe-S незначительно уменьшается относительно исходной структуры (на 4,1 пм), происходит разворот вокруг связи Fe–S с приближением крайнего атома серы к ближайшему атому хлора. В результате появляется возможность перехода атома хлора к атому серы с формированием связи S–Cl (210,2 пм), длина связи Fe–S в продукте 230,2 пм. Тепловой эффект присоединения двухатомной серы (синглет) составляет –24,2 кДж/моль – реакция идет с выделением тепла, энергия активации 18,7 кДж/моль. Тепловой эффект внедрения триплетной двухатомной серы составляет 97,3 кДж/моль, энергия активации 53,2 кДж/моль.
Сходный механизм реализуется и при присоединении четырехатомной серы к хлориду железа: атом серы атакует атом железа, образуя промежуточный шестичленный комплекс FeS4Cl со слабыми донорно-акцепторными связями: Fe–S 243,1 пм; S–Cl 249,0 пм; Fe–Cl 256,9 пм. Затем происходит перенос атома хлора к атому серы. Связи Fe–S и S–Cl уменьшаются и составляют 228,9 и 213,9 пм соответственно (рис. 3). Энергия активации присоединения четырехатомной серы к гексахлориду дижелеза составляет 58,1 кДж/моль, тепловой эффект процесса 15,6 кДж/моль.
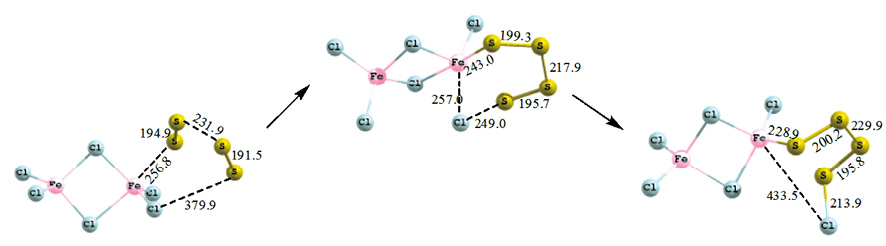
Рис. 3. Схема присоединения четырехатомной серы к гексахлориду дижелеза
В случае присоединения четырехатомной серы с мультиплетностью 3, сера в отличие от S4 (М = 1) присоединяется к хлориду железа, образуя пятичленный цикл FeS5, в ПС цикл раскрывается с приближением конечной серы к атому хлора и перегруппировкой в шестичленный промежуточный комплекс FeS4Cl, длина связи S–Cl 220,3 пм; Fe–Cl 258,1 пм. В продукте расстояние Fe–Cl увеличивается и составляет 361,1 пм, а связь S–Cl укорачивается до 213,2 пм. Энергия активации присоединения четырехатомной серы (М = 3) к хлориду железа составляет 32,2 кДж/моль, тепловой эффект процесса 11,2 кДж/моль.
Образование сульфидных комплексов, содержащих шести- и восьмиатомную серу протекает в несколько последовательных стадий: сера S6 и S8 присоединяется к исходному хлориду железа в виде конфигураций, свойственных для гекса- и октасеры («кресло» и «корона»), затем происходит раскрытие циклов и перемещение атома хлора к ближайшему атому серы. Так, взаимодействие хлорида железа с S6 (М = 1) протекает через одно ПС (рис. 4).
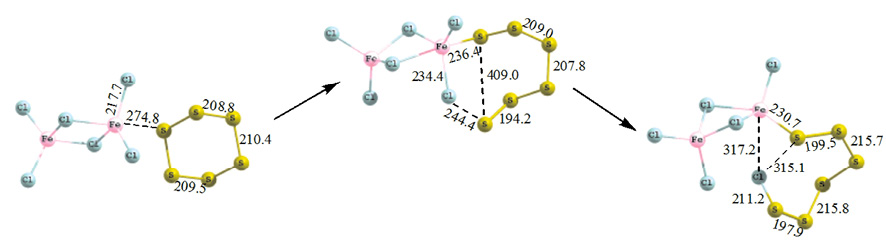
Рис. 4. Схема присоединения шестиатомной серы (М = 1) к гексахлориду дижелеза
В исходном комплексе молекула S6 приближается к хлориду железа в виде замкнутого цикла без нарушения симметрии и перегруппировок, расстояние между атомом железа и атомом серы 274,8 пм. После раскрытия серной молекулы в ПС появляется возможность сближения атомов с формированием связи Fe–S длиной 236,4 пм. Одновременно с раскрытием молекулы S6 происходит раскручивание серного «хвоста» с приближением конечного атома серы к атому хлора. После чего атом серы оттягивает на себя атом хлора, длина связи S–Cl в конечном продукте 212 пм.
Механизм образования сульфидного комплекса, содержащего 8 атомов серы, представлен на рис. 5. Восьмиатомная серная «корона» присоединяется к хлориду железа, затем происходит раскрытие кольца S8: в ПС расстояние между концевыми атомами серы составило 311,2 пм, а в интермедиате уже 475 пм. После сокращения связи S–Cl с 372,4 пм в ПС 1 до 347,3 пм в интермедиате появляется возможность перехода атома хлора к атому серы. А после формирования связи S–Cl происходит раскрытие серной короны.
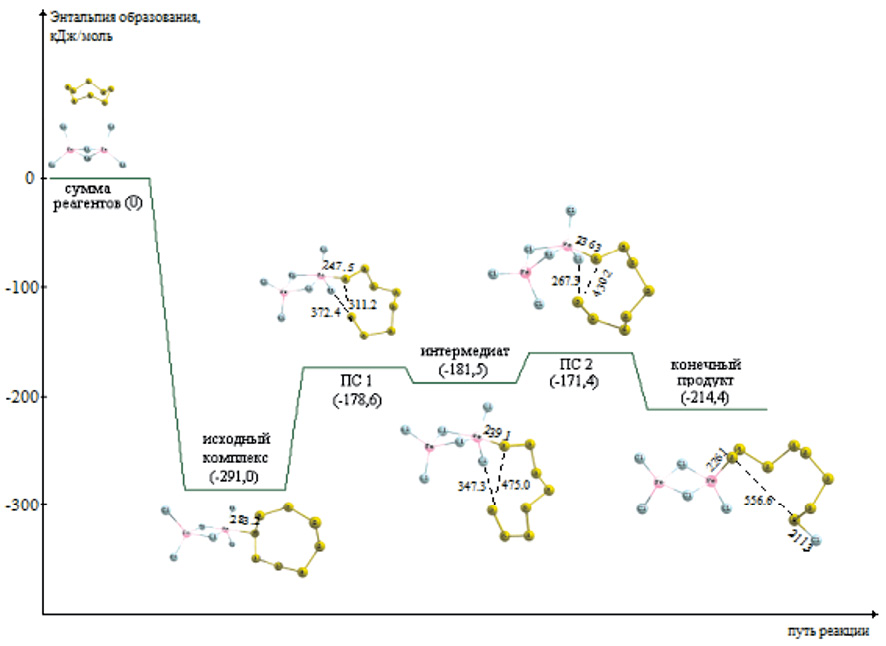
Рис. 5. Схема присоединения S8 к гексахлориду дижелеза
Хлорид железа несколько облегчает раскрытие циклических молекул: Еакт раскрытия серной «короны» S8 в присутствии электрофильного активатора составляет 112,46 кДж/моль, а без активатора (термическая активация) 142 кДж/моль. Для S6 Еакт раскрытия серной молекулы в присутствии хлорида железа составляет 91,8 кДж/моль, а в отсутствии FeCl3 105,4 кДж/моль.
Следовательно, хлорид железа способствует снижению энергии разрыва серных молекул S6 и S8 на 13,6 и 29,54 кДж/моль соответственно, т.е. способствует дестабилизации циклов и активирует их разрыв. Проведена оценка термической стабильности полученных сульфидов, определены энергии связи Me-S. Энергия диссоциации синтезированных сульфидов при разрыве на два фрагмента FeCl3 и FeCl3Sn лежит в пределах 268,46–322,6 кДж/моль, что указывает на прочную полярно-ковалентную связь и высокую термическую стабильность образованных сульфидов.
На устойчивость полученных сульфидных комплексов указывает и высокое значение энергии активации процесса отщепления хлорида серы, которое лежит в пределах 180–275 кДж/моль.
Полученные результаты по определению энергии активации (Еакт) и теплового эффекта (∆H) процесса взаимодействия исследуемого хлорида с серой Sn (n = 1–8) представлены в таблице.
Тепловые эффекты и энергии активации процесса взаимодействия серы Sn с хлоридом железа
|
Атомарность серы |
M = 1 |
M = 3 |
||
|
∆Hреакции, кДж/моль |
Еакт, кДж/моль |
∆Hреакции, кДж/моль |
Еакт, кДж/моль |
|
|
Fe2Cl6 + Sn |
Fe2Cl6 + Sn |
|||
|
S1 |
–517,2 |
0 |
–397,8 |
0 |
|
S2 |
–24,2 |
18,7 |
97,3 |
53,2 |
|
S4 |
15,6 |
58,1 |
11,2 |
32,2 |
|
S6 |
48,2 |
91,8 |
– |
– |
|
S8 |
77,14 |
119,6 |
– |
– |
Выводы
Таким образом, исследован механизм процесса взаимодействия хлорида железа с серой с использованием квантово-химических расчетов. Установлено активирующее действие хлорида на серу, заключающееся в дестабилизации и раскрытии циклических молекул и образовании реакционно активных радикалов с их последующим присоединением к хлориду и образованием устойчивых сульфидных комплексов [2, 8, 9].
При взаимодействии серы с хлоридом железа образуются термодинамически устойчивые сульфиды переменного состава. Невысокая энергия активации процесса присоединения серы к гексахлориду дижелеза порядка 0–119,6 кДж/моль указывает на вероятность образования сульфидов даже при незначительном нагревании системы.
Следовательно, результаты квантово-химических расчетов подтверждают известные из литературы сведения о выступлении кислот Льюиса, к которым относятся хлорид железа, к катализаторам реакций элементной серы.
Результаты квантово-химических расчетов были подтверждены результатами физико-химических исследований, так, рентгенофазовым анализом зафиксированы рефлексы сульфидов железа в продукте взаимодействия хлорида железа с серой и хлорида цинка с серой, а также обнаружены полосы поглощения на ИК-спектрах, свойственные для связей Fe–S [3].
Рецензенты:Ахметов Т.Г., д.т.н., профессор, КНИТУ, г. Казань;
Сагадеев Е.В., д.х.н., профессор, КГАСУ, г. Казань.
Работа поступила в редакцию 18.11.2014.



