Термины «токсопиримидины» и «атоксопиримидины» возникли в результате обнаружения феномена идентичности судорожных приступов, вызванных действием на организм гидразидов (тиосемикарбазида, семикарбазида, изоникотинилгидразида) с действием токсопиримидина (ТП, 2-метил-5-оксиметил-4-аминопиримидин). Испытание ряда его производных выявило, что токсичность этих соединений связана с наличием метильных группировок в пиримидиновом кольце [11]. Производные б имеют большую токсичность, чем производные в, что указывает на роль метильной группы в 5 положении. Производное, которое не имеет метильной группы ни в 5-м, ни в 6-м положениях – нетоксично. Наибольшая токсичность обнаружена у 2,5,6-триметил-4-аминопиримидина –производное д [9, 11]. При изучении механизма судорог, вызванных разными производными ТП, во всех случаях было показано торможение глутаматдекарбоксилазы (ГДК) мозга и снижение уровня ГАМК.
Структурные аналоги ТП-атоксопиримидины (рис. 2), имеющие либо иную боковую цепь в 4-м положении, либо гидроксильную группу в 5-м положении, обладают способностью подавлять судороги, вызванные ТП. Их введение снижает степень торможения активности ГДК [9].
При судорожных состояниях, вызванных введением 4-дезоксипиримидина или его фосфорилированной формы, активность ГДК мозга резко падает [11].
Материал и методы исследования
В настоящее время нами накоплен значительный экспериментальный материал, свидетельствующий о том, что некоторые производные 1,3-пиримидина оказывают положительное влияние на динамику токсического процесса при различных формах его проявления – острых, подострых, хронических интоксикациях ксенобиотиками, а также химически индуцированных видах патологии. Установлено, что антитоксическими свойствами обладают, как правило, производные 1,3-пиримидина, содержащие окси- или аминогруппы в 5-м положении. Им присуще положительное поливалентное воздействие на организм, при весьма малой токсичности: пиримидины стимулируют нуклеиновый и белковый обмен, ускоряют клеточный рост и размножение, оказывают противовоспалительное, иммуномодулирующее действие, обладают широким спектром фармакологических эффектов.
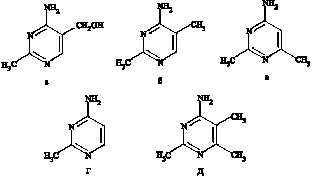
Рис. 1. Производные токсопиримидина (а-д).
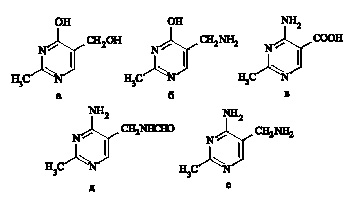
Рис. 2. Атоксопиримидины (а-е)
В значительной степени это связано с их структурным сходством с пиримидиновыми основаниями, нуклеозидами и нуклеотидами, играющими определенную роль в механизмах наследственности и обмена веществ. В этой связи представлялись целесообразными систематизация и обобщение полученного экспериментального материала – антитоксических (лечебно-профилактических) эффектов производных пиримидина, содержащих в 5-м положении пиримидинового кольца окси- и аминогруппы.
Результаты исследования
и их обсуждение
Проведенный анализ позволил выдвинуть гипотезу о многообразии потенциальных функций, свойственных этим соединениям, которые могут быть связаны с их способностью регулировать взаимопревращения свободно радикальных соединений, обусловливающих «окислительный потенциал» клеток, оказывая в результате стабилизирующие действия на клеточные мембраны. За основу были положены результаты исследования, представленные в таблице.
Они свидетельствуют о многообразии потенциальных функций, свойственных этим соединениям. На уровне современных знаний это многообразие в большинстве случаев может быть сведено к важной фундаментальной особенности – способности пиримидинов регулировать взаимопревращения свободнорадикальных соединений, обуславливающих «окислительный потенциал» клеток, оказывая в результате стабилизирующее действие на клеточные мембраны [1, 2, 3, 4, 5, 6, 7, 8]. Однако этим не исчерпывается их защитный потенциал.
Антитоксические эффекты производных 1,3-пиримидина при различных формах токсического процесса [1, 2, 3, 4, 5, 6, 7, 8]
|
№ п/п |
Производное пиримидина |
Токсический агент, модель патологии |
Эффект, условия эксперимента |
|
1 |
2 |
3 |
4 |
|
1 |
5-гидрокси-6-метилурацил |
метафос |
повышение выживаемости мышей в условиях острой интоксикации |
|
2 |
5-гидрокси-6-метилурацил |
октаметил |
повышение выживаемости мышей при острой интоксикации |
|
3 |
5-гидрокси-6-метилурацил+атропин |
зарин |
снижение токсичности (по критерию DL50) зарина для мышей |
|
4 |
5-гидрокси-6-метилурацил+атропин |
карбофос |
повышение защитной эффективности атропина – предупреждение отдаленного летального эффекта |
|
5 |
5-гидрокси-6-метилурацил+атропин |
армин |
повышение антидотной эффективности атропина, мембраностабилизирующий эффект |
|
6 |
5-гидрокси-6-метилурацил+антидот П-3 |
армин |
повышение эффективности профилактического антидота П-3 |
|
7 |
5-гидрокси-6-метилурацил |
дихлордиэтил-сульфид |
актопротекторный эффект у крыс, отравленных 2DL50 токсиканта |
|
8 |
5-гидрокси-6-метилурацил |
карбофос |
мембраностабилизирующий эффект (по изменению флуоресценции зонда АНС в «тенях» эритроцитов) |
|
9 |
5-гидрокси-6-метилурацил |
ПХБ – содержащий препарат «совтол-1» |
повышение выживаемости крыс в условиях подострой интоксикации |
|
10 |
1,3,6- триметил- |
токсическая гепатопатия, моделируемая совтолом-1 |
гепатопротекторный эффект |
|
11 |
5-гидрокси-6-метилурацил |
токсический цирроз печени, моделируемый сочетанием |
гепатопротекторный эффект |
|
12 |
5-гидрокси-6-метилурацил |
токсический гепатит, моделируемый тетрахлорметаном |
гепатопротекторный эффект |
|
13 |
1,3,6-триметил- |
токсическая гепатопатия, моделируемая дихлорэтаном |
гепатопротекторный эффект |
|
14 |
5-гидрокси-6-метилурацил+ витамины: B6, C, E |
токсическая гепатопатия, моделируемая подострой интоксикацией 2,4-дихлорфенолом |
гепатопротекторный эффект, повышение выживаемости крыс |
|
15 |
5-гидрокси-6-метилурацил |
жировой гепатоз, моделируемый этанолом |
гепатопротекторный эффект |
|
16 |
Комплексное соединение 5-гидрокси-6-метилурацил+ Na сукцинат |
токсическое поражение печени трихлорметафосом |
гепатопротекторный эффект |
|
17 |
5-аминоурацил |
токсическая метгемоглобинемия, моделируемая NaNO2 |
деметгемоглобинизирующий эффект |
|
18 |
5-гидрокси-6-метилурацил |
токсическая метгемоглобинемия, моделируемая NaNO2 |
деметгемоглобинизирующий эффект |
|
1 |
2 |
3 |
4 |
|
19 |
5-гидрокси-6-метилурацил |
поражение печени гидразидом изоникотиновой кислоты |
гепатопротекторный эффект |
|
20 |
5-аминоурацил |
острое отравление крыс натрия нитритом |
антидотный эффект |
|
21 |
5-гидрокси-6-метилурацил |
острое отравление крыс натрия нитритом |
антиоксидантный, церебропротекторный эффекты |
|
22 |
комплексное соединение |
острое отравление мышей натрия нитритом |
антидотный эффект |
|
23 |
5-гидрокси-6-метилурацил+атропин |
подострое отравление крыс карбофосом |
мембранопротекторный, церебропротекторный эффекты |
|
24 |
5-гидрокси-6-метилурацил |
подострое отравление крыс карбофосом |
мембраностабилизирующий эффект |
|
25 |
5-гидрокси-6-метилурацил+ ИТ-229 |
острое отравление крыс карбофосом |
ослабление пульмонотоксического действия |
|
26 |
5-гидрокси-6-метилурацил |
цистамин |
снижение токсичности, повышение радиозащитной эффективности |
|
27 |
5-гидрокси-6-метилурацил |
острая алкогольная интоксикация |
повышение выживаемости мышей и крыс |
|
28 |
литиевая соль 5-гидрокси-6-метилурацила |
коразол |
противосудорожный эффект у мышей |
|
29 |
5-гидрокси-6-метилурацил |
строфантин |
ослабление токсичности, усиление кардиотонического действия (кошки, кролики, лягушки) |
|
30 |
5-гидрокси-6-метилурацил |
острое отравление метанолом |
повышение выживаемости мышей |
|
31 |
5-гидрокси-6-метилурацил-Li |
бикукулин |
противосудорожный эффект, повышение выживаемости |
По-видимому, благодаря тому, что 5-гидрокси- и 5-аминопроизводные совмещают в одной молекуле разные виды биорегуляторной активности, эти соединения могут принимать участие в осуществлении разнообразных гомеостатических реакций не только молекулярного, но и более высоких уровней – с участием клеток, тканей, функциональных систем и целого организма [3, 5].
Антиоксидантные, а затем и мембранопротекторные свойства 5-гидрокси-
6-метилурацила (оксиметилурацила) впервые были обнаружены В.А. Мышкиным [2, 3], что позволило в дальнейшем успешно развивать это направление исследований, используя различные экспериментальные модели интоксикаций и химически индуцированных видов патологии [3, 4, 5].
Многочисленные исследования антитоксической и антиоксидантной активности производных 5-гидрокси-6-метилурацила, выполненные на различных моделях, показывают, что указанные производные являются эффективными «ловушками» свободных радикалов [1, 2, 5]. Установлено, что антиоксидантная и антирадикальная активность соединений зависит от положения и природы заместителя в молекуле урацила. На проявления антиоксидантной активности оказывают влияние заместители в положении C-5, N-1 и N-3. Антиоксидантная активность возрастает с увеличением индуктивных свойств заместителя при C-5. При отсутствии электронодонорных заместителей в положении C-5 на проявление активности оказывает влияние наличие заместителя в положениях N-1 и N-3 [10] .
Наряду с обнаружением антиоксидантов пиримидиновой структуры, обладающих антитоксической активностью, в синтетической химии сформировался подход, основанный на методе кластрирования фармаконов с природными веществами. Созданные таким путем лекарственные композиции оказывают терапевтическое воздействие в меньшей дозе, менее токсичны и обладают целым рядом новых полезных свойств. Ранее одним из авторов (В.А. Мышкин) было высказано предположение, что эффективными средствами коррекции мембранотоксического действия могут быть комплексные соединения, обладающие антиоксидантными свойствами со стимулирующим действием на систему энергогенеза. В этой связи в ИОХ Уфимского научного центра РАН был получен ряд комплексов производных 6-метилурацила с полифункциональными карбоновыми кислотами – янтарной, фумаровой, аскорбиновой, лимонной, проявляющих противогипоксическую и токсико-гипоксическую активность [1, 10].
Высокая противогипоксическая активность установлена у комплексного соединения 6-метилурацила и янтарной кислоты [7] и 1,3-бис(2-гидроксиэтил)-5-гидрокси-6-метилурацила и фумаровой кислоты [8].
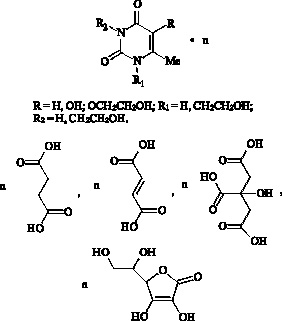
Рис. 3. Комплексные соединения производных 6-метилурацила с полифункциональными карбоновыми кислотами (янтарной, фумаровой, аскорбиновой, лимонной и др.),
проявляющие антитоксическую активность
Выводы
Таким образом, антитоксические свойства производных 1,3-пиримидина являются важной составной частью их фармакологического спектра. Они служат основой для дальнейших целенаправленных исследований в этой области фармакологии, интерес к которой в настоящее время возрастает. Не исключено, что будущие лекарства будут найдены именно среди описанного класса фармакологических средств – направленных корректоров токсического дисгомеостаза на основе производных пиримидина.
Рецензенты:Миннибаев М.М., д.м.н., профессор кафедры патофизиологии, ГБОУ ВПО «Казанский государственный медицинский университет», г. Казань;
Фролов Б.А., д.м.н., профессор, заведующий кафедрой патофизиологии, Оренбургская государственная медицинская академия, г. Оренбург.
Работа поступила в редакцию 30.10.2014.



