К настоящему времени в литературе накоплены данные о важности эндогенной каннабиноидной системы (ЭКС) для регуляции функционирования центральной нервной системы. Являясь ключевой нейромодулирующей системой мозга, ЭКС также может осуществлять нейропротекцию при различных патологиях [9]. ЭКС состоит из двух типов каннабиноидных G протеин-связанных рецепторов (CB1 и CB2), их эндогенных липидных лигандов (эндоканнабиноидов, ЭК) анандамида и 2-арахидоноилглицерола (2-АГ), а также ферментов их синтеза, транспорта и деградации [9]. СВ1 рецепторы широко экспрессируются в мозге на терминалях аксонов, как тормозных [10], так и возбуждающих [12] нейронов. ЭК синтезируются «по мере надобности» из мембранных предшественников в постсинапсе и, ретроградно активируя пресинаптические СВ1 рецепторы, регулируют активность мембранных каналов и выделение нейротрансмиттеров [9]. Анандамид и 2-АГ удаляются из внеклеточного пространства с помощью специфического механизма обратного захвата в нейронах и астроцитах и гидролизуются в клетках посредством гидролазы амидов жирных кислот и моноацилглицерол липазы соответственно [9]. Интерес к использованию каннабиноидных препаратов для терапии таких нейродегенеративных заболеваний с неблагоприятным прогнозом, как височная эпилепсия, болезнь Альцгеймера, Паркинсона и других, в последние годы сильно возрос [9]. Антагонист каннабиноидных рецепторов римонобант (SR141716A) уже используется в медицинской практике для лечения ожирения и метаболических расстройств [9]. Однако применение агонистов каннабиноидных рецепторов в качестве лекарственных средств ограничивается их психотропными свойствами, кроме того при данном подходе нарушается принцип действия ЭКС «по мере надобности». Поэтому одним из перспективных подходов является применение веществ, активирующих ЭКС опосредованно за счет повышения синаптического уровня ЭК в результате ингибирования их обратного захвата или энзиматического гидролиза. Однако в отличие от действия натуральных и синтетических каннабиноидов влияние как ингибиторов метаболизма ЭК, так и антагонистов СВ1 рецепторов на поведение и мозговую активность человека и животных в настоящее время исследовано недостаточно.
Целью настоящей работы было исследование влияния модуляции активности ЭКС, посредством блокады СВ1 рецепторов или процессов инактивации ЭК, на осцилляторные процессы медиальной септальной области, гиппокампа, энторинальной коры и амигдалы.
Материалы и методы исследования
Эксперименты проведены в соответствии с международными нормами этического обращения с животными (Директива европейского Парламента 86/609/EE). Опыты были поставлены на четырех группах бодрствующих морских свинок. За неделю до начала экспериментов животным имплантировали регистрирующие электроды в поле СА1 гиппокампа (Гип, АР = 6,6; L = 3; H = 5), медиальную септальную область (МС, АР = 12.2; L = 2; H = 7,5, угол 15°), энторинальную кору (Энт, АР = 4,6; L = 5,5; H = 10,5) и базальное ядро амигдалы (БА, AP = 10,2; L = 5; Н = 12,2) для одновременной регистрации локальных полевых потенциалов (ЛПП). Сигналы усиливали (Grass Instruments, США) и регистрировали в частотном диапазоне 0,1–300 Гц (с сетевым фильтром на 50 Гц). Запись оцифрованных (PCI-DAS 1200JR, 12-bit A/D resolution, США; частота дискретизации 1 кГц) ЛПП проводили с помощью программного обеспечения Datapac 2k2 (Run Technologies, США). Все препараты вводились интрацеребровентрикулярно бодрствующим морским свинкам через вживленную направляющую канюлю (AP = 8,6; L = 2,5; H = 4,7) с помощью микрошприца Гамильтона. У всех животных в течение 3–4 дней регистрировали фоновые ЛПП исследуемых структур. Затем животным экспериментальных групп («АМ251», n = 5; «АМ404», n = 6; «URB597», n = 5) разово вводили селективный антагонист СВ1 рецепторов АМ251 (2 мкл, 20 нмоль), ингибитор обратного захвата эндоканнабиноидов АМ404 (3 мкл, 120 нмоль) или ингибитор фермента деградации анандамида URB597 (2 мкл, 4,8 нмоль), а животным контрольной группы – соответствующий объем ДМСО («ДМСО»). ЛПП регистрировали после окончания инъекции в течение 60 минут.
Анализ активности исследуемых структур мозга проводился при помощи специально разработанного алгоритма в среде Матлаб (Matlab 8.0, США). Для анализа мощности ЛПП на различных частотах использовали метод Уэлча на основе алгоритма быстрого преобразования Фурье (окно Ханна, 4096 мс, 50 %-е перекрытие сегментов). Применяя описанный анализ, оценивали:
1) спектры амплитуды/мощности сигналов;
2) мощность сигнала определенного частотного диапазона (дельта 0,5–4 Гц; тета 4–8 Гц; альфа 8–12 Гц; бета 12–40 Гц; гамма 80–120 Гц; высокочастотные осцилляции, ВЧО, 120–300 Гц).
Для статистического анализа при множественном сравнении с контрольной группой применяли непараметрический критерий Краскела – Уоллиса с последующим попарным сравнением с использованием U-критерия Манна – Уитни с поправкой Бонферрони. Данные представлены как среднее ±SD, различия считали статистически достоверными при уровне значимости p < 0.05. Анализ производили в программе SPSS (версия 21, IBM Corp., США).
Результаты исследования и их обсуждение
Спонтанная активность исследуемых структур мозга. Локальные полевые потенциалы изучаемых структур мозга у животных в состоянии спокойного бодрствования включали осцилляции различной частоты, обычно не превышающие по амплитуде 0,4 мВ (0,25 ± 0,08 мВ) (рис. 1, А). Амплитуда ЛПП в исследуемых структурах (медиальной септум, гиппокампе, энторинальной коре и амигдале) существенно не различалась (в среднем 0,23 ± 0,04, 0,26 ± 0,09, 0,27 ± 0,12 и 0,23 ± 0,04 мВ соответственно). Спектральный анализ выявил более широкий частотный диапазон для гиппокампа (0,1–250 Гц), по сравнению с другими изучаемыми структурами (0,1–100 Гц для МС и амигдалы, 0–150 для Гц энторинальной коры). Выраженность различных ритмов также варьировала между исследуемыми структурами. Дельта-активность была более характерна для МС и Энт, а мощность осцилляций в тета-, альфа, и бета-диапазонах была выше в гиппокампе. Высокочастотная активность также была в наибольшей степени свойственна гиппокампу (рис. 1, В). В амигдале иногда появлялся веретеновидный альфа-ритм, не характерный для остальных изучаемых структур.
Влияние AM404, URB597 и AM251 на активность исследуемых структур. Для того чтобы оценить собственное влияние ингибитора обратного захвата ЭК AM404, ингибитора фермента деградации ЭК URB597 и антагониста СВ1 рецепторов АМ251 на поведение и электрическую активность исследуемых структур, данные вещества вводились однократно, после чего ЛПП регистрировали в течение 60 минут.
Спектральный анализ показал, что мощность ЛПП исследуемых структур мозга после введения каннабиноидных препаратов практически всегда менялась однонаправленно. Данные изменения зависели от частотного диапазона. Так, в первые 10 минут после введения веществ можно отметить снижение мощности ЛПП во всех диапазонах (тета, альфа и бета), кроме самого низкочастотного (0,5–4 Гц, дельта) (рис. 2). Такое понижение мощности наблюдалось во всех экспериментальных группах, независимо от вводимого вещества (AM404, URB597, AM251 либо ДМСО), однако было различно по величине (снижение на 10–40 % в зависимости от группы), не всегда достоверно изменяло фоновую активность и было кратковременным (как правило, первые 10–20 минут). В поведении животных в первые 5–10 минут после интрацеребровентрикулярной инъекции отмечалось легкое беспокойство.
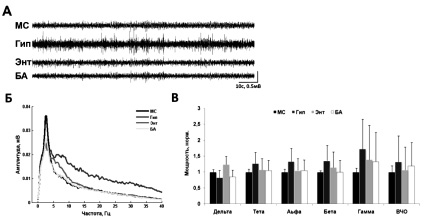
Рис. 1. Спектральные характеристики фоновой активности: А – пример фоновой записи ЛПП медиальной септум (МС), гиппокампа (Гип), энторинальной коры (Энт) и амигдалы (БА); Б – характерный пример частотных спектров исследуемых структур мозга; В – мощность ритмов исследуемых структур, для каждого диапазона нормированная к МС
Группа «АМ251», в которой животным вводился антагонист каннабиноидных рецепторов, несколько отличалась от остальных. В ней наблюдалось некоторое повышение мощности ЛПП в низкочастотном диапазоне до 12 Гц (дельта-, тета- и альфа-ритмы) через 20 минут после введения АМ251, что не сказывалось на поведении животных (рис. 2).
Нейропротекторный потенциал эндоканнабиноидной системы мозга в настоящее время интенсивно изучается [9]. Однако применение натуральных и синтетических каннабиноидов в медицинской практике значительно ограничено их негативными побочными эффектами. Установлено, что каннабиноиды изменяют активность мозга и влияют на процессы обучения и памяти. Так, показано, что введение крысам Δ-9-тетрогидроканнабинола (ТГК), основного психоактивного компонента препаратов конопли, приводит к снижению спектральной мощности кортикальной ЭЭГ крыс примерно на 50 % в течение часа после введения и возвращается к норме только спустя 8 часов [4]. В другом исследовании ТГК, так же, как и синтетический агонист СВ1 рецепторов CP55940, снижали мощность тета-ритма, что коррелировало с ухудшением гиппокамп-зависимой памяти, а также гамма- и риппл-осцилляций в гиппокампе крыс. Такое снижение мощности («уплощение») ЛПП происходило в силу десинхронизации, а не уменьшения активности одиночных нейронов, так как при действии каннабиноидов частота их разрядов не менялась [14]. Нарушение временной координации в активности гиппокампальных нейронов, вызванное CP55940, также сказывалось на поведении животных, ухудшая пространственную память [13]. Сходным образом, как ТГК, так и синтетические агонисты СВ1 рецепторов (WIN55,212-2 и HU210) подавляли активность и залповые характеристики пирамид СА1 и СА3 гиппокампа в дозах, вызывающих дефицит памяти у крыс, и нарушали синхронную активность пирамидных клеток в полях СА1 и СА3, а также между этими полями [6]. У людей после разового курения марихуаны (не было хроническим в прошлом) также отмечено снижение мощности тета-ритма, коррелирующее с ухудшением рабочей памяти [2, 8], а при тестах на эпизодическую память возрастало число ошибок [8]. По другим данным, на фоне хронического употребления марихуаны, напротив, данное воздействие вызывало минимальный эффект на выполнение когнитивных задач, однако мощности альфа-ритма (задачи на пространственную рабочую память), и, в меньшей степени, тета- и бета-ритмов были понижены через 15 мин после курения в течение почти двух часов [7].
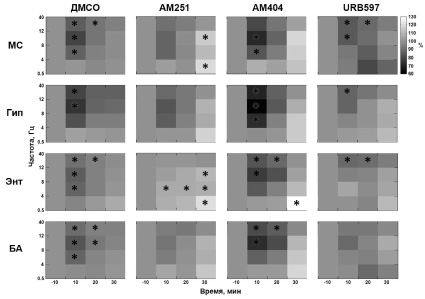
Рис. 2. Изменение мощности ЛПП медиальной септум (МС), гиппокампа (Гип), энторинальной коры (Энт) и амигдалы (БА) после введения ДМСО, AM251, AM404 либо URB597. Цветом показан процент изменения относительно фоновой активности (100 %) (* достоверное отличие от фоновой активности (–10 мин), тест Манна – Уитни U с поправкой Бонферрони, p < 0,05)
Таким образом, каннабиноиды, как правило, приводят к достаточно продолжительному снижению мощности ЭЭГ либо ЛПП разных структур мозга, вероятно, вследствие десинхронизации активности одиночных клеток, а также ингибирования глутаматергического возбуждения с положительной обратной связью, как в случае подавления риппл-осцилляций у мышей in vivo и in vitro [11]. Интересно, что блокада путей деградации эндоканнабиноидов не приводила к подобному эффекту [11], а также не изменяла гиппокампальную нейрональную активность и моторные функции [5]. Проведенное нами исследование также показало, что внутримозговое системное введение ингибитора обратного захвата эндоканнабиноидов АМ404, а также ингибитора фермента деградации анандамида URB597 не имело специфического влияния на поведение животных и активность медиальной септум, гиппокампа, энторинальной коры и амигдалы. Кратковременное понижение мощности осцилляций наблюдалось во всех экспериментальных группах, независимо от вводимого вещества. Данный эффект может быть опосредован реакцией животного на процедуру введения, а также механического действия инъецирования, поскольку ранее нами было показано, что введение физиологического раствора также кратковременно снижало ЛПП [1].
В нескольких работах показано, что антагонисты каннабиноидных рецепторов не влияют на ЛПП и нейронную активность гиппокампа [5, 11, 14]. Напротив, в настоящей работе было выявлено повышение мощности некоторых ритмов через 20 минут после введения АМ251. Данное повышение может являться следствием увеличения нейрональной активности, либо ее синхронности, что приводит к увеличению амплитуды ЛПП. Действительно, генетическое удаление или фармакологическая блокада каннабиноидных рецепторов может облегчать или даже вызывать судорожную активность, состояние, характеризуемое повышенной нейрональной возбудимостью и гиперсинхронизацией [3, 12].
Вещества, блокирующие инактивацию анандамида и 2-АГ, могут способствовать установлению физиологической роли последних, а в ряде случаев оказаться полезными при лечении заболеваний, при этом регулирование уровня эндоканнабиноидов будет вызывать более избирательную реакцию организма, нежели введение экзогенных лигандов каннабиноидных рецепторов.
Выводы
1. Ингибитор обратного захвата эндоканнабиноидов АМ404 и ингибитор фермента деградации анандамида URB597 существенно не изменяют ЛПП медиальной септум, гиппокампа, энторинальной коры и амигдалы, а также не влияют на поведение животных. Таким образом, активация ЭКС может быть достигнута посредством ингибирования ЭК транспорта и деградации без нежелательных побочных эффектов, обычно наблюдаемых при прямой активации СВ1 рецепторов агонистами.
2. Антагонист каннабиноидных рецепторов АМ251 вызывал некоторое повышение мощности ЛПП в низкочастотном диапазоне до 12 Гц через 20 минут после введения АМ251, что не сказывалось на поведении животных. Применение антагонистов каннабиноидных рецепторов в медицинской практике может иметь значительные побочные эффекты и должно проводиться с осторожностью.
Работа поддержана грантами РФФИ (№ 12-04-00776-a) и Президента Российской Федерации (НШ-850.2012.4, СП-6466.2013.4).
Рецензенты:
Архипов В.И., д.б.н., ведущий научный сотрудник лаборатории экспериментальной нейробиологии, ФГБУН «Институт теоретической и экспериментальной биофизики» РАН, г. Пущино;
Гордон Р.Я., д.б.н., ведущий научный сотрудник лаборатории Микроспектрального анализа клеток и клеточных систем, ФГБУН «Институт биофизики клетки» РАН, г. Пущино.
Работа поступила в редакцию 23.09.2014.



