Химические канцерогены окружающей среды и эндогенные стероиды, будучи низкомолекулярными органическими соединениями, не способны индуцировать синтез специфических антител (АТ). Однако под действием ферментов биотрансформацииI фазы (CYP) они превращаются в реактивные метаболиты, которые образуют аддукты с макромолекулами – ДНК и белками. Инактивацию и выведение из организма реактивных метаболитов обеспечивают ферменты II фазы биотрансформации, в том числе GST.
Аддукты низкомолекулярных ксено- и эндобиотиков, в частности бензо[а]пирена (БП) и эстрагенов, обнаружены в различных тканях человека, в частности, в плаценте [13], а также в сыворотке крови беременных женщин, плодов и новорожденных детей [10, 12, 14]. Выявлены ассоциации генетических полиморфизмов CYP и GST с количеством аддуктов, в том числе в сыворотке крови беременных женщин и плодов [15]. В ответ на образование аддуктов иммунная система реагирует синтезом гаптен-специфических АТ. АТ к БП, эстрадиолу (ЭС) и прогестерону (ПГ) обнаружены в сыворотках крови беременных женщин, в том числе при врождённых пороках развития плода (ВПРП) и при привычном невынашивании беременности [1, 4, 5].
В многочисленных экспериментах in vitro и in vivo показано, что АТ к химическим канцерогенам способны модулировать их проникновение из окружающей среды через поверхностный эпителий в кровь и распределение по разным органам [7, 9]. В свою очередь индукция АТ к стероидным гормонам приводит к повышению их содержания в сыворотке крови, нарушению эндокринной регуляции беременности и её прерыванию [6, 8].
Поэтому весьма вероятно, что АТ к химическим канцерогенам и стероидным гормонам, обнаруженные у женщин в естественных условиях, принимают участие в процессе тератогенеза и вынашивании беременности.
Цель настоящего исследования – выявить особенности взаимосвязи образования АТ к стероидным гормонам (АТ-ЭС и АТ-ПГ) с АТ к химическим канцерогенам (АТ-БП) у беременных женщин, в том числе при ВПРП.
Материалы и методы
Описание исследуемых групп.
Исследовали сыворотки венозной крови 282 беременных женщин, находящихся во II триместре беременности (13-27 недель гестации). По результатам УЗИ, у 101 женщины выявлены ВПРП, превалировали пороки сердечно-сосудистой (23,4 %), моче-выделительной (20,6 %), центральной нервной (18,3 %), костно-мышечной систем (15,8 %), а также множественные ВПРП (12 %). Средний возраст в группе составил 26,4±4,8 лет. 186 беременных женщин, являющихся условно здоровыми, были отнесены в группу сравнения. Средний возраст – 27,5±5,2 лет.
Исследования антител.
АТ к БП, ЭС и ПГ определяли методом неконкурентного ИФА в собственной модификации с использованием коньюгатов БП, ЭС и ПГ с бычьим сывороточным альбумином (БСА) [2]. В лунки полистирольных иммунологических планшетов вносили по 100 мкл коньюгата гаптен-БСА в концентрации 2 мкг/мл и инкубировали при температуре 250С в течении ночи. Для оценки фонового связывания с белком в отдельные лунки вносили неконьюгированный БСА. Для определения АТ к БП, ЭС и ПГ сыворотку крови разводили 1:20 (для IgA-АТ) и 1:100 (для IgG-АТ) блокирующим раствором. Связавшиеся АТ выявляли с помощью кроличьих АТ против IgG человека, меченых пероксидазой хрена («Sigma», Германия). Регистрацию адсорбированных на планшете АТ проводили с помощью субстратного буфера, содержащего 3,3ʼ,5,5ʼ-тетраметилбензидин (ТМБ, США), на фотометре (Пикон, Россия) при длине волны 450 нм.
Уровень AT, специфичных к БП и стероидным гормонам, определяли по формулам:
АТ-X = (OD(X-БСА) – OD(БСА)) / OD(БСА),
где OD – значение оптической плотности в соответствующих лунках, X – БП, ЭС или ПГ соответственно.
Исследование полиморфных вариантов генов детоксикации.
Используемые тест-системы для молекулярно-генетического анализа SNP- полиморфизма гена CYP1A2 (-163 A ->C) и полиморфизмов GSTM1(del) и GSTT1(del) были разработаны в ИХБФМ СО РАН (г. Новосибирск).
Исследование полиморфного варианта CYP1A2*1F проводили с помощью ПЦР/ПДРФ анализа, а GSTM1(del) и GSTT1(del) – методом мультиплексной RealTime ПЦР, как описано ранее [3]. Гетерозиготы по мутации (генотип «+/0») рассматривались в одной группе с носителями нормальных генов («+»). Отсутствие функциональной активности ферментов II фазы детоксикации GSTM1 и GSTT1 является следствием обширной делеции в соответствующем гене [11].
Статистическая обработка данных.
Статистическую обработку данных, в том числе корреляционный и регрессионный анализ, проводили при помощи пакета прикладных программ STATISTICA 6.0. С использованием критерия Шапиро-Уилка был выявлен ненормальный характер распределения выборки и в дальнейшем оценку статистической значимости различий между группами проводили при помощи непараметрического U-критерия Манна-Уитни и критерия χ2 с поправкой Йетса для непрерывной вариации.
Результаты и обсуждения
В ответ на воздействие химических канцерогенов окружающей среды и образовании их аддуктов в эпителии бронхов и желудочно-кишечного тракта иммунная система реагирует в первую очередь индукцией IgA-АТ. О выраженности местной иммунной реакции можно судить по уровню сывороточных гаптен-специфических IgA-АТ. Очевидно, что дальше развивается системный иммунный ответ – индукция IgG-АТ.
С использованием регрессионного анализа исследовали взаимосвязи уровней IgG-АТ к БП и стероидным гормонам с уровнями IgA-АТ к БП. Результаты выражали ввиде уравнений общего вида y=a×x+b, где x – уровни IgA-БП, y – уровни IgG-БП, IgG-ЭС и IgG-ПГ; коэффициент а показывает, как изменяется y при изменении x.
Выяснилось, что между исследуемыми показателями действительно имеются статистически достоверные линейные взаимосвязи разной степени выраженности (коэффициенты корреляции r=0,35 – 0,7). Результаты представлены в табл. 1-4.
При анализе искомых взаимосвязей в двух сравниваемых группах без учёта ассоциации с генетическими полиморфизмами CYP и GST обнаружили следующее (табл.1). У женщин с ФБ коэффициент а в уравнении регрессии, описывающем взаимосвязь уровней IgG-ЭС и IgA-БП, больше, чем значение а во взаимосвязях IgG-БП/IgA-БП и IgG-ПГ/IgA-БП (соответственно: 0,62; 0,49; 0,35). Это означает, что при повышении уровня IgA-БП образование IgG-ЭС происходит более интенсивно, чем IgG-БП и IgG-ПГ. У женщин с ВПРП коэффициент а в уравнении IgG-БП/IgA-БП значительно больше, а в уравнениях IgG-ЭС/IgA-БП и IgG-ПГ/IgA-БП меньше, чем в норме. Эти различия наглядно продемонстрированы на рис.1.
Таблица 1
Взаимосвязи уровней IgG-АТ к бензо[а]пирену, эстрадиолу и прогестерону с уровнями IgA-АТ к бензо[а]пирену у женщин с физиологической беременностью (ФБ) и с врождёнными пороками развития плода (ВПРП)
|
АТ |
ФБ |
ВПРП |
|||
|
х |
у |
r(p) |
y=a×x+b |
r(p) |
y=a×x+b |
|
IgA-БП |
IgG-БП |
0,39(0,00001) |
y=0,49х+1,07 |
0,64(0,00001) |
y=0,87х+0,24 |
|
IgA-БП |
IgG-ЭС |
0,35(0,00001) |
у=0,62х+0,45 |
0,55(0,00001) |
y=0,44х+0,57 |
|
IgA-БП |
IgG-ПГ |
0,35(0,00001) |
у=0,35x+0,45 |
0,5(0,00001) |
y=0,19х+0,78 |
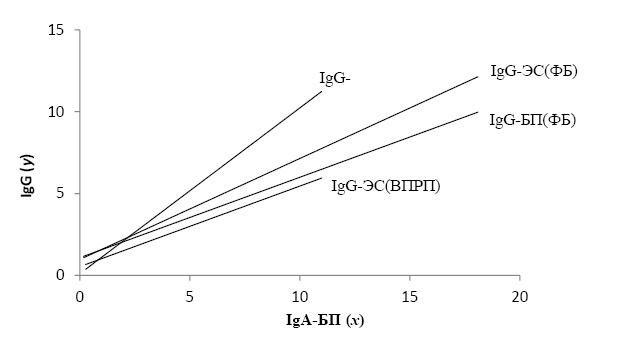
Рис. 1. Зависимость уровней IgG-антител к бензо[а]пирену и эстрадиолу от уровней IgA-антител к бензо[а]пирену у женщин с физиологической беременностью (ФБ) и с врождёнными пороками развития плода (ВПРП)
Различия между группами особенно выражены при определённых генетических вариантах ферментов биотрансформации. Например, у гомозигот А/А гена CYP1A2*1F при наличии ВПРП значение а в 5 раз больше, чем в норме (соответственно 1,76 и 0,35), и в 4 раза больше при отсутствии делеции в гене GSTM1 (1,03 и 0,24) в уравнениях регрессии между IgG-БП и IgA-БП (табл. 2).
Таблица 2
Взаимосвязи уровней IgG-АТ к бензо[а]пирену (у) с уровнями IgA-АТ к бензо[а]пирену (х) у женщин с физиологической беременностью (ФБ) и с врождёнными пороками развития плода (ВПРП) при различных полиморфных вариантах генов ферментов биотрансформации
|
Генотип |
ФБ |
ВПРП |
||
|
r(p) |
y=a×x+b |
r(p) |
y=a×x+b |
|
|
1.CYP1A2*1F A/A С/А+С/С |
0,35(0,001) 0,45(0,00015) |
y=0,35х+1,34 y=,43х+1,18 |
0,67(0,00001) 0,64(0,0003) |
y=1,76х-1,49 y=0,63х+0,61 |
|
2.GSTT1 «+» GSTT1 «0/0» |
0,38(0,00001) 0,46(0,0042) |
y=0,36х+1,05 y=0,82х+1,4 |
0,6(0,00001) 0,64(0,00002) |
y=0,74х+0,69 y=0,35х+0,83 |
|
3.GSTM1 «+» GSTM1 «0/0» |
0,35(0,0009) 0,41(0,00003) |
y=0,24х+1,39 y=0,56х+1,06 |
0,7(0,00001) 0,54(0,00005) |
y=1,03х-0,14 y=0,73х+0,58 |
Особенно интересны различия внутри обследованных групп между носителями разных вариантов одного гена. Например, у женщин с ФБ при делеции GSTM1 значение а в 7 раз выше, чем у женщин без делеции в уравнениях регрессии между IgG-ЭС и IgA-БП (табл. 3) и между IgG-ПГ и IgA-БП (табл. 4). У женщин с ВПРП – гомозигот A/A CYP1A2*1F значения а в 2-3 раза выше, чем при наличии аллели С, при анализе взаимосвязей IgG-БП, IgG-ЭС и IgG-ПГ с IgA-БП (табл. 2-4).
Таблица 3
Взаимосвязи уровней IgG-АТ к эстрадиолу (у) с уровнями IgA-АТ к бензо[а]пирену (х) у женщин с физиологической беременностью (ФБ) и с врождёнными пороками развития плода (ВПРП) при различных полиморфных вариантах генов ферментов биотрансформации
|
Генотип |
ФБ |
ВПРП |
||
|
r(p) |
y=a×x+b |
r(p) |
y=a×x+b |
|
|
1.CYP1A2*1F A/A С/А+С/С |
0,37(0,0005) 0,35(0,0005) |
y=0,48x+1,32 y=0,62x+0,86 |
0,68(0,00001) 0,44(0,0047) |
y=0,79x-0,05 y=0,27x+0,86 |
|
2.GSTT1 «+» GSTT1 «0/0» |
0,33(0,00005) 0,45(0,005) |
y=0,58x+0,74 y=0,54x+1,99 |
0,56(0,00002) 0,51(0,0011) |
y=0,36x+0,79 y=0,86x-0,32 |
|
3.GSTM1 «+» GSTM1 «0/0» |
0,19(0,046) 0,41(0,000039) |
y=0,08x+1,7 y=0,6x+1,21 |
0,62(0,00001) 0,45(0,0003) |
y=0,59x+0,22 y=0,4x+0,79 |
Таблица 4
Взаимосвязи уровней IgG-АТ к прогестерону (у) с уровнями IgA-АТ к бензо[а]пирену (х) у женщин с физиологической беременностью (ФБ) и с врождёнными пороками развития плода (ВПРП) при различных полиморфных вариантах генов ферментов биотрансформации
|
Генотип |
ФБ |
ВПРП |
||
|
r(p) |
y=a×x+b |
r(p) |
y=a×x+b |
|
|
1.CYP1A2*1F A/A С/А+С/С |
0,34(0,0017) 0,38(0,0002) |
y=0,21x+0,75 y=0,38x+0,29 |
0,67(0,00001) 0,41(0,008) |
y=0,48x+0,01 y=0,13x+0,47 |
|
2.GSTT1 «+» GSTT1 «0/0» |
0,35(0,00003) 0,44(0,006) |
y=0,33x+0,32 y=0,24x+1,02 |
0,57(0,00003) 0,42(0,0037) |
y=0,18x+0,57 y=0,43x+0,16 |
|
3.GSTM1 «+» GSTM1 «0/0» |
0,17(0,106) 0,46(0,00006) |
y=0,06x+0,99 y=0,46x+0,23 |
0,57(0,00008) 0,45(0,0013) |
y=0,3x+0,58 y=0,2x+0,67 |
Таким образом, получены подтверждения предположений [1] о том, что:
- Образование АТ к низкомолекулярным органическим ксено- и эндобиотикам в естественных условиях у человека – взаимосвязанные процессы;
- В норме эти процессы сбалансированы определённым образом (в частности, при беременности состояние иммунологического баланса описывается вышеприведёнными уравнениями регрессии);
- При нарушениях адаптации организма к генотоксическим ксенобиотикам имеет место иммунологических дисбаланс (в частности, при тератогенезе это явление описывается характерными уравнениями регрессии);
- Состояние иммунологической адаптации и дисбаланса ассоциированы с определёнными вариантами ферментов биотрансформации низкомолекулярных органических соединений.
Работа выполнена в рамках проекта № 59.1.1. Программы фундаментальных научных исследований СО РАН и поддержана грантом программы «УМНИК» по Кемеровской области.
Авторы благодарят сотрудников лаборатории иммуногенетики ИЭЧ СО РАН О.С. Попову, И.В. Шаталину за техническую поддержку настоящей работы.
Рецензенты:
Лавряшина М.Б., д.б.н., профессор кафедры генетики биологического факультета ФГБОУ ВПО «Кемеровский государственный университет», г. Кемерово;
Неверова О.А., д.б.н., профессор, заведующая лабораторией экологического биомониторинга ФГБУН Институт экологии человека Сибирского отделения РАН, г. Кемерово.
Работа поступила в редакцию 29.07.2014.



