Одним из лекарственных препаратов, относящихся к классу нестероидных противовоспалительных препаратов (НПВП), подтвердивших свой отчетливый клинический эффект и удовлетворительную переносимость, является Пироксикам. Являясь НПВП группы оксиамов, пироксикам характеризуется широким диапазоном фармакологической активности. Он оказывает противовоспалительное, анальгетическое, антиагрегантное и жаропонижающее действие [2]. При этом, согласно данным литературы, этот диапазон, имеет перспективы к расширению [4, 5]. В эксперименте было обнаружено, что пироксикам способен выступать в роли регулятора аквопорина-4, оптимально связываясь с ним, что способствует циклооксигеназонезависимому снижению формирования отека и образованию экссудата [4]. Также весьма существенной является способность пироксикама проявлять циклооксигеназонезависимую нейропротекцию, опосредованную через фосфатидилинозитол-3-киназы (PI3K)/Akt пути [5]. Так, в исследовании Tasaki Y. с соавторами показано, что пироксикам вызывает существенноее нейропротекторное действие в отношении 1-метил-4-фенил-пиридиния (МРР(+))-индуцированной токсичности в дофаминергических клетках нейробластомы человека [5].
Однако несмотря на такие серьезные фармакологические показатели, на фармацевтическом рынке Российской Федерации пироксикам зарегистрирован лишь в четырех лекарственных формах (ЛФ) – гель для наружного применения, суппозитории, таблетки и капсулы [2]. Что касается использования в детской практике, то пироксикам разрешен к применению детям с 6 лет, хотя существующие ЛФ с пироксикамом рекомендованы для детей старше 12 лет [2]. Такая несогласованность позволяет предполагать, что расширение ассортимента ЛФ приведет к персонализации терапии, с учетом особенностей каждого конкретного больного. Оптимальной представляется разработка жидкой пероральной лекарственной формы, характеризующейся высокой биологической доступностью, эффективностью, комфортностью приема. В то же время, поскольку пироксикам трудно растворим в воде [2], то его использование возможно лишь в виде суспензии, которая позволяет обеспечить пролонгированное действие. При создании пероральных ЛФ одним из существенных технологических решений является подбор оптимальной композиции вспомогательных веществ.
Цель работы – создание суспензии пироксикама, подбор композиции вспомогательных веществ – стабилизатора и пролонгатора, обеспечивающих оптимальные реологические параметры и позволяющих контролировать постоянную скорость высвобождения пироксикама из ЛФ.
Материалы и методы исследования
На предварительном этапе исследований была проанализирована серия суспензий с различной комбинацией пролонгаторов и стабилизаторов по таким значимым показателям, как стабильность, седиментационная устойчивость, ресуспендируемость. В качестве стабилизаторов использовались: лецитин, метилцеллюлоза, беницил, эмульгатор Т2, слизь семян льна, флокар, крахмальный клейстер, декстран. В качестве пролонгаторов исследовались ксантановая камедь, пласдон и коллидон. Так как пироксикам существует в двух полиморфных формах, одним из критериев отбора композиций суспензий являлось обеспечение термодинамического равновесия процесса растворения [3], что оценивалось визуально по изменению окраски ЛФ до лимонно-желтой в процессе изготовления и хранения в течение полугода. В результате для дальнейших исследований были отобраны девять композиций суспензий, представленных в табл. 1.
Таблица 1
Композиционные составы суспензий
|
№ п/п |
Композиционный состав суспензии на 100,0 г |
|
1 |
Пироксикам 0,5; лецитин 0,25; ксантановая камедь 0,2 |
|
2 |
Пироксикам 0,5; метилцеллюлоза 0,25; ксантановая камедь 0,2 |
|
3 |
Пироксикам 0,5; беницил 0,25; ксантановая камедь 0,2 |
|
4 |
Пироксикам 0,5; лецитин 0,25; пласдон 0,4 |
|
5 |
Пироксикам 0,5; метилцеллюлоза 0,25; пласдон 0,4 |
|
6 |
Пироксикам 0,5; беницил 0,25; пласдон 0,4 |
|
7 |
Пироксикам 0,5; лецитин 0,25; коллидон 0,4 |
|
8 |
Пироксикам 0,5 %; метилцеллюлоза 0,25; коллидон 0,4 |
|
9 |
Пироксикам 0,5; беницил 0,25; коллидон 0,4 |
Дальнейшие исследования по выбору оптимальной композиции стабилизатора и пролонгатора включали проведение биофармацевтических исследований in vitro. Анализ высвобождения пироксикама проводили для образцов 1–9 через полупроницаемую мембрану. Пироксикам является амфолитом, кислотные свойства, которого связаны с подвижным протоном енольной гидроксигруппы, а основные свойства обусловлены атомом азота пиридинового типа, однако более выраженными являются кислотные свойства. Поэтому в качестве диализной среды использовали 0,1 моль/л раствор кислоты хлористоводородной. Кроме того, в данном растворителе ожидалось наиболее высокое значение растворимости и его водородный показатель приближен к среде желудка (pH = 1–2) [1, 3]. Исследование проводили при температуре 37 °C. В качестве полупроницаемой мембраны использовался целлофан марки «Купрофан» с диаметром пор 0,2 мм. Отбор проб производился через 15, 30, 45, 60, 75 и 90 мин с немедленным возмещением объема диализной среды. Количественное определение пироксикама проводили спектрофотометрически, используя аналитическую длину волны 242 нм [3]. В качестве стандартного использовали раствор ГСО пироксикама с концентрацией 1·10–5 г/мл в том же растворителе.
Расчет высвобождения пироксикама проводили по формуле
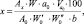
где Аx – оптическая плотность испытуемого раствора; А0 – оптическая плотность раствора стандартного образца пироксикама; а0 – навеска стандартного образца пироксикама, г; W – объем среды высвобождения, мл; 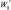 ,
,  ,
,  – разведения раствора стандартного образца пироксикама, мл; b – содержание пироксикама в испытуемом образце, г/мл.
– разведения раствора стандартного образца пироксикама, мл; b – содержание пироксикама в испытуемом образце, г/мл.
Результаты исследования и их обсуждение
Наибольшее высвобождение пироксикама на 15 мин наблюдалось из композиций № 2 и № 7. Содержание пироксикама составило 73,71 и 73,34 % соответственно. Данный уровень высвобождения был относительно постоянен с незначительным увеличением высвобождения пироксикама вплоть до 60 мин у состава № 2 и до 45 мин у состава № 7. После наступления максимумов высвобождения у данных составов наблюдалось постепенное снижение высвобождения пироксикама. Также хорошо зарекомендовал себя состав № 4. Для данной композиции наблюдалась обратная тенденция: наименьшее высвобождение пироксикама на 15 и 30 мин, что составило 35,47 и 49,32 %. Максимум высвобождения 78,97 % зафиксирован на 45 мин. Что касается 60, 75 и 90 мин, то количество высвободившегося пироксикама было относительно постоянно: 74,72; 74,08; 73,61 %. Состав № 1, несмотря на высокие стабильные показатели высвобождения пироксикама на 60, 75, 90 мин, имел очень низкие показатели на 15 и 30 мин, что может свидетельствовать о замедлении высвобождения пироксикама из лекарственного средства. Самые низкие показатели высвобождения были установлены для составов № 3, № 5, № 6, № 8, № 9. Обобщенные данные по высвобождению пироксикама из ЛФ представлены в табл. 2.
Таблица 2
Количество пироксикама, перешедшее в диализную среду, %
|
Время забора пробы Композиции суспензий |
15′ |
30′ |
45′ |
60′ |
75′ |
90′ |
|
Состав № 1 |
4,55 |
5,36 |
29,93 |
77,49 |
78,42 |
79,34 |
|
Состав № 2 |
73,71 |
73,98 |
75,92 |
72,88 |
43,97 |
34,54 |
|
Состав № 3 |
31,03 |
38,52 |
45,82 |
57,36 |
8,5 |
8,04 |
|
Состав № 4 |
35,47 |
49,32 |
78,97 |
74,72 |
74,08 |
73,61 |
|
Состав № 5 |
1,20 |
5,17 |
26,51 |
35,19 |
79,99 |
2,96 |
|
Состав № 6 |
3,88 |
9,51 |
40,18 |
22,72 |
19,40 |
9,05 |
|
Состав № 7 |
73,34 |
78,01 |
80,73 |
55,23 |
51,91 |
47,30 |
|
Состав № 8 |
1,29 |
2,40 |
6,37 |
17,83 |
6,19 |
3,05 |
|
Состав № 9 |
5,26 |
4,99 |
14,22 |
15,89 |
8,60 |
1,66 |
Составы № 2, № 4, № 7 содержали действующего вещества 0,5 г на 100,0 г суспензии. Для составов № 4 и № 7 в качестве стабилизатора использовался лецитин, в составе № 2 – метилцеллюлоза. Оба стабилизатора вводятся в суспензию в количестве 0,25 г на 100,0 г суспензии. Для составов № 4 и № 7 содержание пролонгатора было одинаковым – 0,4 г на 100,0 г суспензии. В этих составах с целью лонгации использовали пласдон и коллидон соответственно. Таким образом, при соотношении пироксикама и лецитина 0,5/0,25 на 100,0 г суспензии пласдон и коллидон проявляют близкий пролонгирующий эффект.
Состав № 2 показал аналогичный пролонгирующий эффект, но при использовании в качестве пролонгатора камеди в количестве 0,2 г на 100,0 г суспензии.
На основании полученных данных перспективными составами для дальнейших исследований, в том числе фармакологических, являются композиции состав № 2, состав № 4, состав № 7.
Заключение
Таким образом, впервые для широко известного дженерика – пироксикама – предложена оригинальная лекарственная форма – суспензия. Проведен выбор оптимальной композиции, в частности подобраны стабилизаторы и пролонгаторы.
Рецензенты:
Сливкин А.И., д.фарм.н., заведующий кафедрой фармации фармацевтического факультета, Воронежский государственный университет, г. Воронеж;
Шаталов Г.В., д.х.н., заведующий кафедрой химии высокомолекулярных соединений и коллоидов химического факультета, Воронежский государственный университет, г. Воронеж.
Работа поступила в редакцию 26.08.2014.



