Исследование трансформации тяжелых металлов после их поступления в клетку является важной задачей экологической химии. Одним из агентов, принимающих участие в детоксикации поступающих поллютантов, является глутатион [5]. Постановка модельных экспериментов по изучению взаимодействия глутатиона с ионами меди(II), определению состава, устойчивости этих комплексов и их токсичности является актуальной задачей. Сложность изучения взаимодействия акваионов меди (II) с глутатионом заключается в том, что данный лиганд достаточно легко подвергается процессу окислительной димеризации, приводящей к образованию соответствующего продукта окисления со связью S–S, обладающего лигандными свойствами, в то время как ионы [Cu(H2O)6]2+ обладают окислительными свойствами и могут превращаться в комплексные соединения Сu (I). В присутствии кислорода воздуха возможно окисление Сu (I) и, как показано в литературе [13], образование продуктов активации молекулярного кислорода, в частности супероксид анион-радикала О2–•. Это приводит к сложности однозначной интерпретации полученных экспериментальных данных. В частности, из-за этого отсутствуют систематизированные данные по исследованию состава, физико-химических свойств и токсичности комплексных соединений глутатиона с медью (II). Актуальность данного исследования определяется ролью глутатиона в живых организмах в процессе детоксикации соединений тяжёлых металлов и поддержания редокс-статуса клетки. Поэтому целью работы было исследование водных растворов с различным мольным соотношением сульфата меди (II) и глутатиона методами физико-химического и биологического анализов.
Материалы и методы исследования
Концентрации для приготовления исходных растворов выбирали с учётом растворимости образующихся соединений и рабочего интервала концентраций определяемых веществ на используемых приборах.
Образование комплексных соединений меди с глутатионом определяли методом потенциометрического и инверсионного вольтамперометрического титрования раствора сульфата меди (II) с концентрацией 1∙10–5 М раствором глутатиона с концентрацией 0,0005 М в анаэробных условиях (аргон). При потенциометрическом титровании регистрировали изменение э.д.с. на pH-метре-иономере «Эксперт-001» с медь-селективным электродом марки ЭЛИС-131, а при инверсионно-вольтамперометрическом титровании – площади пика глутатиона на вольтамперограммах, снятых на приборе «Экотест-ВА» с дисковым вращающимся электродом [7]. Методом электронной спектроскопии поглощения, используя способ изомолярных серий, исследовали растворы в соотношениях Cu(II):GSH равных 9:1, 6:1, 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:9 [1, 11]. Ультрафиолетовые спектры растворов снимали на однолучевом сканирующем спектрофотометре UNICO 2800 в интервале длин волн от 190 до 250 нм. При более высоких длинах волн ультрафиолета и в видимой части спектра пиков не наблюдали.
Три типа растворов, содержащих соль меди(II) в смеси с глутатионом в мольном соотношениях Cu(II):GSH, равных 1:0, 1:1 и 1:4 (содержание меди (II) во всех растворах одинаковое и равно 0,64 мг/дм3), протестировали биолюминесцентным и тетразольно-топографическим методами [2, 8] на культуре Nostoc linckia 273 (титр = 9,5∙109 кл/см3) из коллекции кафедры биологии растений, селекции и семеноводства, микробиологии Вятской государственной сельскохозяйственной академии. Почвенные цианобактерии Nostoc linckia 273 перспективны для использования в качестве биотест-организмов при загрязнении окружающей среды соединениями тяжёлых металлов.
Результаты исследования и их обсуждение
Данные, полученные методом спектрофотометрии, не дали сведений о составе соединений меди с глутатионом, но позволили выявить область соотношений, в которой наблюдается существование комплексов. Соединения начинают образовываться при мольном соотношении исходных веществ в смеси Cu:GSH, равном 2. При увеличении доли глутатиона доля оптической плотности, приходящейся на образующиеся соединения, возрастает и достигает максимума при соотношении 1:6. Область длин волн, в которой возможно зафиксировать образование комплексов лежит от 190 до 217 нм (рис. 1).
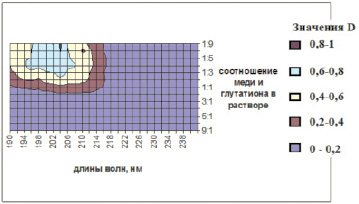
Рис. 1. Влияние состава растворов и длины волны на оптическую плотность раствора (график построен по данным, относящимся только к образующимся соединениям, и не учитывает оптическую плотность, обусловленную исходными соединениями)
Для подтверждения и уточнения данных, полученных методом спектрофотометрии, применены методы потенциометрического и инверсионно-вольтамперометрического титрования.
Данные, полученные этими двумя электрохимическими методами, подтвердили результаты спектрофотометрии относительно того, что в водном растворе при постепенном увеличении доли глутатиона первым образуется комплекс из раствора с мольным соотношением иона меди к лиганду, равным 1.
На графиках (рис. 2, 3) видно, что при прибавлении раствора глутатиона в количествах, создающих мольные соотношения с медью (II), равные 1:1, 1:2, 1:3, 1:4, 1:5 и 1:6, возникают изменения измеряемых параметров. При потенциометрическом титровании наблюдается увеличение отношения dE/dV, а при инверсионно-вольтамперометрическом – уменьшение площади пика свободного глутатиона на вольтамперограмме, что свидетельствует об образовании соединения. В растворах, где на одну молекулу GSH приходится несколько ионов меди (II), таких изменений не обнаружено.
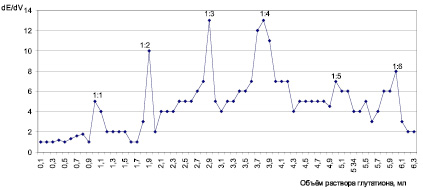
Рис. 2. Кривая потенциометрического титрования 1∙10–5 М раствора сульфата меди (II) 0,0005 М раствором глутатиона
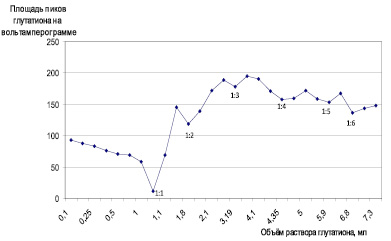
Рис. 3. Кривая инверсионно-вольтамперометрического титрования 1∙10–5 М раствора сульфата меди (II) 0,0005 М раствором глутатиона
Литературные данные, свидетельствующие об обменном механизме реакции между медью (II) и глутатионом [4, 12], позволяют предположить, что выявленные изменения обусловлены ступенчатым образованием комплексных соединений между медью (II) и глутатионом. В этом случае по результатам потенциометрического и инверсионно-вольтамперометрического титрования можно рассчитать константы устойчивости медьсодержащих комплексов глутатиона различного состава (таблица). Согласно численным значениям констант данные соединения относятся к относительно термодинамически устойчивым комплексам.
Значения lgk комплексов меди с глутатионом различного состава
|
Мольное отношение Cu:GSH |
Потенциометрия |
ИВА |
|
1:1 |
4,64 ± 0,05 |
6,21 ± 0,70 |
|
1:2 |
4,70 ± 0,05 |
3,90 ± 0,47 |
|
1:3 |
5,00 ± 0,05 |
4,72 ± 0,57 |
|
1:4 |
5,38 ± 0,06 |
5,34 ± 0,70 |
|
1:5 |
7,00 ± 0,07 |
6,02 ± 0,72 |
|
1:6 |
6,27 ± 0,07 |
6,30 ± 0,76 |
В растворе без глутатиона концентрация ионов меди 0,64 мг/дм3. При добавлении глутатиона до мольного соотношения с медью 1:1 исходная концентрация меди (ІІ) уменьшается в два раза, а при добавлении пептида до соотношения 1:6 – уже в 60 раз. Соответственно, при увеличении доли глутатиона, должен уменьшаться обусловленный медью (II) токсический эффект.
Для выявления влияния глутатиона на токсичность соли меди (II), были протестированы растворы с мольными соотношениями Cu:GSH равными 1:0, 1:1 и 1:4 (рис. 4 и 5).
Достоверных различий между вариантами при исследовании тетразольно-топографическим методом не обнаружено, но есть тенденция: с увеличением количества глутатиона в растворе уменьшается содержание формазана в клетках ЦБ, указывающее на увеличение токсичности (рис. 4). Данные, полученные в результате исследования биохемилюминесценции, показывают, что при увеличении содержания глутатиона увеличивается ИБХЛ культуры, что, скорее всего, также связано с усилением токсичности. Однако известно, что лиганд (глутатион) является важнейшим компонентом всех живых систем, и увеличение токсичности за его счёт маловероятно. Одна из функций глутатиона – защита организма от действия ТМ, а результаты исследований показывают увеличение токсичности с ростом его концентрации.
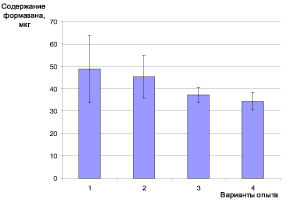
Рис. 4. Влияние соединений меди (II) на накопление формазана клетками цианобактерий Nostoc linckia 273: 1 – контроль (вода); 2 – Сu 2+ ; 3 – Сu:GSH – 1:1; 4 – Сu:GSH – 1:4
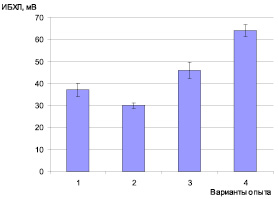
Рис. 5. Влияние соединений меди (II) на интенсивность биохемилюминесценции цианобактерий Nostoc linckia 273: 1 – контроль (вода); 2 – Сu 2+ ; 3 – Сu:GSH – 1:1; 4 – Сu:GSH – 1:4
Анализ суспензии ЦБ показал, что с увеличением доли глутатиона в растворе появляется тенденция к увеличению содержания меди как в лиофобной, так и лиофильной фракциях клеток культуры, в большей степени в лиофильной (без глутатиона – 24 ± 8 мкг; 1:1 – 33 ± 11 мкг и 1:4 – 44 ± 14 мкг в лиофильной фракции; 74 ± 22; 77 ± 23; 96 ± 29 мкг соответственно в лиофобной фракции). Вероятнее всего, глутатион повышает биодоступность меди, и чем выше доля глутатиона в растворе, тем больше меди обнаружено в клетках. Соответственно, чем больше меди внутри клеток, тем токсичнее оказываются растворы согласно результатам тетразольно-топографического метода и тем интенсивнее биолюминесценция. Соединения меди с органическими лигандами усиливают биолюминесценцию за счет образования комплексов с кислородом и продуктами его активации [3, 10]. В частности, присоединение молекулярного кислорода к комплексам меди приводит, в зависимости от природы органического лиганда, к тому, что образуются соединения Cu(II) с супероксид анион-радикалом О2–• или соединения Cu(III) с пероксидным анионом О22– [14]. Радикалы окисляют компоненты клетки, в ходе этих реакций выделяется энергия, обусловливающая увеличение люминесценции [6].
Выводы
- Установлено, что при приливании раствора глутатиона мольных соотношениях с медью (II) 1:1, 1:2, 1:3, 1:4, 1:5 и 1:6 в анаэробных условиях возникают резкие изменения измеряемых параметров: в потенциометрическом титровании увеличение dE/dV, а в инверсионно-вольтамперометрическом – уменьшение площади пика глутатиона восстановленного на вольтамперограмме, что свидетельствует о том, что в данный момент образовалось какое-то соединение. В растворах, где на одну молекулу GSH приходится несколько ионов меди, таких изменений не происходит. Рассчитанные значения констант устойчивости свидетельствуют об образовании относительно термодинамически устойчивых комплексов.
- Выявлено, что глутатион способствует повышению биологической доступности меди (ІІ), особенно в тех соединениях, где доля глутатиона выше.
- Глутатион может обеспечивать в организме накопление соединений меди (ІІ) и наоборот, недоступное для организма количество металла глутатион может сделать доступным.
- Явление усиления биодоступности меди за счет образования комплексов с глутатионом следует учитывать при выборе тест-объектов при проведении биотестирования.
Рецензенты:
Алемасова А.С., д.х.н., профессор, заведующая кафедрой аналитической химии Донецкого национального университета Министерства образования и науки Украины, г. Донецк;
Воробьёв-Десятовский Н.В., д.х.н., профессор, начальник Управления ЗОА «Полиметалл Инжиниринг», г. Санкт-Петербург.
Работа поступила в редакцию 10.07.2014.



