В процессе проведения протезирования клапанов аппарата сердца используется аппаратное экстракорпоральное (искусственное) кровообращение (ИК). Применение ИК позволяет осуществлять операции на открытом сердце, однако сопровождается длительной ишемией тканей. Последующая реперфузия вызывает изменения в активности эндотелиальных клеток и интенсивности миграции лейкоцитов к очагу поражения. Воспалительный и окислительный каскады, опосредованные ишемией и реперфузией, проявляют наиболее выраженные эффекты в отношении травмы эндотелия на микроциркуляторном уровне. [6]. Одновременно активация эндотелия и лейкоцитов в процессе реперфузии оказывает неконтролируемый прокоагулянтный и провоспалительный эффект, который в конечном итоге приводит к нарушениям функций эндотелия, микротромбообразованию и неспособности регулирования местного кровотока в жизненно важных органах [4], итогом является последующее формирование органных дисфункций [5].
Здоровый эндотелий представляет собой неадгезивную поверхность. Первичные контакты клеточных элементов с сосудистой стенкой выражаются в эффекте скольжения лимфоцитарной клетки вдоль эндотелия. В категории молекул, стимулирующих неактивированные полиморфноядерные лимфоциты к созданию первичных контактов с эндотелиальным слоем, наиболее активным семейством являются селектины. [9]. Р-селектин, Е-селектин и L-селектин являются основными молекулами адгезии, обеспечивающими контакт с эндотелием и миграцию лейкоцитов. Селектины обеспечивают «прилипание» лейкоцитов к эндотелию, их проникновение через стенки сосуда и трасэндотелиальную миграцию в ткани [3]. В результате усиления адгезионной активности процесс «скольжения» замедляется, увеличивается время контакта лейкоцитов с эндотелием и медиаторами воспаления. Регистрируемый избыток адгезивных молекул свидетельствует о нарушении механизмов регуляции воспаления [2]. Однако имеющиеся публикации, посвящённые этой проблеме, не отражают значения динамических изменений молекул адгезии для развития системного воспаления в раннем послеоперационном периоде у данной категории пациентов.
Цель ‒ изучить динамику Р-, Е- и L-селектинов при различных вариантах системного воспалительного ответа у пациентов с приобретёнными пороками сердца после оперативной коррекции клапанного порока в условиях искусственного кровообращения.
Материалы и методы исследования
Исследование являлось когортным ретроспективным. В качестве модели выбран инфекционный эндокардит как один из этиологических факторов приобретённых пороков сердца. В исследование включено 110 пациентов (71 мужчина (64,5 %) и 39 женщин (35,5 %) в возрасте 50 (36; 58) лет с верифицированным диагнозом инфекционный эндокардит, подвергшихся оперативному вмешательству на открытом сердце в условиях искусственного кровообращения в объёме клапанного протезирования на базе ФГБУ «НИИ КПССЗ» СО РАМН г. Кемерово, Россия, с 2010 по 2013 годы.
Критериями включения в группу исследования являлись установленный клинически и инструментально диагноз инфекционного эндокардита, возраст не менее 20 и не более 70 лет, подписанное информированное согласие на участие в исследовании; критериями исключения служили: смена диагноза по результатам морфологического исследования удаленных тканей, сочетанные операции, наличие в анамнезе злокачественных новообразований, отказ от участия в исследовании, развитие в послеоперационном госпитальном периоде (до момента выписки) осложнений инфекционного генеза (сепсис и другие похожие состояния).
Диагноз инфекционного эндокардита установлен на основании клинической картины, анамнестических данных и клинико-лабораторных методов исследования (трехкратные бактериологические исследования посевов крови, данные ЭХО-кардиографии, результаты гистологического исследования удалённых во время операции клапанов сердца).
Все пациенты прошли предоперационную подготовку (в том числе курс антибиотикотерапии), находились в «холодном периоде» основного заболевания (степень активности инфекционного эндокардита на момент операции минимальна), были компенсированы по степени ХСН (не более IIБ стадии по Василенко ‒ Стражеско, ФК ХСН от II до III), и подверглись оперативному вмешательству в объёме протезирования клапана сердца в условиях ИК. Длительность ИК при проведении операции составила 115 (85; 150) минут, а время пережатия аорты 81 (60; 109) минут.
Летальность во всей анализируемой группе составила 2,72 % (3 человека). Летальные исходы являлись результатом прогрессирования осложнений синдрома системного воспалительного ответа, развития необратимых вариантов полиорганной недостаточности и зарегистрированы на 13, 15 и 21 сутки после операции.
По характеру течения раннего послеоперационного периода пациенты были разделены на три группы. Наличие СВО в послеоперационном периоде оценивали по критериям R. Bone (Bone R.C. 1992), степень тяжести состояния пациента – по шкале APACHE II (Acute Physiology And Chronic Helth Evalution) (Knaus W.A., 1985), степень полиорганной недостаточности (ПОН) по шкале SOFA (Sepsis-Related Organ Failure Assessment) (J.-L. Vincent et al., 1996).
В 1-ю группу (без осложнений) вошли 38 (34,6 %) пациентов – не более 2-х признаков СВО по R. Bone, APACHE II 0–1 балл, SOFA – 0–1 балл. Во 2-ю группу (осложненный СВО) вошли 47 (42,7 %) пациентов – 3 и более критерия по R. Bone, APACHE II 2–3 балла SOFA – 1–2 балла в 1-е сутки. И 25 человек (22,7 %) (включая 3-х пациентов с летальным исходом) составили 3-ю группу (СВО с ПОН) – 3 и более признака СВО по R. Bone, APACHE II 3–4 балла и более 3 баллов по шкале SOFA.
Кровь забирали из центральной локтевой вены в вакуумные коммерческие пробирки с активатором свёртывания. Кровь центрифугировали, сыворотку аликвотировали, хранили при –70 °C. Концентрацию селектинов в сыворотке крови определяли методом твердофазного иммуноферментного анализа с использованием коммерческих наборов «Human-sL selectin», «Human-sE selectin» и «Human-sP selectin» BenderMed Systems (USA), предназначенных для научных исследований. Концентрации определялись до операции, в 1-е и на 7-е сутки после операции. Использовали пакет программного обеспечения Statistica 6.0. (StatSoftInc., США Серийный номер: AXXR003E608729FAN10). Статистический анализ проводили непараметрическими методами. Результаты выражали в виде медианы (МЕ) и 25 и 75 % межквартильных отклонений (25Q; 75Q). Различия считали значимыми при уровне р < 0,01.
Результаты исследования и их обсуждение
Определили, что на всем протяжении наблюдения в концентрации P-селектина между группами не имелось достоверных различий (Н = 3,23, р = 0,19 до операции, Н = 3,05, р = 0,22 в 1-е сутки и Н = 5,54, р = 0,06 на 7-е) (таблица). Известно, что высокие сывороточные концентрации Р-селектина определяются в острую фазу воспаления, являясь одним из звеньев патогенеза воспалительного процесса [8]. Р-селектин опосредует адгезию моноцитов к эндотелию посткапиллярных венул и связан с формированием синдрома диссеминированного сосудистого свёртывания [1].
Концентрации P-селектина у пациентов с инфекционным эндокардитом после хирургической коррекции порока клапана сердца, нг/мл
|
Группа |
Время взятия крови для исследования |
||
|
До операции |
1-е сутки |
7-е сутки |
|
|
1 (n = 26) |
213,00 (88,23; 458,00) |
259,70 (66,35; 486,00) |
342,60 (70,34; 453,00) |
|
2 (n = 26) |
356,15 (73,69; 414,00) |
366,75 (78,88; 453,40) |
266,10 (76,96; 420,90) |
|
3 (n = 16) |
122,4 (46,26; 280,70) |
112,00 (65,67; 254,70) |
74,47 (59,47; 162,40) |
Соответственно, одинаковый уровень Р-селектина во всех группах связан с ранее сформированным, в результате развития основного заболевания, нарушением реологии крови. Отсутствие значимых изменений в концентрациях указывает на продолжающуюся в течение всего периода наблюдения дискоординацию адгезии иммунокомпетентных клеток к эндотелию, не имеющую разрешения к 7-м суткам ни в одной из изучаемых групп.
Значимые отличия между анализируемыми группами были выявлены в ходе анализа динамики Е-селектина. Так, на дооперационном этапе концентрации в группе СВО и ПОН находились на уровне (137,75 (62,00;176,15) пг/мл) и превышали таковой как 1-й (50,38 (34,42; 59,05) пг/мл, р < 0,00001), так и 2-й группы (55,55 (42,70; 77,75) пг/мл, р = 0,00003). Между уровнями первых двух групп значимые отличия отсутствовали (р = 0,13) (рисунок).
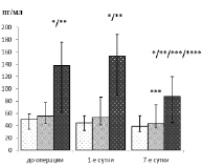 sE-селектин
sE-селектин sL-селектин
sL-селектин
 – 1-я группа;
– 1-я группа;  – 2-я группа;
– 2-я группа;  – 3-я группа
– 3-я группа
* – р < 0,01 по отношению к группе без осложнений в данное время
** – р < 0,01 по отношению к группе с осложнённым СВО в данное время
*** – р < 0,01 по отношению к дооперационному уровню
*** – р < 0,01 по отношению к 1-м суткам
**** ‒ р < 0,01 по отношению к 1-м суткам после операции
Динамика молекул адгезии в течение периода наблюдения у пациентов с инфекционным эндокардитом, оперированных по поводу клапанного порока
Количество Е-селектина в 1-е сутки увеличилось до 153,60 (89,86; 188,60) пг/мл в группе СВО с ПОН, против 44,92 (32,32; 55,90) пг/мл в 1-й группе и 53,24 (41,10; 86,45) пг/мл во 2-й группе. Одновременно определялись достоверные отличия в уровнях между 1-й и 3-й (р = 0,003) и между 2-й и 3-й (р = 0,005) группами. А также регистрировались значимые отличия в уровнях между 1-й и 2-й группами (в последней количество Е-селектина в это время выше), однако установленный порог значимости не был достигнут (р = 0,03).
К 7-м суткам в 1-й группе изменений в уровнях Е-селектина не произошло (38,81 (29,66; 56,15) пг/мл, р ˃ 0,01). При том, что после подъёма в 1-е сутки в двух группах с осложнениями к 7-м наблюдается значимое их снижение (р = 0,003 для 2-й и р = 0,002 для 3-й). Но если у 2-й группы Е-селектин на 7-е сутки определялся на дооперационном уровне (43,26 (35,91; 73,65) пг/мл, р = 0,12), то в 3-й группе они опускались ниже дооперационных (87,67 (45,10; 120,20) пг/мл, р = 0,003). Одновременно количество Е-селектина у пациентов 3-й группы превышало таковое и 1-й (р = 0,0002) и у 2-й (р = 0,0009) групп.
Избыточная экспрессия молекул адгезии, как и повышенное «слущивание» их с поверхности клеток, свидетельствует о нарушении механизмов регуляции воспаления [2]. Опосредованное через Е-селектин повышение инициализации «прилипания» к эндотелию, усиление миграционной активности лейкоцитов приводит к микротромбообразованию, что находит отражение в клиническом проявлении органных дисфункций у группы СВО с ПОН.
В отношении L-селектина были выявлены некоторые особенности динамики в зависимости от варианта течения СВО. Так, до операции в группе без осложнений определялись самые низкие концентрации (3,41 (2,81;3,45) нг/мл против 3,5 (3,23;404) нг/мл 2-й и 4,23 (3,65;4,83) нг/мл 3-й групп) из всех трёх групп наблюдения (рисунок). При этом регистрировались значимые отличия между концентрациями группы СВО с ПОН по отношению к 1-й (р = 0,00007) и 2-й (р = 0,004) группам. В дальнейшем количество L-селектина группы без осложнений снижалось в 1-е сутки (2,9 (2,67;3,36) нг/мл, р = 0,0009) и возвращалось к исходному на 7-е (3,21(2,84;3,47) нг/мл), р = 0,35). В группе осложнённого СВО значимой динамики концентраций L-селектина на протяжении всего времени наблюдения не было (3,37 (3,25;3,57) нг/мл и 3,5 (3,07;4,10) нг/мл соответственно в 1-е и 7-е сутки, χ2 = 3,32, р = 0,19). А в группе СВО с ПОН изменения были сходными с динамикой 1-й группы – снижение в 1-е сутки (3,4 (3,17;4,17) нг/мл, р = 0,01) и возвращение к исходным на 7-е (4,01 (3,21; 4,46) нг/мл, р = 0,08). Однако количество L-селектина у группы СВО с ПОН было выше, чем у группы без осложнений (р = 0,005 в 1-е и р = 0,0006 на 7-е сутки), тогда как достоверных отличий от 2-й группы не было (р = 0,44 и р = 0,06 соответственно).
Высокие концентрации функциональноактивного L-селектина в циркулирующем кровотоке могут приводить к повреждению эндотелия мелких сосудов за счёт увеличения адгезии полиморфноядерных нейтрофилов, последующего выхода лейкоцитарных ферментов и развитию воспаления в микрокапиллярах различных тканей и органов. Также, по литературным данным [7], в патогенезе органной недостаточности играет роль усиление тромбообразования и капиллярное постоперационное кровотечение. Высокие уровни L-селектина во всех группах исследования свидетельствуют об активности лейкоцитов на всем протяжении наблюдения, у группы СВО с ПОН степень активации выше, чем в двух первых группах. Состояние активности лейкоцитов ещё до операции, демонстрируемое количеством L-селектина, по-видимому, сформировано за счёт реализации воспаления в патогенезе основного заболевания. Следствием дисфункции в регулировании активности лейкоцитов является проявление недостаточности органов, имеющее наибольшие клинические проявления у пациентов группы СВО с ПОН.
Выводы
У пациентов с инфекционным эндокардитом до операции имеется повышенная активность лейкоцитов и эндотелия, характеризующаяся высокими уровнями L- и Р-селектинов. В группе пациентов, у которых после оперативного лечения наблюдали осложнения системного воспалительного ответа с полиорганной недостаточностью, дисфункция дополняется высокими концентрациями Е-селектина. В дальнейшем наиболее выраженные изменения касаются увеличения количества Е-селектина в группе СВО с ПОН, которое значимо (р < 0,01) превышали значения таковых у пациентов двух других групп в 1-е сутки после операции. Проведённое исследование показало, что у данной категории пациентов дисфункция механизмов активации эндотелия формируется на этапе основного заболевания, а развитие системного воспалительного ответа, индуцированного оперативным вмешательством в условиях искусственного кровообращения, является дополнительным стимулирующим фактором.
Ограничение исследования: полученные данные характеризуют группу лиц, имеющих диагноз «инфекционный эндокардит», и их следует с осторожностью интерпретировать для других категорий пациентов.
Рецензенты:
Лисаченко Г.В., д.м.н., профессор кафедры патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово;
Коростелёв А.А., д.м.н., профессор кафедры оториноларингологии и клинической иммунологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово.
Работа поступила в редакцию 04.06.2014.



