В процессе проведения протезирования клапанов аппарата сердца используется аппаратное экстракорпоральное (искусственное) кровообращение (ИК). Применение ИК позволяет осуществлять операции на открытом сердце, однако сопровождается длительной ишемией тканей. Последующая реперфузия вызывает изменения в активности эндотелиальных клеток и интенсивности миграции лейкоцитов к очагу поражения. Воспалительный и окислительный каскады, опосредованные ишемией и реперфузией, проявляют наиболее выраженные эффекты в отношении травмы эндотелия на микроциркуляторном уровне. [6]. Одновременно активация эндотелия и лейкоцитов в процессе реперфузии оказывает неконтролируемый прокоагулянтный и провоспалительный эффект, который в конечном итоге приводит к нарушениям функций эндотелия, микротромбообразованию и неспособности регулирования местного кровотока в жизненно важных органах [4], итогом является последующее формирование органных дисфункций [5].
Здоровый эндотелий представляет собой неадгезивную поверхность. Первичные контакты клеточных элементов с сосудистой стенкой выражаются в эффекте скольжения лимфоцитарной клетки вдоль эндотелия. В категории молекул, стимулирующих неактивированные полиморфноядерные лимфоциты к созданию первичных контактов с эндотелиальным слоем, наиболее активным семейством являются селектины. [9]. Р-селектин, Е-селектин и L-селектин являются основными молекулами адгезии, обеспечивающими контакт с эндотелием и миграцию лейкоцитов. Селектины обеспечивают «прилипание» лейкоцитов к эндотелию, их проникновение через стенки сосуда и трасэндотелиальную миграцию в ткани [3]. В результате усиления адгезионной активности процесс «скольжения» замедляется, увеличивается время контакта лейкоцитов с эндотелием и медиаторами воспаления. Регистрируемый избыток адгезивных молекул свидетельствует о нарушении механизмов регуляции воспаления [2]. Однако имеющиеся публикации, посвящённые этой проблеме, не отражают значения динамических изменений молекул адгезии для развития системного воспаления в раннем послеоперационном периоде у данной категории пациентов.
Цель ‒ изучить динамику Р-, Е- и L-селектинов при различных вариантах системного воспалительного ответа у пациентов с приобретёнными пороками сердца после оперативной коррекции клапанного порока в условиях искусственного кровообращения.
Материалы и методы исследования
Исследование являлось когортным ретроспективным. В качестве модели выбран инфекционный эндокардит как один из этиологических факторов приобретённых пороков сердца. В исследование включено 110 пациентов (71 мужчина (64,5 %) и 39 женщин (35,5 %) в возрасте 50 (36; 58) лет с верифицированным диагнозом инфекционный эндокардит, подвергшихся оперативному вмешательству на открытом сердце в условиях искусственного кровообращения в объёме клапанного протезирования на базе ФГБУ «НИИ КПССЗ» СО РАМН г. Кемерово, Россия, с 2010 по 2013 годы.
Критериями включения в группу исследования являлись установленный клинически и инструментально диагноз инфекционного эндокардита, возраст не менее 20 и не более 70 лет, подписанное информированное согласие на участие в исследовании; критериями исключения служили: смена диагноза по результатам морфологического исследования удаленных тканей, сочетанные операции, наличие в анамнезе злокачественных новообразований, отказ от участия в исследовании, развитие в послеоперационном госпитальном периоде (до момента выписки) осложнений инфекционного генеза (сепсис и другие похожие состояния).
Диагноз инфекционного эндокардита установлен на основании клинической картины, анамнестических данных и клинико-лабораторных методов исследования (трехкратные бактериологические исследования посевов крови, данные ЭХО-кардиографии, результаты гистологического исследования удалённых во время операции клапанов сердца).
Все пациенты прошли предоперационную подготовку (в том числе курс антибиотикотерапии), находились в «холодном периоде» основного заболевания (степень активности инфекционного эндокардита на момент операции минимальна), были компенсированы по степени ХСН (не более IIБ стадии по Василенко ‒ Стражеско, ФК ХСН от II до III), и подверглись оперативному вмешательству в объёме протезирования клапана сердца в условиях ИК. Длительность ИК при проведении операции составила 115 (85; 150) минут, а время пережатия аорты 81 (60; 109) минут.
Летальность во всей анализируемой группе составила 2,72 % (3 человека). Летальные исходы являлись результатом прогрессирования осложнений синдрома системного воспалительного ответа, развития необратимых вариантов полиорганной недостаточности и зарегистрированы на 13, 15 и 21 сутки после операции.
По характеру течения раннего послеоперационного периода пациенты были разделены на три группы. Наличие СВО в послеоперационном периоде оценивали по критериям R. Bone (Bone R.C. 1992), степень тяжести состояния пациента – по шкале APACHE II (Acute Physiology And Chronic Helth Evalution) (Knaus W.A., 1985), степень полиорганной недостаточности (ПОН) по шкале SOFA (Sepsis-Related Organ Failure Assessment) (J.-L. Vincent et al., 1996).
В 1-ю группу (без осложнений) вошли 38 (34,6 %) пациентов – не более 2-х признаков СВО по R. Bone, APACHE II 0–1 балл, SOFA – 0–1 балл. Во 2-ю группу (осложненный СВО) вошли 47 (42,7 %) пациентов – 3 и более критерия по R. Bone, APACHE II 2–3 балла SOFA – 1–2 балла в 1-е сутки. И 25 человек (22,7 %) (включая 3-х пациентов с летальным исходом) составили 3-ю группу (СВО с ПОН) – 3 и более признака СВО по R. Bone, APACHE II 3–4 балла и более 3 баллов по шкале SOFA.
Кровь забирали из центральной локтевой вены в вакуумные коммерческие пробирки с активатором свёртывания. Кровь центрифугировали, сыворотку аликвотировали, хранили при –70 °C. Концентрацию селектинов в сыворотке крови определяли методом твердофазного иммуноферментного анализа с использованием коммерческих наборов «Human-sL selectin», «Human-sE selectin» и «Human-sP selectin» BenderMed Systems (USA), предназначенных для научных исследований. Концентрации определялись до операции, в 1-е и на 7-е сутки после операции. Использовали пакет программного обеспечения Statistica 6.0. (StatSoftInc., США Серийный номер: AXXR003E608729FAN10). Статистический анализ проводили непараметрическими методами. Результаты выражали в виде медианы (МЕ) и 25 и 75 % межквартильных отклонений (25Q; 75Q). Различия считали значимыми при уровне р < 0,01.
Результаты исследования и их обсуждение
Определили, что на всем протяжении наблюдения в концентрации P-селектина между группами не имелось достоверных различий (Н = 3,23, р = 0,19 до операции, Н = 3,05, р = 0,22 в 1-е сутки и Н = 5,54, р = 0,06 на 7-е) (таблица). Известно, что высокие сывороточные концентрации Р-селектина определяются в острую фазу воспаления, являясь одним из звеньев патогенеза воспалительного процесса [8]. Р-селектин опосредует адгезию моноцитов к эндотелию посткапиллярных венул и связан с формированием синдрома диссеминированного сосудистого свёртывания [1].
Концентрации P-селектина у пациентов с инфекционным эндокардитом после хирургической коррекции порока клапана сердца, нг/мл
|
Группа |
Время взятия крови для исследования |
||
|
До операции |
1-е сутки |
7-е сутки |
|
|
1 (n = 26) |
213,00 (88,23; 458,00) |
259,70 (66,35; 486,00) |
342,60 (70,34; 453,00) |
|
2 (n = 26) |
356,15 (73,69; 414,00) |
366,75 (78,88; 453,40) |
266,10 (76,96; 420,90) |
|
3 (n = 16) |
122,4 (46,26; 280,70) |
112,00 (65,67; 254,70) |
74,47 (59,47; 162,40) |
Соответственно, одинаковый уровень Р-селектина во всех группах связан с ранее сформированным, в результате развития основного заболевания, нарушением реологии крови. Отсутствие значимых изменений в концентрациях указывает на продолжающуюся в течение всего периода наблюдения дискоординацию адгезии иммунокомпетентных клеток к эндотелию, не имеющую разрешения к 7-м суткам ни в одной из изучаемых групп.
Значимые отличия между анализируемыми группами были выявлены в ходе анализа динамики Е-селектина. Так, на дооперационном этапе концентрации в группе СВО и ПОН находились на уровне (137,75 (62,00;176,15) пг/мл) и превышали таковой как 1-й (50,38 (34,42; 59,05) пг/мл, р < 0,00001), так и 2-й группы (55,55 (42,70; 77,75) пг/мл, р = 0,00003). Между уровнями первых двух групп значимые отличия отсутствовали (р = 0,13) (рисунок).
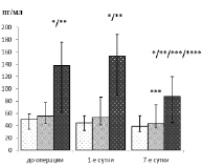 sE-селектин
sE-селектин sL-селектин
sL-селектин
 – 1-я группа;
– 1-я группа;  – 2-я группа;
– 2-я группа;  – 3-я группа
– 3-я группа
* – р < 0,01 по отношению к группе без осложнений в данное время
** – р < 0,01 по отношению к группе с осложнённым СВО в данное время
*** – р < 0,01 по отношению к дооперационному уровню
*** – р < 0,01 по отношению к 1-м суткам
**** ‒ р < 0,01 по отношению к 1-м суткам после операции
Динамика молекул адгезии в течение периода наблюдения у пациентов с инфекционным эндокардитом, оперированных по поводу клапанного порока
Количество Е-селектина в 1-е сутки увеличилось до 153,60 (89,86; 188,60) пг/мл в группе СВО с ПОН, против 44,92 (32,32; 55,90) пг/мл в 1-й группе и 53,24 (41,10; 86,45) пг/мл во 2-й группе. Одновременно определялись достоверные отличия в уровнях между 1-й и 3-й (р = 0,003) и между 2-й и 3-й (р = 0,005) группами. А также регистрировались значимые отличия в уровнях между 1-й и 2-й группами (в последней количество Е-селектина в это время выше), однако установленный порог значимости не был достигнут (р = 0,03).
К 7-м суткам в 1-й группе изменений в уровнях Е-селектина не произошло (38,81 (29,66; 56,15) пг/мл, р ˃ 0,01). При том, что после подъёма в 1-е сутки в двух группах с осложнениями к 7-м наблюдается значимое их снижение (р = 0,003 для 2-й и р = 0,002 для 3-й). Но если у 2-й группы Е-селектин на 7-е сутки определялся на дооперационном уровне (43,26 (35,91; 73,65) пг/мл, р = 0,12), то в 3-й группе они опускались ниже дооперационных (87,67 (45,10; 120,20) пг/мл, р = 0,003). Одновременно количество Е-селектина у пациентов 3-й группы превышало таковое и 1-й (р = 0,0002) и у 2-й (р = 0,0009) групп.
Избыточная экспрессия молекул адгезии, как и повышенное «слущивание» их с поверхности клеток, свидетельствует о нарушении механизмов регуляции воспаления [2]. Опосредованное через Е-селектин повышение инициализации «прилипания» к эндотелию, усиление миграционной активности лейкоцитов приводит к микротромбообразованию, что находит отражение в клиническом проявлении органных дисфункций у группы СВО с ПОН.
В отношении L-селектина были выявлены некоторые особенности динамики в зависимости от варианта течения СВО. Так, до операции в группе без осложнений определялись самые низкие концентрации (3,41 (2,81;3,45) нг/мл против 3,5 (3,23;404) нг/мл 2-й и 4,23 (3,65;4,83) нг/мл 3-й групп) из всех трёх групп наблюдения (рисунок). При этом регистрировались значимые отличия между концентрациями группы СВО с ПОН по отношению к 1-й (р = 0,00007) и 2-й (р = 0,004) группам. В дальнейшем количество L-селектина группы без осложнений снижалось в 1-е сутки (2,9 (2,67;3,36) нг/мл, р = 0,0009) и возвращалось к исходному на 7-е (3,21(2,84;3,47) нг/мл), р = 0,35). В группе осложнённого СВО значимой динамики концентраций L-селектина на протяжении всего времени наблюдения не было (3,37 (3,25;3,57) нг/мл и 3,5 (3,07;4,10) нг/мл соответственно в 1-е и 7-е сутки, χ2 = 3,32, р = 0,19). А в группе СВО с ПОН изменения были сходными с динамикой 1-й группы – снижение в 1-е сутки (3,4 (3,17;4,17) нг/мл, р = 0,01) и возвращение к исходным на 7-е (4,01 (3,21; 4,46) нг/мл, р = 0,08). Однако количество L-селектина у группы СВО с ПОН было выше, чем у группы без осложнений (р = 0,005 в 1-е и р = 0,0006 на 7-е сутки), тогда как достоверных отличий от 2-й группы не было (р = 0,44 и р = 0,06 соответственно).
Высокие концентрации функциональноактивного L-селектина в циркулирующем кровотоке могут приводить к повреждению эндотелия мелких сосудов за счёт увеличения адгезии полиморфноядерных нейтрофилов, последующего выхода лейкоцитарных ферментов и развитию воспаления в микрокапиллярах различных тканей и органов. Также, по литературным данным [7], в патогенезе органной недостаточности играет роль усиление тромбообразования и капиллярное постоперационное кровотечение. Высокие уровни L-селектина во всех группах исследования свидетельствуют об активности лейкоцитов на всем протяжении наблюдения, у группы СВО с ПОН степень активации выше, чем в двух первых группах. Состояние активности лейкоцитов ещё до операции, демонстрируемое количеством L-селектина, по-видимому, сформировано за счёт реализации воспаления в патогенезе основного заболевания. Следствием дисфункции в регулировании активности лейкоцитов является проявление недостаточности органов, имеющее наибольшие клинические проявления у пациентов группы СВО с ПОН.
Выводы
У пациентов с инфекционным эндокардитом до операции имеется повышенная активность лейкоцитов и эндотелия, характеризующаяся высокими уровнями L- и Р-селектинов. В группе пациентов, у которых после оперативного лечения наблюдали осложнения системного воспалительного ответа с полиорганной недостаточностью, дисфункция дополняется высокими концентрациями Е-селектина. В дальнейшем наиболее выраженные изменения касаются увеличения количества Е-селектина в группе СВО с ПОН, которое значимо (р < 0,01) превышали значения таковых у пациентов двух других групп в 1-е сутки после операции. Проведённое исследование показало, что у данной категории пациентов дисфункция механизмов активации эндотелия формируется на этапе основного заболевания, а развитие системного воспалительного ответа, индуцированного оперативным вмешательством в условиях искусственного кровообращения, является дополнительным стимулирующим фактором.
Ограничение исследования: полученные данные характеризуют группу лиц, имеющих диагноз «инфекционный эндокардит», и их следует с осторожностью интерпретировать для других категорий пациентов.
Рецензенты:
Лисаченко Г.В., д.м.н., профессор кафедры патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово;
Коростелёв А.А., д.м.н., профессор кафедры оториноларингологии и клинической иммунологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово.
Работа поступила в редакцию 04.06.2014.
Библиографическая ссылка
Понасенко А.В., Хуторная М.В., Антонова Л.В., Кондюкова Н.В., Головкин А.С., Григорьев Е.В. ДИНАМИКА КОНЦЕНТРАЦИЙ МОЛЕКУЛ КЛЕТОЧНОЙ АДГЕЗИИ ПРИ ФОРМИРОВАНИИ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА ПОСЛЕ ОПЕРАТИВНОГО ЛЕЧЕНИЯ ПРИОБРЕТЁННЫХ ПОРОКОВ СЕРДЦА // Фундаментальные исследования. 2014. № 7-3. С. 549-553;URL: https://fundamental-research.ru/ru/article/view?id=34482 (дата обращения: 28.12.2025).



