Изыскание новых биологически активных соединений среди продуктов органического синтеза в настоящее время является актуальной задачей фармацевтической химии. Весьма перспективным направлением является поиск новых биологически активных веществ (БАВ) в ряду амидов 2-замещенных хинолин-4-карбоновой (цинхониновой) кислоты. Изопропил-амид 2-хлорцинхониновой кислоты при биологических испытаниях на животных в дозе 25 мг/кг показал противовоспалительную и анальгетическую активность [3], а синтезированные на его основе изопропиламиды 2-ариламино- и 2-арилоксицинхониновых кислот также обладают данными видами активности [3, 4]. Противомикробная активность выявлена у изопропиламида 2-(2,4-динитрофенилгидразино)цинхониновой кислоты [5]. Приведенные данные литературы свидетельствуют о том, что среди производных хинолин-4-карбоновой кислоты имеются биологически активные вещества. В то же время малоизученными являются амиды 2-гетариламинохинолин-4-карбоновой кислоты.
Целью исследования является разработка методик синтеза новых потенциально биологически активных соединений в ряду производных хинолин-4-карбоновой кислоты на основе изопропиламида 2-хлорхинолин-4-карбоновой кислоты в реакции с гетериламинами, изучение их физико-химических свойств и биологической активности. Провести анализ результатов биологических испытаний полученных соединений с активностью ранее полученных их структурных аналогов, а также и препаратами-эталонами. Выявить взаимосвязь структура-активность в ряду 2-замещенных амидов хинолин-4-карбоновой кислоты.
Материалы и методы исследования
Структура полученных соединений подтверждена спектральными методами анализа. ЯМР 1Н-спектры записаны на спектрометре ЯМР MERCURY-300 фирмы Varian, (300 МГц), в ДМСО-d6, внутренний стандарт – ГМДС. Ход реакций и чистоту соединений контролировали методом ТСХ на пластинах Silufol UV-254 в системе углерод четыреххлористый:ацетон (3:1), пятна детектировали парами йода. Данные элементного анализа синтезированных веществ соответствуют вычисленным значениям. В качестве препаратов-эталонов использованы: диклофенак натрия (Россия) и ацетилсалициловая кислота (Байер, Германия).
Результаты исследования
и их обсуждение
В ходе опытов было установлено, что при кипячении эквимолекулярных количеств изопропиламида 2-хлор-
хинолин-4-карбоновой кислоты и гетериламина в ДМФА с выходами 74-83 % образуются соответствующие изопропиламиды 2-гетариламинохинолин-4-карбоновой кислоты (1–10) по схеме
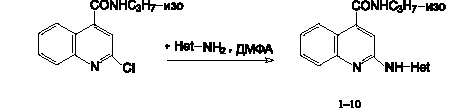
Где Het = 1,3,4-тиадиазолил-2 (1); 1,2,4-триазолил-1 (2) 1,2,4-триазолил-3 (3); 2,6-дихлор-пиримидил-4 (4); 2,4-диоксорпиримидил-6 (5); пиридил-4 (6); 2-гидрокси-3-карбокси-пиридил-5 (7); 5-метилпиридил-2 (8); антипирил-4 (9); 3-этоксикарбонил-4,5,6,7-тетрагидро-1-бензо[b]тиофенил-2 (10).
Полученные соединения (1–10) – белые кристаллические вещества нерастворимые в воде и растворимые при нагревании в органических растворителях: диоксане, ДМФА. Характеристики синтезированных соединений приведены
в табл. 1.
Таблица 1
Характеристики изопропиламидов 2-гетариламинохинолин-4-карбоновой кислоты (1-10)
|
Соединение |
Het |
Брутто-формула |
Т.пл., °С |
Выход, % |
Rf* |
|
1. |
1,3,4-тиадиазолил-2 |
C15H15N5OS |
235–236 |
77 |
0,44 |
|
2. |
1,2,4-триазолил-1 |
С15Н16N6O |
251–252 |
82 |
0,47 |
|
3. |
1,2,4-триазолил-3 |
С15Н16N6O2 |
260–263 |
76 |
0,50 |
|
4. |
2,6-дихлорпиримидил-4 |
С17Н15CI2N5O |
305–306 |
75 |
0,42 |
|
5. |
2,4-диоксопиримидил-6 |
C17H17N5O3 |
303–307 |
80 |
0,37 |
|
6. |
пиридил-4 |
C18H18N4O |
293–295 |
74 |
0,36 |
|
7. |
2-гидрокси-3-карбокси-пиридил-5 |
С19Н18N4O4 |
293–295 |
77 |
0,49 |
|
8. |
5-метилпиридил-2 |
C19H20N4O |
250–252 |
79 |
0,45 |
|
9. |
антипирил-4 |
С24Н25N5O2 |
273–275 |
83 |
0,41 |
|
10. |
3-этоксикарбонил-4,5,6,7-тетрагидро-1-бензо[b]тио-фенил-2 |
С24Н27N3O3S |
257–258 |
80 |
0,40 |
Примечание. *в системе углерод четыреххлористый:ацетон (3:1).
Общая методика получения изопропиламидов 2-гетариламинохинолин-4-карбоновых кислот (1–10). Смесь 2,49 г (0,01 моль) изопропиламида 2-хлорхинолин-4-карбоновой кислоты и 0,01 моль соответствующего гетериламина в 10 мл ДМФА кипятят в течение 5 часов, охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из диоксана. Структура полученных соединений 1–10 подтверждена данными ЯМР 1Н- спектров (табл. 2).
Таблица 2
Данные ЯМР 1H-спектров соединений (1-10)
|
Соединение |
Het |
Спектр ЯМР 1H: (ДМСО-d6), δ, м.д.: |
||||
|
6H, 2CH3, д |
1Н, –СН <, м |
HetH, ArH, м |
1H, NH амид, д |
1H, NH, с |
||
|
1. |
1,3,4-тиадиазолил-2 |
1,29 |
4,16 |
7,08–7,94 (6Н) |
8,52 |
8,59 |
|
2. |
1,2,4-триазолил-1 |
1,24 |
4,17 |
7,61–8,69 (7H) |
8,72 |
10,05 |
|
3. |
1,2,4-триазолил-3 |
1,24 |
4,30 |
7,03–8,54 (7H) |
8,69 |
8,76 |
|
4. |
2,6-дихлорпиримидил-4 |
1,23 |
4,13 |
7,09–7,79 (6H) |
8,64 |
11,80 |
|
5. |
2,4-диоксорпиримидил-6 |
1,25 |
4,16 |
7,06–7,77 (6H) |
8,38 |
9,02 |
|
6. |
пиридил-4 |
1,30 |
4,28 |
7,02–8,25 (9H) |
9,02 |
9,10 |
|
7. |
2-гидрокси-3-карбокси-пиридил-5 |
1,22 |
4,15 |
6,37–8,54 (7H) |
8,44 |
9,42 |
|
8. |
5-метилпиридил-2 |
1,24 |
4,15 |
7,42–8,07 (8H) |
8,52 |
9,20 |
|
9. |
антипирил-4 |
1,25 |
4,15 |
7,22–8,03 (10H) |
8,77 |
8,84 |
|
10. |
3-этоксикарбонил-4,5,6,7-тетрагидро-1-бензо[b]тио-фенил-2 |
1,23 |
4,33 |
7,40–8,57 (13H) |
8,60 |
11,19 |
В спектрах ЯМР 1Н соединений 1–10 (табл. 2) имеются характерные сигналы протонов δ, м.д.: 8,59–11,19 (1 H, NH, с); 8,38–9,02 (1 H, NH амид, д), группа линий ароматических и гетероциклических протонов в области 6,37–8,69; 4,13–4,33 (1Н, –СН < , м); 1,23–1,29 (6H, 2 CH3, д).
Биологические исследования
Испытания синтезированных соединений проведены согласно методическим указаниям «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» в сравнении с препаратами эталонами [6]. Результаты обработаны статистически с использованием критерия Стьюдента, эффект считали достоверным при р ≤ 0,05 [1].
Острая токсичность соединений (1, 2, 5) изучена на белых мышах массой 18–22 г при однократном внутрибрюшинном введении с учетом гибели животных в течение 24 ч. Установлено, что ЛД50 соединений 1, 2, 4–6 более 2150 мг/кг (табл. 3), и они относятся к малотоксичным веществам. Из данных литературы известно, что ЛД50 при этом же пути введения ортофена равна 132, аспирина – 495 [2].
Противовоспалительная активность (ПВА) соединений (1–6,8,9) изучена на белых крысах обоего пола массой 180–220 г на каррагениновой модели воспаления, создаваемой субплантарным введением в заднюю лапу крыс 0,1 мл 1 % водного раствора каррагенина. Исследуемое вещество вводили внутрибрюшинно в дозе 25 мг/кг
в 2 % крахмальной слизи, диклофенак натрия в дозе 25 мг/кг и аспирин в дозе
50 мг/кг в водной суспензии с твином 80 за один час до моделирования воспаления. Прирост объёма воспалённой стопы оценивали онкометрически через 3 и 5 часов после введения флогогенного агента и вычисляли процент торможения отёка к контролю. Проведено 8 опытов, в каждой группе было по 6 животных. Полученные результаты сравнивали с литературными данными по противовоспалительному действию диклофенака натрия в дозе 25 мг/кг (табл. 3) и аспирина в дозе 50 мг/кг на каррагениновой модели воспаления [3].
Исследования показали, что апробированные соединения при внутрибрюшинном пути введения в дозе 25 мг/кг после введения флогогенного агента тормозят развитие отека через 3 ч в пределах 29,85–42,54 и 5 ч – 38,32–62,42 %. Противовоспалительный эффект изученных соединений сохраняется и даже усиливается в опытах через 5 часов. Наиболее активным является 2-замещенные изопропиламиды хинолин-4-карбоновой кислоты (соединения 1, 2, 5), которые уступают по ПВА активности диклофенаку натрия в этой же дозе через 3 и 5 часов наблюдения, но являются менее токсичными, чем препарат-эталон сравнения. По противовоспалительному действию все соединения в дозе 25 мг/кг являются более активными, чем аспирин в дозе 50 мг/кг (табл. 3).
Таблица 3
Острая токсичность, противовоспалительная активность изопропиламидов 2-гетариламинохинолин-4-карбоновых кислот (1–6,8,9) и препаратов эталонов
|
Соединение /препарат-эталон |
ЛД50, мг/кг |
Противовоспалительная активность, % торможения отека к контролю после введения каррагенина через |
||
|
Доза, мг/кг |
3 ч |
5 ч |
||
|
1. |
> 2150 |
25 |
38,78* |
51,36* |
|
2. |
> 2150 |
25 |
37,50* |
50,15* |
|
3. |
. . . |
25 |
32,35* |
47,82* |
|
4. |
. . . |
25 |
33,35* |
38,32** |
|
5. |
> 2150 |
25 |
34,25* |
62,42* |
|
6. |
. . . |
25 |
42,54* |
47,05* |
|
8. |
. . . |
25 |
37,25** |
42,60* |
|
9. |
. . . |
25 |
29,85* |
41,43* |
|
Диклофенак натрия (ортофен) |
132 |
25 |
69,40** |
72,20** |
|
Ацетилсалициловая кислота (аспирин) |
495 |
50 |
51,20** |
28,70** |
|
Контроль |
. . . |
. . . |
70,88 ± 0,16 |
87,07 ± 1,04 |
Примечания: * – р < 0,05; ** – p < 0,01 по сравнению с контролем.
Цитотоксичность синтезированных соединений (2-4,6) была определена по МТТ-тесту [7]. В работе использованы культуры клеток человека RD (рабдомиосаркома), которые выращены в среде DMEM с добавлением 10 % эмбриональной телячьей сыворотки, 0,3 % L-глутамина и 1 % гентамицина в качестве антибиотика при 37 °C и 5 % CO2 во влажной атмосфере. Клетки культуры были рассеяны в 96 луночные микропланшеты. Исследуемые вещества растворены в ДМСО, конечная концентрация которого в лунке не превышала 0,1 % и не была токсична для клеток. После 24 часов инкубации к культурам клеток были добавлены различные концентрации тестируемых соединений (от 100 до 1,56 мкМ/л) и далее клетки культивированы в тех же условиях 72 часа. В качестве количественного критерия цитотоксичности тестируемых соединений использован индекс IC50 (мкМ/л), соответствующий концентрации тестируемого соединения, которая вызывает гибель 50 % клеток в сравнении с контролем. Эксперименты проведены в трех повторностях. В качестве препарата сравнения использован камптотецин. Результаты опытов приведены в (табл. 4).
Таблица 4
Цитотоксичность изопропиламидов 2-гетериламинохинолин-4-карбоновых кислот
|
Соединение |
Het |
IC50 (мкМ/л) RD |
|
2. |
1,2,4-триазолил-1 |
- |
|
3. |
1,2,4-триазолил-3 |
- |
|
4. |
2,6-дихлорпиримидил-4 |
206, 68 ± 29,73 |
|
6. |
пиридил-4 |
201,02 ± 34,07 |
|
Камптотецин |
0,88 ± 0,02 |
Примечание. «–» нет эффекта по отношению к контролю.
Из приведенных данных таблицы следует, что апробированные соединения 4, 6 проявили слабую цитотоксическую активность.
Выводы
1. В ходе проведенного исследования установлено, что при нагревании изопропиламида 2-хлорхинолин-4-карбоновой кислоты с гетериламинами с хорошими выходами образуются соответствующие изопропиламиды 2-гетариламинонохинолин-4-карбоновой кислоты.
2. Индивидуальность полученных соединений установлена с помощью ТСХ, а химическая структура – данных ЯМР 1Н-спектров.
3. Фармакологические исследования показали, что апробированные соединения в дозе 25 мг/кг при внутрибрюшинном введении обладают противовоспалительной активностью, которая практически не зависит от химической природы остатка гетериламина при С2 атоме хинолина.
4. Поиск новых биологически активных соединений в рядах амидов 2-замещенных хинолин-4-карбоновых кислот является перспективным.
Рецензенты:Хомов Ю.А., д.фарм.н., профессор кафедры фармацевтической химии ФДПО и ФЗО, ГБОУ ВПО ПГФА Министерства здравоохранения России, г. Пермь;
Михайловский А.Г., д.фарм.н., профессор кафедры общей и органической химии, ГБОУ ВПО ПГФА Министерства здравоохранения Россия, г. Пермь.



