Ранее в нашей лаборатории был сконструирован биосенсор для обнаружения генотоксического воздействия (повреждение ДНК или ферментативного аппарата обслуживающего геном клетки) различных веществ на клетку. Известно, что при повреждениях ДНК в клетке и, в частности,
в E.coli, запускается SOS-система репарации ДНК, впервые описанная в 1975 г. М. Радманом [8]. При запуске SOS-системы активируется промотор recA-гена, отвечающего за синтез соответствующего RecA-белка, который играет ключевую роль в нескольких путях репарации повреждений ДНК [7]. Ранее нами была сконструирована плазмидная ДНК (pRAC), содержащая ген зеленого флюоресцирующего белка под регуляторной областью промотора recA-гена Proteus mirabilis. Плазмидная ДНК была встроена в клетки кишечной палочки. Таким образом, биосенсор был основан на клетках E.coli штамм BL21(DE3) и при нарушении генетического аппарата клетки биосенсора продуцировали зеленый флюоресцирующий белок (GFP), который легко регистрировался флуориметром непосредственно в культуре клеток [6]. В качестве генотоксикантов нами были проверены формальдегид, митомицин С, налидиксовая кислота, перекись водорода и ультрафиолетовое облучение (УФО с длинной волны ~254 нм). Эксперименты показали, что клетка отвечает синтезом GFP на все исследованные мутагены и в основном дозозависимым
образом [2, 5].
Помимо промотора recA-гена в литературе описаны конструкции другими промоторами генов SOS-репаративного ответа [9]. Однако все эти конструкции использовались для непосредственного определения генотоксикантов (прямой анализ), и нет работ, где с помощью этих конструкций определялись бы эффекты, направленные на подавление или устранение эффекта генотоксиканта (своего рода «обратный» анализ). Поскольку УФО ведет к образованию свободных радикалов в клетке, мы предположили возможность использования данной модели для обнаружения защитных эффектов различных веществ, обладающих антирадикальной активностью. При добавлении таких веществ к клеткам
биосенсора в условиях стресса – под действием УФО, уровень флуоресценции клеток должен снижаться. Целью настоящего исследования явилось изучение возможности использования биосенсора – клеток E.coli шт.BL21(DE3), содержащих плазмиду pRAC, для обнаружения антирадикальной активности различных веществ.
Материалы и методы исследования
В качестве биосенсора использовались клетки E.coli штамм BL21(DE3), содержащие плазмиду pRAC и обладающие устойчивостью к ампициллину. В качестве веществ, обладающих антирадикальной активностью исследовались аскорбиновая кислота (5 % раствор, ЗАО «Новосибхимфарм», г. Новосибирск, Россия), метилэтилпиридинол (торговое название «Эмоксипин», 1 % раствор, ФГУП «Московский эндокринный завод», г. Москва, Россия), бис-[(3,5-ди-трет-бутил-4-гидроксифенил)пропил]сульфид («Тиофан») и 4-додецил-тиометил-2,6-диметилфенол («Тиофан-М») (кафедра химии, Институт естественных и социально-экономических наук, г. Новосибирск, Россия), структурные формулы веществ представлены на рис. 1.
Рис. 1. Структурные формулы исследованных веществ
Клетки выращивали на среде Луриа‒Бертани, содержащей ампициллин 100 мкг/мл, в колбе на ротационном шейкере при 37 °C. Культуру клеток в логарифмической фазе роста (1,0–1,5 о.е., D600) разливали в культуральные полистироловые планшеты (по 1 мл в лунку) и добавляли в различных концентрациях исследуемые вещества. Клетки инкубировали на ротационном шейкере (180 об/мин) в течение 20–30 мин при комнатной температуре, после чего планшеты инкубировали при аналогичных условиях под УФО в течение необходимого периода. В качестве источника УФО использовалась лампа ртутная бактерицидная ДБ-60 (λ ~ 254 нм, мощность 60 Вт), расстояние от лампы до планшетов составляло 50 см. По окончании инкубации проводился замер оптической плотности (ОП) культуры клеток (спектрофотометр «Evoluion 300 V-VIS», США) и флуоресценции (флуориметр «Shimadzu RF-530» (РС), Япония). Измерения проводили непосредственно в культуре клеток, без их разрушения. Волна возбуждения зеленого флюоресцирующего белка 480 нм, эмиссии – 515 нм.
Для сравнения результатов исследуемых культур флуоресценцию нормировали на оптическую плотность культуры клеток и вычисляли фактор индукции (ФИ) по методу, описанному в работе Лавриненко [2]. Каждый образец повторяли три раза. Обработку полученных результатов проводили с применением методов вариационной статистики. В сравниваемых группах определяли средние величины (М), ошибку средних величин ( ± m). Математическую обработку выполняли с помощью программы «StatPlus 2009» (компания «StatSoft», USA). Аскорбиновая кислота и метилэтилпиридинол являются водорастворимыми веществами. Растворы «Тиофана» и «Тиофана-М» с высокой концентрацией веществ готовили в 100 % диметилсульфоксиде, до исследуемых концентраций вещества растворяли 96 % этанолом, поэтому контрольные клетки содержали аналогичный объем растворителя без исследуемых веществ.
Результаты исследования
и их обсуждение
На предварительном этапе работ было исследовано время экспозиции клеток биосенсора под УФО для выбора оптимальных условий инкубации. Клетки инкубировали в течение суток под УФО. Через определенный промежуток времени ряд лунок экранировался от УФО, контрольные лунки были экранированы с начала инкубации. По окончании инкубации производились соответствующие замеры, вычисления фактора индукции и построение кривых изменения ОП и ФИ от времени. Результаты эксперимента представлены на рис. 2.
Из графика видно, что ОП клеток уменьшается в результате угнетающего действия УФО, а флуоресценция увеличивается вследствие накопления в клетках GFP. Из результатов этого эксперимента следует, что в исследованные периоды максимальный ФИ приходится на четырехчасовой период инкубации, т.е. в этой точке флюоресценция облучаемых клеток в восемь раз больше, чем в контрольных. Мы посчитали эту разницу вполне достаточной для проявления антирадикальных защитных эффектов, поэтому в последующих экспериментах остановились на четырехчасовой инкубации клеток.
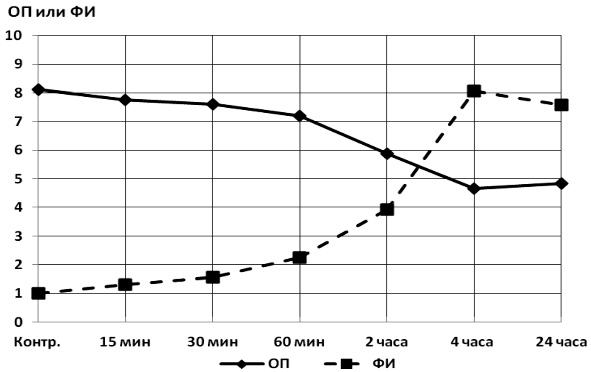
Рис. 2. Кривые изменения ОП культуры клеток и ФИ под действием УФО. По оси ординат отложены единицы ОП культур и ФИ, по оси абсцисс – время инкубации клеток. ФИ контрольных клеток принят за единицу
В качестве веществ, обладающих антирадикальными свойствами, нами были выбраны такие общепризнанные вещества, как аскорбиновая кислота и метилэтилпиридинол. И два синтетических фенольных антиоксиданта «Тиофан» и «Тиофан-М», обладающих двумя группами, обуславливающими их антиоксидантные и антирадикальные свойства. Антиоскидантные свойства проявляются в основном за счет содержания атома серы в структуре данных соединения [1]. Имеется работа по исследованию выживаемости клеток E.coli в условиях перекисного стресса [4], где показано, что добавление в культуральную среду производных соединений данных веществ приводило к увеличению выживаемости клеток. Антирадикальные свойства «Тиофана» и «Тиофана-М» обусловлены наличием в их структурах фенольной группировки, которая выступает «ловушкой» для радикалов, аналогично механизму, описанному для фенольного антиоксиданта 2,6-ди-трет-бутил-4-метил-фенола – «Ионол» [3]. Поэтому мы предположили, что и в наших экспериментах эти фенольные антиоксиданты должны проявить антирадикальную активность. Вещества исследовались в конечных концентрациях 0,1, 1, 10 и 100 мкг/мл. Результаты исследования представлены в таблице.
Флуоресценция клеток с исследуемыми веществами, выраженная в процентах относительно контрольных, ФИ контрольных клеток принят за 100 % (M ± m, n = 3)
|
Исследуемое вещество |
Концентрация исследуемого вещества |
|||
|
0,1 мкг/мл |
1 мкг/мл |
10 мкг/мл |
100 мкг/мл |
|
|
«Тиофан» |
99,2 ± 2,7 |
96,7 ± 4,9 |
93,2 ± 3,7* |
91,2 ± 1,8* |
|
«Тиофан-М» |
100,5 ± 2,1 |
100,8 ± 4,1 |
96,3 ± 4,8 |
90,1 ± 4,2* |
|
Метилэтилпиридинол |
98,3 ± 3,2 |
95,0 ± 5,8 |
88,7 ± 5,8* |
80,3 ± 2,9* |
|
Аскорбиновая кислота |
95,6 ± 4,5 |
85,1 ± 5,4* |
82,0 ± 4,1* |
86,2 ± 4,2* |
Примечание. * – достоверно (p < 0,05) по сравнению с контролем.
В результате этих исследований была выявлена закономерность, которая выражалась в статистически достоверном снижении флуоресценции культуры клеток при повышении концентрации исследуемого вещества. Чем выше была концентрация исследуемого вещества, тем меньше флуоресцировала культура клеток относительно контрольных. Таким образом, добавление к культурам клеток биосенсора
исследованных веществ в основном дозозависимым образом вело к снижению уровня флуоресценции культур, т.е. можно предполагать, что происходило снижение уровня повреждения ДНК клеток.
Результаты показывают, что максимальное снижение флуоресценции происходит почти на 20 % в случае метилэтилпиридинола и аскорбиновой кислоты, в случае «Тиофана» и «Тиофана-М» – почти на 10 %. Таким образом, добавление исследованных веществ к клеткам оказывало защитный эффект от УФО. Вероятно, это происходит в результате снижения концентрации свободных радикалов в клетке за счет добавленных в культуру исследованных веществ. Мы предполагаем, что данные цифры могут быть более наглядными, т.е. разница с контрольными клетками может быть большей при оптимизировании условий эксперимента. В частности, при изменении дозы УФО путем изменения времени инкубации клеток либо замены источника УФО.
Заключение
Данные результаты позволяют сделать вывод о пригодности исследуемого биосенсора для обнаружения антирадикальной активности веществ в условиях жесткого ультрафиолетового облучения клеток биосенсора. Биосенсор может быть пригоден для первичного скрининга и выявления антирадикальной активности различных, не токсичных для E.coli, веществ и может найти применение в фармакологии.
Рецензенты:
Усынин И.Ф., д.б.н., заведующий лабораторией «Молекулярная биология клетки», ФГБУ «НИИ биохимии» СО РАМН,
г. Новосибирск;
Потеряева О.Н., д.м.н., профессор кафедры медицинской химии, ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, г. Новосибирск.



