Проводимые нами исследования посвящены разработке методов синтеза пирролохинолинов (в том числе целенаправленных, с конкретным сочленением колец и с различными заместителями) из аминоиндолов весьма актуальны и перспективны. Ряд пирролохинолинов, полученных и исследованных авторами [1, 2, 3], в зависимости от строения и заместителей показали обезболивающую (сравнимую с анальгином), антимикробную, противогрибковую, витаминоподобную активность. Вместе с тем формирование соответствующей трициклической гетеросистемы на основе аминоиндолов и конкретного ß-дикарбонильного компонента требует изучения структурных, электронных особенностей исходных и промежуточных соединений, выявление роли этих факторов на протекание первичной конденсации и последующей циклизации.
Ранее показано, что использование в качестве исходных компонентов этилового эфира ацетоуксусной кислоты и 5-амино-6-метил-, 5-амино-1,6-диметил-2-фенилиндолов позволяет получать лишь соединения енаминного строения, дальнейшая циклизация которых приводит исключительно к образованию пирроло[3,2-f]хинолонов. Использование в аналогичных условиях полностью фторированного по метильной группе аналога β-кетоэфира может привести к синтезу как амидов, так и енаминов [4, 5].
В связи с этим интересно было изучить реакции конденсации и последующей циклизации выше названных аминоиндолов при использовании в качестве дикабонильной компоненты метилового эфира ацетоуксусной кислоты.
Цель исследования – изучение реакции 5-амино-6-метил-, 5-амино-1,6-диметил-2-фенилиндолов с метиловым эфиром ацетоуксусной кислоты и последующей гетероциклизации продуктов их взаимодействия с целью синтеза пирроло[3,2-f]хинолинов. Настоящее исследование имеет фундаментальную направленность.
Материалы и методы исследования
Спектры ЯМР 1Н записаны на мультиядерном спектрометре ядерного магнитного резонанса JoelJNM-ECX400 (400 МГц) в DMSO-d6. Расчетные спектры соединений выполнены с использованием программы ACD/LABSHNMRSpectrumGenerator: Chemsketch Windows. Электронные спектры сняты на приборе LEKISS2109UV в этаноле. Квантово-химические расчеты эффективных зарядов на атомах молекул систем I–IV проведены ограниченным методом Хартри‒Фока в параметризации полуэмпирического метода РМ3 и пакета прикладных программ GAMESS. Очистку продуктов реакции проводили методом колоночной хроматографии. В качестве сорбента использовали оксид алюминия (нейтральный, I и II ст. акт. по Брокману). Контроль за ходом реакции, чистотой полученных соединений, определение Rf осуществляли с помощью ТСХ на пластинках SilufolUV–254 в системах: бензол–этилацетат 15:1 (а), этилацетат–метанол 3:1 (б), этилацетат–метанол–аммиак 4:1:следы (в).
Аминоиндол 1, 2 получены по аналогичной методике, приведенной в работе [6].
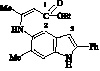
Метил (2Z)-3-[(6-метил-2-фенил-1Н-индол-5-ил)амино]бут-2-еноат (3) из 0,50 г (2,25 ммоль) 5-амино-6-метил-2-фенилиндола (1) и 0,26 г (2,30 ммоль) метилового эфира ацетоуксусной кислоты в 200 мл абсолютного бензола, в присутствии следов ледяной уксусной кислоты нагревают 15 часов с насадкой Дина‒Старка. По окончании реакции (контроль хроматографический) бензол отгоняют. Полученное соединение очищают пропусканием нагретого до кипения раствора в петролейном эфире с небольшим количеством бензола через слой (2 см) оксида алюминия. Перекристаллизовывают из петролейного эфира. Выход: 0,69 г. (97 %). Rf = 0,58 (а), т. пл. = 159–160 °С (бензол-петролейный эфир). Найдено, %: С 75,05; Н 5,58; C20H20N2О2; вычислено, %: С 74,98; Н 6,29.
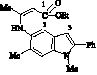
Метил (2Z)-3-[(1,6-диметил-2-фенил-1Н-индол-5-ил)амино]бут-2-еноат (4) получают и очищают аналогично из 0,80 г (3,34 ммоль) 5-амино-1,6-диметил-2-фенил-5-аминоиндола (2) и 0,40 г (3,34 ммоль) метилового эфира ацетоуксусной кислоты (15 ч). Выход: 0,85 г. (75 %). Rf = 0,68 (а), т. пл. = 151–152 °С (бензол-петролейный эфир). Найдено, %: С 75,40; Н 6,59; C21H22N2О2; вычислено, %: С 75,42; Н 6,63.
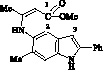
5,7-Диметил-2-фенил-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-9-он (5). 0,061 г (0,19 ммоль) енамина 3 нагревают в кипящем дифениле 20-25 мин. По окончании реакции (хроматографический контроль) еще теплую реакционную массу выливают в гексан. Выпавший осадок отфильтровывают и многократно промывают горячим гексаном от дифенила.Перекристаллизовывают из спирта. Выход: 0,035 г. (64 %). Rf = 0,53 (в), т. пл. > 276 °С (этанол). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д., J (Гц): 2,45 (3 Н, с, 7–СН3), 2,62 (3Н, с, 5–СН3), 6,01 (1Н, с, Н–8), 7,29 (1 Н, т, J = 8, р-H 2–Ph), 7,46 (2 Н, т, J = 8, m-H 2–Ph), 7,54 (1 Н, с, Н–1), 7,85 (2Н, д, J = 8, о-H 2–Ph), 7,91 (1 Н, с, Н–4), 10,20 (1 Н, с, H–6), 11,72 (1 Н, с, H–3). УФ спектр (спирт), λmax, нм (lg ε): 205 (4,50), 229 (4,43), 240 пл (4,28), 303 (4,21), 368 (4,30). Лит. данные [4]: т.пл. > 276 °С (этанол), спектр ЯМР 1Н (ДМСО-d6), δ, м.д., J (Гц): 2,45 (3 Н, с, 5–СН3), 2,62 (3 Н, с, 7–СН3), 6,00 (1 Н, с, Н–8), 7,29 (1 Н, т, J = 8 Гц, p-H 2–Ph), 7,46 (2 Н, т, J = 8 Гц, m-H 2–Ph), 7,54 (1 Н, с, Н–4), 7,84 (2 Н, д, J = 8 Гц, о-H 2–Ph), 7,92 (1 Н, с, Н–1), 10,10 (1 Н, с, H–6), 11,64 (1 Н, с, H–3). УФ-спектр (спирт), λmax, нм (lg ε): 208 (4,56), 230 (4,56), 244 пл (4,40), 256 пл (4,35), 308 (4,32), 370 (4,42).
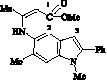
3,5,7-Триметил-2-фенил-6,9-дигидро-9Н-пирроло[3,2-f]хинолин-9-он (6) получают аналогично из 0,16 г (0,47 ммоль) енамина 4. Перекристаллизовывают из толуола. Выход: 0,11 г. (75 %). Rf = 0,60 (б), т. пл. > 276 °С (толуол). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д., J (Гц): 2,44 (3 Н, с, 5–СН3), 2,66 (3 Н, с, 7–СН3), 3,83 (3 Н, с, 3–CH3), 6,00 (1 Н, с, Н–8), 7.42-7,72 (7 Н, м, p-H 2-Ph, m-H 2-Ph, о-H 2-Ph, Н–1, Н–4), 10,24 (1 Н, с, H–6). УФ-спектр (спирт), λ max, нм (lg ε): 207 (4,53), 225 (4,47), 255 (4,31), 295 (4,20), 356 (4,26). Лит. данные [4]: т.пл. > 276 °С (толуол), спектр ЯМР 1Н (ДМСО-d6), δ, м.д., J (Гц): 2,44 (3 Н, с, 5–СН3), 2,66 (3 Н, с, 7–СН3), 3,83 (3 Н, с, 3–CH3), 6,00 (1 Н, с, Н–8), 7.43 (1 Н, т, J = 8 Гц, p- H 2–Ph), 7,52 (2 Н, т, J = 8 Гц, m-H 2–Ph), 7,60 (1 Н, с, H–4), 7,63 (2 Н, д, J = 8 Гц, о-Н 2–Ph), 7,72 (1 Н, с, Н–1), 10,15 (1 Н, с, H–6). УФ-спектр (спирт), λmax, нм (lg ε): 211 (4,37), 227 (4,30), 256 (4,13),
299 (4,01), 364 (4,06).
Спектральные характеристики соединений 3, 4 приведены в табл. 1.
Результаты исследования
и их обсуждение
При нагревании аминоиндолов 1, 2 с метиловым эфиром ацетоуксусной кислоты в абсолютном бензоле в присутствии каталитических количеств ледяной уксусной кислоты получены енамины метил (2Z)-3-[(6-метил-2-фенил-1Н-индол-5-ил)амино]бут-2-еноат (3) и метил (2Z)-3-[(1,6-диметил-2-фенил-1Н-индол-5-ил)амино]бут-2-еноат (4), при этом процесс конденсации протекает быстрее, чем в случае этилового эфира. Об этом свидетельствует меньший временной интервал протекания реакции.
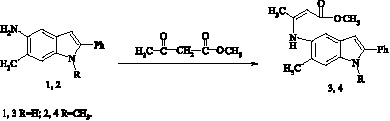
Таблица 1
Спектральные параметры соединений 3-6
|
Соединение |
Спектр ЯМР 1Н,δ, м.д., J, Гц |
Уфспектр |
|
|
λmax |
lg ε |
||
|
3 |
1,77 (3 Н, с, С = С–СН3), 2,28 (3 Н, с, 6–СН3), 3,58 (3 Н, с, ОСН3), 4,62 (1 Н, с, = СНвин), 6,84 (1 Н, с, Н–4), 7,29 (1 Н, с, Н–3), 7,31 (1 Н, т, J = 8, р-H, 2-Ph), 7,32 (1 Н, с, Н–7), 7,45 (2 Н, т, J = 8, m-H, 2–Ph), 7,83 |
205 225 пл 321 |
4,31 4,17 4,42 |
|
4 |
1,77 (3 Н, с, С = С–СН3), 2,32 (3 Н, с, 6–СН3), 3,58 (3 Н, с, ОСН3), 3,72 (3 Н, с, 1–СН3), 4,66 (1 Н, с, = СНвин), 6,51 (1 Н, с, Н–4), 7,36 (1 Н, с, Н–3), 7,42 (1 Н, с, Н–7), 7,51 (1 Н, т, J = 8, р-H, 2-Ph), 7,56 (2 Н, т, J = 8, m-H, |
205 227 303 |
4,33 4,38 4,50 |
Строение енамина 3 подтверждается наличием в спектре ЯМР 1Н сигналов протонов метоксильной группы (3,58 м. д.), = С–СН3 (1,77 м. д.), 6–СН3 (2,28 м. д.), = СНвин. (4,62 м. д.), ароматических водородов Н–4, Н–3, Н–7 (соответственно 6,84 м. д., 7,29 м. д., 7,32 м. д.), 2-Ph (два триплета и дублет), 5–NH (10,03 м. д.) и N–H пирр (11,48 м. д.). Аналогичная картина наблюдается и для енамина 4. Различие ‒ лишь в отсутствии сигнала протона Н–1 и в присутствии синглета протонов группы 1–СН3. Анализируя спектры ЯМР 1Н соединений 3, 4, мы пришли к выводу о существовании их в растворе ДМСО-d6 исключительно в Z-форме. Об этом свидетельствует слабопольный сдвиг сигналов = СНвин. по сравнению с возможной Е-формой. Полученные результаты строго согласуются с ранее рассмотренными в работе [4] параметрами отнесения енаминов к Z- и E-изомерам
и расчетным спектрам.
Сходство в строении енаминов 3, 4 подтверждается и УФ-спектрами. Соединения 3, 4 содержат полосы поглощения с максимумами при 205, 225 (плечо), 321 нм (для 3) и 205, 227, 303 нм (для 4), относящихся к n–π переходам в пиррольном и π–π переходам в бензольном кольцах соответственно. Приведенные данные по УФ-спектрам соединений 3, 4 согласуются с полученными ранее результатами для других подобных енаминокарбонильных соединений [4, 5].
Альтернативных продуктов взаимодействия по сложноэфирной группе метилового эфира ацетоуксусной кислоты, как и этилового аналога [4], в условиях данной реакции не обнаружено.
Далее мы изучили поведение енаминов 3, 4 в термических условиях. При этом нами установлено, что высокотемпературная обработка полученных соединений 3, 4 приводит к пирроло[3,2-f]хинолинам 5 (64 %), 6(75 %) с заданным сочленением колец.
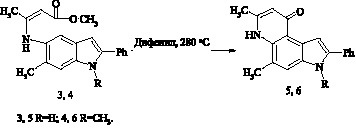
В спектре ЯМР 1Н соединения 5 имеются: сигналы метильных групп, синглеты Н–1, Н–3, Н–4, Н–6, Н–8, N-H, а также дублет и два триплета фенильных протонов. Угловое сочленение колец подтверждает слабопольный химический сдвиг Н–1 (7,54 м.д.), находящегося в пери-положении к γ-пиридоновому атому кислорода, что характерно для структур подобного типа [4, 5]. Аналогично енамину 3 подвергается циклизации и соединение 4 с образованием пирролохинолона 6 с угловым сочленением колец. УФ-спектры соединений 5, 6 практически идентичны, что подтверждает сходство их структур. Кроме того, ЯМР 1Н и УФ-спектры соединений 5, 6 идентичны таковым у пирролохинолинов, полученных из этил (2Z)-3-[(6-метил-2-фенил-1Н-индол-5-ил)амино]бут-2-еноата и этил (2Z)-3-[(1,6-диметил-2-фенил-1Н-индол-5-ил)амино]бут-2-еноата [4]. Величина химического сдвига Н–8, согласно литературным данным [7] и расчетным спектрам, свидетельствует о хинолоновой структуре соединений 5, 6, что подтверждает ранее предложенную авторами [4] интерпретацию данных структур.
В условиях термической циклизации с образованием пирролохинолинов енамины, полученные из метилового и этилового эфиров ацетоуксусной кислоты, ведут себя одинаково и по временному интервалу, и по выходам пирролохинолинов. Это объясняется квантово-химическими расчетами эффективных атомных зарядов на атомах 1, 2, 3, величины которых для структур I-IV практически одинаковы. Величины эффективных атомных зарядов приведены в табл. 2.
Таблица 2
Величины эффективных атомных зарядов в ат. ед. на атомах 1–3 для структур I–IV
|
№ п/п |
Структурная формула |
Номера атомов |
||
|
1 |
2 |
3 |
||
|
I |
|
0,307 |
‒0,047 |
‒0,188 |
|
II |
|
0,307 |
‒0,046 |
‒0,187 |
|
III |
|
0,304 |
‒0,047 |
‒0,188 |
|
IV |
|
0,303 |
‒0,046 |
‒0,187 |
Заключение
В ходе проведенного исследования изучены реакции конденсации 5-амино-6-метил-, 5-амино-1,6-диметил-2-фенилиндолов с метиловым эфиром ацетоуксусной кислоты и при этом обнаружено протекание реакции с участием только карбонильной группы, что позволило получить енамины, ранее не описанные в литературе. Следует отметить, что на основании спектральных характеристик полученные
енамины в растворителе ДМСО-d6 находятся исключительно в Z-состоянии. Замечено, что метильный заместитель у пиррольного атома азота, по-видимому, за счет положительного индуктивного влияния усиливает реакционную способность 5-аминоиндолов в реакциях конденсации. Проведение термического циклообразования продуктов конденсации 5-амино-6-метил-, 5-амино-1,6-диметил-2-фенилиндолов и того же эфира позволило найти альтернативный путь синтеза двух ранее известных пирролохинолонов: 4,7-диметил-2-фенил-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-9-она (5) и 3,4,7-триметил-2-фенил-6,9-дигидро-3Н-пирроло[3,2-f]хинолин-9-она (6), отличающийся от ранее разработанного получением промежуточного продукта за более короткие сроки и с большим выходом. С использованием современных физико-химических методов анализа и литературных данных доказано тонкое строение полученных соединений.
Танасейчук Б.С., д.х.н., профессор кафедры органической химии Мордовского государственного университета имени
Н.П. Огарева, г. Саранск;
Бузулуков В.И., д.т.н., к.х.н., профессор кафедры физической химии Мордовского государственного университета
имени Н.П. Огарева, г. Саранск.
Работа поступила в редакцию 31.01.2014.