Заторы – явление, характерное для большинства рек России. Быстрый и значительный подъем уровней, возникающий выше заторов, часто намного превосходит максимальные уровни весенних половодий и дождевых паводков и создает чрезвычайные ситуации на прибрежных территориях. Затор представляет собой скопление льда в русле, ограничивающее течение реки. В результате происходит подъем воды и ее разлив. Затор обычно образуется в конце зимы и в весенний период при вскрытии рек во время разрушения ледяного покрова, состоит из крупных и мелких льдин. Ликвидация заторов как мера предупреждения чрезвычайных ситуации стоит крайне остро, особенно для северных территорий.
Ранее мы сообщали о заторных явлениях на реках Иркутской области [1, 10]. В зону высокого риска возникновения ЧС во время весеннего половодья попадают 54 населенных пункта Иркутской области. Отметим, что на территории области имеется восемь традиционно опасных паводковых районов: Жигаловский, Качугский, Киренский, Усть-Кутский, Катангский, Тайшетский, Казачинско-Ленский и Чунский. Чаще всего для ликвидации заторов применяют методы подрыва льда. Однако подобная технология предупреждения заторов может закончиться трагедией. 6 мая 2013 г. в Катангский район вылетел вертолёт Ми-8 авикомпании «Ангара», на борту которого находились шестеро спасателей и трое членов экипажа с целью проверки паводковой ситуации в районе. Первый и последний раз Ми-8 вышел на связь на взлёте. На борту было около двух тонн взрывчатки. Ми-8 взорвался на высоте 120 метров. Ни от вертолёта, ни от людей практически ничего не осталось. Погибли временно исполняющий обязанности начальника ГУ МЧС России по Иркутской области полковник внутренней службы Станислав Омельянчик, заместитель руководителя Байкальского поисково-спасательного отряда Александр Степанов, а также специалисты Центра ГО ЧС и ПБ Иркутской области.
В настоящее время среди методов борьбы с заторами и зажорами на реках широкое применение стали находить химические и физико-химические методы. Суть
методов заключается в том, что для ускорения таяния льда его поверхность обрабатывают реагентами, внося их непосредственно или в пропилы. Нами предложено в качестве реагента, ускоряющего процесс таяния льда и предупреждения заторообразований в северных территориях Иркутской области, в Жигаловском районе, в частности, на реке Илга в районе н.п. Знаменка, вносить соляной рассол (рапу), добываемый на Знаменском месторождении промышленных вод. Знаменское месторождение промышленных вод находится на территории Жигаловского района Иркутской области, на правом берегу р. Илга. Оно было открыто в 1986 г. В геолого-структурном плане Знаменское месторождение находится на юго-восточном крыле центральной части Жигаловского вала, который, в свою очередь, приурочен к Иркутскому амфитеатру на юге Сибирской платформы. Добываемое гидроминеральное сырье (рассол) имеет суммарную минерализацию до 600 г/л, удельный вес – 1,42 кг/л, кислотность рН-4,6, давление пластовое – 460 атм., давление устьевое – 178 атм., температура рассола в пласте – 36–38 °С. Ниже приведены данные по содержанию основных компонентов сырья:
|
Таблица 1 Содержание компонентов, г/л |
|||||||||
|
Элементы |
Li |
Mg |
Ca |
Cl |
Br |
K |
Na |
Sr |
I |
|
В расчете на элемент |
0,42 |
29,2 |
120,9 |
325,3 |
9,3 |
4,3 |
2,4 |
0,62 |
0,09 |
|
В расчете на хлорид |
2,5 |
116,8 |
335,5 |
8,2 |
6,0 |
1,2 |
|||
Формула основного ионно-солевого состава воды скважины № 3А имеет следующий вид:
![]()
Согласно ГОСТ 13273 «Воды минеральные питьевые лечебные и лечебно-столовые», из биологически-активных компонентов (БАК) в воде скважины в концентрации, достигающей бальнеологически значимой нормы, выявлен бром в количестве 8000,0 мг/дм3 при кондиции для минеральных бромных вод 25,0 мг/дм3. Содержание ионов железа составляет 900,0 мг/дм3,
марганца 130,0 мг/дм3, лития 100,0 мг/дм3. По минерализации и основному ионно-солевому составу вода скважины является бромной крепко рассольной хлоридной магниево-кальциевой с кислой реакцией водной среды.
В условиях лабораторного моделирования и опытно-промышленных испытаний нами определены условия внесения рассолов в пропилы льда для разрушения льда, найдены оптимальные дозы реагента и разработан технический регламент реализации технологии. Однако ее внедрение не может быть осуществлено без предварительной оценки экологических последствий внесения рапы, так как после выполнения функций разрушения льда, раствор окажется в водоеме, и необходимо провести корректную оценку экологического благополучия после реализации технологии. В настоящее время для целей диагностики экологических последствий загрязнений широко используют методы биоиндикации и биотестирования, которые позволяют интегрально и оперативно дать токсикологическую характеристику используемым реагентам и технологиям [2, 3]. В основу методов контроля положен метод биотестирования. Суть метода заключается в определении действия испытуемых веществ на специально выбранные организмы и тест-реакции. Тест-реакцию (тест-функцию) определяют как закономерно возникающую ответную реакцию тест-системы на воздействие комплекса внешних факторов. Количественным выражением тест-реакции является тест-параметр. Критерием токсичности служит значение тест-параметра или правило, на основании которого делают вывод о токсичности исследуемой пробы. В качестве тест-объектов предложено использовать различные группы организмов, реакции и т.д. В настоящее время в России имеется около 30 аттестованных методик определения токсичности объектов экологического контроля, в Реестр методик для государственного контроля и мониторинга включено 12 методик по биотестированию в ранге ПНД Ф, в Федеральный реестр методик выполнения измерений – 11 методик в ранге ФР, в Федеральный реестр методик выполнения измерений, допущенных к применению при выполнении работ в области мониторинга загрязнения окружающей природной среды, – 5 методик в ранге РД (Р)52. В качестве тест-объектов в аттестованных методиках используется довольно узкий круг организмов: бактерии, ракообразные (дафнии, цериодафнии, артемия), водоросли (преимущественно хлорелла и сценедесмус), простейшие, хирономиды. При этом тест-культуры, предоставляемые разработчиками, фактически не стандартизованы и гарантировать точность исследований весьма затруднительно.
Среди методов биотестирования в последнее время достаточно широко используется метод фитотестирования. Его используют не только как способ токсикологической оценки сред, например, почв и вод, но и как весьма распространенный прием оценки токсичности или биоактивности различных материалов, химикатов, промышленных отходов. Интересно заметить, что фитотесты стали довольно широко использоваться для оценки биобезопасности наноматериалов [4]. Фитотестирование давно используется как метод оценки почв для биомедицинских исследований и относительно недавно применяется для оценки экологического качества природных сред (вод, почвы), при разработке новых технологий. Однако на данный момент в реестре природоохранных нормативных документов (ПНДФ) нет метрологически аттестованных (стандартизированных) методик фитотестирования, рекомендованных для целей государственного и производственного экологического контроля.
Тем не менее автор настоящей работой в течение 30 лет активно использует в практике эколого-токсикологической экспертизы методы фитотестирования, основанные на физиолого-биохимических реакциях водного растения – элодеи канадской. Накоплен огромный опыт, позволяющий судить об экологических последствиях предлагаемых технологий и поллютантов. Нами предложено для оценки токсичности сточных вод и их компонентов использовать метод биотестирования по ростовым реакциям элодеи канадской (биологический) и метод энзимоиндикации (химический) по активности оксидоредуктаз [5, 6, 9]. Именно благодаря оксидоредуктазам протекают процессы самоочищения в водоемах. Оксидоредуктазы являются основными ферментами, катализирующими окислительные превращения ксенобиотиков в растительных организмах. Они являются стрессовыми белками, синтезируемые растениями в ответ на химическое воздействие, своего рода защитной реакцией на загрязнение. Это касается в первую очередь пероксидазы, катализирующей окисление органических веществ, при участии перекиси водорода и имеющей субстратную специфичность. Полифенолоксидаза – медьсодержащий фермент, а пероксидаза и каталаза ‒ железосодержащие ферменты, потому возможны их инактивация под действием веществ, обладающих свойствами комплексообразователей.
Выбор элодеи канадской как биотеста обусловлен ее уникальной пластичностью. Она способна размножаться с огромными скоростями, запасы растительной элодеи достигают в озерах 201,3 т (воздушно-сухой вес), в среднем в зарослях урожайность элодеи составляет 40–90 т с 1 га водной поверхности. В водоемах происходит постоянно воспроизведение элодеи, она может перезимовать, вмерзнув в лёд и, таким образом, легко переносить суровые зимы Крайнего севера. Она обладает высокой конкурентоспособностью, вытесняя другие растения.
Фитотестирование с использованием семян нашло широкое применение в методике обоснования класса опасности отходов [7]. В частности, согласно МР 2.1.7.2297-07 «Обоснование класса опасности отходов…», в лабораторных фитотестах рекомендуется применять семена овса («Avenaspp»). На кафедре агрохимии МГУ предложен метод определения суммарной токсичности почвы с использованием семян редиса (p.Raphanus). Международный стандарт ISO 11269-1 для биотестирования рекомендуют использовать семена ячменя обыкновенного (Hordeumvulgaris) сорта CVTrimph. Международный стандарт ISO11269-2 рекомендует выбирать минимум два вида растений, при этом одно должно быть однодольным, другое ‒ двудольным. Зарубежные исследователи [4] рекомендуют применять три вида тест-растений сорго сахарное (sorghumsaccharatum), кресс-салат (Hepidiumsativum) и горчица белая (Sinapeisalba). Исследованиями, выполненными в МГУ, обосновано применение именно семян редиса. В качестве тест-реакции в лабораторном фитотестировании используют всхожесть, энергию прорастания, дружность прорастания, длину корней. При этом под всхожестью понимают способность семян давать за установленный срок нормальные проростки при определенных условиях прорастания. Число пророщенных семян выражают в процентах от общего числа семян, взятых для анализа. В наших экспериментах оценивали всхожесть и длину корней в процентах от контроля.
Материалы и методы исследования
Исследование проводили в условиях лабораторного эксперимента. В стаканы вместительностью 0,5 л помещали по 10 отрезков верхушечных побегов элодеи канадской длиной 5 см и вносили в определенных концентрациях и разведениях исследуемый рассол. Стаканы экспонировали на свету определенное время, измеряли прирост в длину побегов элодеи и уровни оксидоредуктаз, согласно методикам, изложенным в работе [5]. Уровень активности
оксидоредуктаз определяли по специфическим реакциям: о-дифенолоксидазу по пирокатехину, пероксидазу по реакции с о-дианизидином, каталазу – с перекисью водорода. Активность выражали в соизмеримых единицах-микромолях субстрата, превращенного за 1 мин 1 мгбелка [6].
Фитотестирование на семенах редиса проводили в чашках Петри, раскладывая 100 семян на фильтровальной бумаге и добавляя по 5 мл исследуемого раствора. Чашки помещали в термостат, ежедневно просматривали и подсчитывали проросшие семена. Предварительно была проведена проверка семян на всхожесть.Чашки Петри с вложенными в них кусочками фильтровальной бумаги стерилизуются и охлаждаются. Для определения всхожести семян редиса отобраны четыре пробы по 100 семян в каждой. Фильтровальную бумагу в чашках Петри перед проращиванием увлажнили 5 мл дистилированной водой, заложили семена по 100 штук в каждую, закрытые чашки помещали в термостат для проращивания при температуре 20–30 °С [8].
Всхожесть семян отдельных проб оказалась равной 100–6 = 94, 100–4 = 96, 100–2 = 98, 100–5 = 95 (рис. 1), среднее арифметическое значение – 95,75 %, округленно составляет 96 %.
Рис. 1. Проверка партии семян на всхожесть




Кроме всхожести оценивали длину проростков и длину корешков (рис. 2).
Результаты исследования
и их обсуждение
Фитотестированием установлено, что ингибирование ростовых реакций элодеи канадской отмечается непосредственно в неразбавленном растворе рассола при экспозиции 5, 10 и 15 суток, при разбавлении 1:10 степень ингибирования достигает 50 % к контролю. При больших разведениях наблюдается интенсивный рост побегов элодеи по сравнению с контролем, что указывает на отсутствие токсического воздействия. Напротив, вероятно, растения усваивают компоненты рассола, выполняли при разных разведениях от 1:0 до 500 (рис. 3).
Уровни активности оксидоредуктаз снижаются незначительно, что указывает на высокую ассимиляционную способность элодеи канадской. Как видно из полученных данных, наибольшее снижение уровня активности отмечалось только на пероксидазе.
В результате фитотестирования на семенах редиса по тесту всхожесть семян достаточным является разбавление 1:50, а по длине проростов и длине корней 1:100 (рис. 4.1–4.3).
Таким образом, экспериментально с использованием фитотестирования доказано, что рассол Знаменского месторождения не оказывает остро токсичного действия на растительные организмы и достаточно разбавления 1:100, чтобы обеспечить его экологическую безопасность. В реальных условиях применения технологии разбавление будет гораздо больше и целесообразно применять технологию борьбы с заторными явлениями путем внесения рассола в пропилы льда на реках Илга, Лена. Затраты на технологию невысокие, так как Знаменское месторождение территориально близко расположено к местам возникновения заторов на данных реках.



Рис. 2. Оценка токсичности рассола по длине корешков
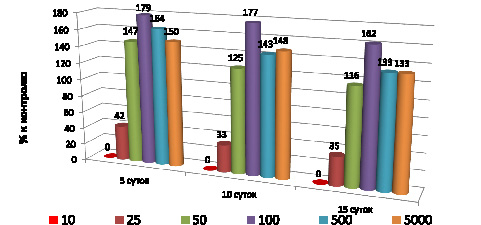
Рис. 3. Токсикологическая экспертиза рассола скважины
Знаменского месторождения промышленных вод при разных разведениях
по ростовым реакциям элодеи канадской Elodeaсanadensis
Таблица 2
Степень ингибирования активности оксидаз
при действии рассола Знаменского месторождения
|
Фермент |
Время |
Степень ингибирования % к контролю при разведениях 1:0 1:1 1:10 1:50 1:100 |
|
Каталаза |
1 |
26,6 25,4 17,7 11,4 8,9 |
|
2 |
31,3 29,4 23,5 12,5 5,6 |
|
|
3 |
32,5 26,6 21,5 12,9 4,7 |
|
|
4 |
35,6 21,6 9,6 10,5 2,5 |
|
|
5 |
25,3 19,5 16,5 9,4 0,9 |
|
|
Пероксидаза |
1 |
8,5 8,5 5,5 4,7 2,8 |
|
2 |
12,3 9,4 6,9 5,9 3,1 |
|
|
3 |
22,2 19,4 16,7 15,6 9,8 |
|
|
4 |
23,4 18,7 15,7 14,5 8,9 |
|
|
5 |
25,9 15,6 14,5 13,5 9,1 |
|
|
Полифенолоксидаза |
1 |
20,8 14,6 12,4 11,4 5,8 |
|
2 |
36,8 15,6 11,5 10,7 9,7 |
|
|
3 |
42,1 36,7 21,4 14,7 10,4 |
|
|
4 |
41,4 38,5 21,3 13,5 9,5 |
|
|
5 |
34,6 28,9 20,2 10,5 5,6 |



Рис. 4. Токсикологическая экспертиза рассола скважины Знаменского месторождения промышленных вод при разных разведениях на семенах редиса Raphanussativus
Рецензенты:
Медведева С.А., д.х.н., профессор, ФГБОУ ВПО «Национальный исследовательский Иркутский государственный технический университет», г. Иркутск;
Тальгамер Б.Л., д.т.н., профессор, директор института недропользования, ФГБОУ ВПО «Национальный исследовательский Иркутский государственный технический университет», г. Иркутск.
Работа поступила в редакцию 31.01.2014.



