Заболевания сердца по этиологическим причинам разделяются на две большие группы – коронарогенные (ИБС) и некоронарогенные (миокардит, ревматизм, инфекционный эндокардит и др.).
Известно, что основными механизмами повреждения кардиомиоцитов являются ишемия, некроз, воспаление, дистрофия. В литературных источниках обсуждается вопрос, что механизмы повреждения способны развиваться параллельно в миокарде.
Одним из лабораторных показателей иммуновоспалительного синдрома является циркуляция аутоантител к кардиомиоцитам. Лабораторные методики в настоящее время могут выделять неселективные аутоантитела (т.е. антитела к миокарду) и селективные аутоантитела (к актину, миозину, адренорецепторам и пр.).
Иммунные механизмы повреждения играют важную роль в развитии некоронарогенного поражения сердца. При ревмокардите выявляется корреляция между содержанием антител к поврежденной ткани сердца, степенью активности заболевания, характером его течения и выраженностью кардита [16]. В развитии инфекционного эндокардита также имеет место аутоиммунный механизм, что подтверждается выявлением у больных циркулирующих антикардиальных антител [5].
Роль антикардиальных антител неоднозначна. В ряде работ было показано, что циркуляция различных аутоантител к белкам кардиомиоцитов вызывает снижение систолической функции сердца или сопряжено с дилатацией его камер [7, 11, 13]. В последние годы появляется все больше работ, посвященных влиянию аутоантител к различным кардиальным антигенам (актину, миозину, тропонину I, β- и α-адренорецепторам, M2-мускариновым рецепторам) на проявления, особенности течения и степень тяжести хронической сердечной недостаточности независимо от ее этиологии [1, 2, 5, 6, 8, 9 12, 14, 15, 17, 18]. Однако окончательно эти вопросы не изучены.
Недостаточное количество данных об исследовании иммунного ответа при различной кардиальной патологии, а также о взаимосвязи аутоантител к белкам кардиомиоцитов со структурными и функциональными показателями сердечно-сосудистой системы, клиническими проявлениями хронической сердечной недостаточности и о возможности использования в диагностике данных лабораторных тестов послужило основанием для проведения этой работы.
Недостаточно изучена роль аутоиммунных реакций гуморального и клеточного типа в клиническом течении стабильной стенокардии, а также при ее переходе в нестабильное течение. Существуют различные точки зрения на иммунологические нарушения у больных с различными формами стенокардии [3].
Целью нашего исследования было выявление связей иммунологического воспалительного ответа у больных с коронарогенной и некоронарогенной патологией сердца с жалобами, клиническими проявлениями сердечной недостаточности и нарушениями ритма сердца.
Материалы и методы исследования
В состав первой группы было включено 52 больных хроническим миокардитом, из них 29 женщин и 23 мужчины, возраст обследованных от 26 до 61 года, средний – 43 года. Диагноз миокардита у пациентов данной группы устанавливался в два этапа. На первом этапе – в соответствии с диагностическими критериями миокардитов NYHA (1973 г.), которые включают в себя «большие» и «малые» диагностические критерии неревматических миокардитов. Вторым этапом было установление окончательного диагноза. Наличие текущего миокардита обязательно подтверждалось после проведения дополнительного обследования при обнаружении: накопления аутолейкоцитов, предварительно меченных 99Тс-гексаметилпропиленаминооксимом (ГМПАО) в миокарде, что является характерным признаком воспалительной инфильтрации; при изменении магнитно-резонансного сигнала в миокарде после его контрастирования препаратом «Магневист», что означает наличие в мышце сердца воспалительного отека [3].
Критериями невключения были острый и подострый миокардит, системные заболевания соединительной ткани, крупноочаговый постинфарктный кардиосклероз, любая эндокринная патология, прием больными любых противовоспалительных препаратов.
В состав второй группы было включено 25 больных с острым коронарным синдромом (нестабильной стенокардии или острым инфарктом миокарда без подъема сегмента ST), из них 5 женщин и 20 мужчин, возраст обследованных от 44 до 64 лет, средний – 53 года.
Диагноз острого коронарного синдрома ставился на основании типичной для стенокардии клинической картины болевого синдрома, анамнеза, ЭКГ-динамики и данных исследования кардиоспецифичных ферментов. В группу включались пациенты, направленные скорой помощью с диагнозом ОКС с типичным ангинозным болевым синдромом, купируемым в течение не более 24 часов.
Из исследования исключались лица, у которых на ЭКГ отмечался подъем сегмента S-T или формировался патологический зубец Q, по данным лабораторных исследований отмечался положительный Т-тропонин или повышение КФК-МВ более 2 значений превышения от нормы. В дальнейшем через 24 часа был выставлен диагноз нестабильной стенокардии или non-Q инфаркт без подъема сегмента ST. В дальнейшем использовали регистрацию ЭКГ в динамике, холтеровское 24-часовое ЭКГ-мониторирование, нагрузочные тесты (тредмил-тест или велоэргометрия) и выявление дефектов перфузии миокарда при перфузионной однофотонной эмиссионной компьютерной томографии миокарда с технетрилом. После включения в исследования антиангинальная терапия стандартизировалась и включала: 57,9 % больных группы ИБС получили блокаторы ренин-ангиотензиновой системы, 22,4 % – антагонисты рецепторов ангиотензина II, 71,3 % – статины, 98,2 % – гепарин, 67,2 % – аспирин, 46,7 % – пролонгированные нитраты, 17,3 % – диуретики, 61,4 % – β-адреноблокаторы, 12,2 % – антагонисты кальциевых каналов недигидропиридинового ряда.
Каждому пациенту, включенному в исследование, проводилось обследование, включающее: сбор жалоб и анамнеза, физикальное обследование, изучение иммунологических показателей (иммуноглобулинов классов A и G к кардиомиозину); для выявления специфических иммуноглобулинов классов A и G к кардиомиозину нами использовался иммуноферментный анализ в модификации ELISA (выполнялся на базе научно-производственной лаборатории «Хеликс», г.С-Петербург); оценка воспалительного синдрома (общеклиническое и биохимическое исследования крови, при которых учитывались уровень лейкоцитоза, скорость оседания эритроцитов, концентрация фибриногена, С-реактивного белка и сиаловых кислот); стандартная электрокардиография; суточное мониторирование ЭКГ по Холтеру проводили на комплекте мониторов одно-, двух-, трехсуточного мониторирования ЭКГ, АД, «Союз-ДМС» (Россия); эхокардиографическое исследование в сочетании со сканированием в М-режиме проводилось на аппарате «Vivid 7» (США).
Результаты исследования и их обсуждение
1. Результаты обследования больных хроническим миокардитом.
Анализ распределений количественных показателей выявил, что показатель АТМ имеет только одну слабую связь с дискретным показателем «наличие жалоб на одышку»: при отсутствии жалоб (n = 33) среднее геометрическое значение АТМ равно 8,5 с 68 % доверительным интервалом, ДИ (3,1; 23,5), при наличии (n = 19) – 3,9 с 68 % ДИ (1,5; 9,9).
Показатель Ig А к кардиомиозину не имеет статистически значимых связей с качественными показателями. Результаты р-значения для критерия Фишера однофакторного дисперсионного анализа, с помощью которого были оценены величины ассоциации показателей иммунного воспаления со значимыми дискретными клиническими показателями, приведены ниже, в табл. 1.
Таблица 1
Результаты однофакторного дисперсионного анализа показателей иммунного воспаления с клиническими жалобами
|
Показатель |
ATM |
IgG |
IgA |
|
Одышка |
0,01 |
0,53 |
0,10 |
|
Слабость |
0,47 |
0,02 |
0,33 |
|
Потливость |
0,29 |
0,005 |
0,63 |
|
ФК ХСН |
0,35 |
0,01 |
0,25 |
Показатель IgG к кардиомиозину имеет три значимые связи:
– с показателем «наличие жалоб на слабость»: при отсутствии жалоб (n = 38) среднее геометрическое значение IgG к кардиомиозину равно 0,20 с 68 % доверительным интервалом, ДИ (0,12; 0,33), при наличии (n = 14) – 0,47 с 68 % ДИ (0,20; 1,15);
– с показателем «наличие жалоб на потливость»: при отсутствии жалоб (n = 22) среднее геометрическое значение IgG к кардиомиозину равно 0,16 с 68 % доверительным интервалом, ДИ (0,10; 0,26), при наличии (n = 30) – 0,25 с 68 % ДИ (0,15; 0,41).
– с показателем «функциональный класс сердечной недостаточности» (ФК ХСН): для ФК = 1 (n = 40) среднее геометрическое значение IgG к кардиомиозину равно 0,19 с 68 % доверительным интервалом, ДИ (0,13; 0,30), для ФК = 2 (n = 10) – 0,30 с 68 % ДИ (0,15; 0,57), для ФК = 3 (n = 2) – 0,33 с 68 % ДИ (0,17; 0,42).
При изучении взаимосвязи уровня иммуноглобулинов A и G к кардиомиозину с показателями, отражающими морфофункциональное состояние сердца с помощью дисперсионного анализа, выявлена достоверная связь с параметрами, характеризующими структурные изменения сердца (гипертрофию, дилатацию), нарушения его функции (сократимости, ритма и проводимости) у больных миокардитом. Диагностическая ценность иммуноглобулинов A и G в группах была различной. Значимой связи общих антител к миокарду с данными показателями не обнаружено.
При корреляционном анализе у исследуемых больных также выявлена значимая положительная связь (р < 0,05) концентрации IgG к кардиомиозину с показателями, отражающими морфофункциональное состояние сердца и клиническими проявлениями ХСН – с массой миокарда левого желудочка (r = 0,33), индексом массы миокарда (r = 0,27), с наличием полной блокады ЛНПГ на ЭКГ (r = 0,51), с наличием отеков (r = 0,28), с расширением перкуторных границ сердца (r = 0,27), с индексом ШОКС (r = 0,48), функциональным классом ХСН (NYHA) (r = 0,56), и значимая отрицательная связь с результатом теста 6-минутной ходьбы (r = –0,52) и с фракцией выброса левого желудочка (r = –0,37), результаты корреляционных взаимодействий представлены на рис. 1–3.
При корреляционном анализе также выявлена значимая связь (р < 0,05) концентрации Ig А к кардиомиозину с показателями, отражающими морфофункциональное состояние сердца – с систолическим размером ЛЖ (r = 0,28), с индексом массы миокарда левого желудочка (r = 0,29), диастолическим размером левого предсердия (r = 0,29) и отрицательную связь с продолжительностью интервала PQ на ЭКГ (r = –0,28), с результатом теста 6-минутной ходьбы (r = –0,31).
2. Результаты обследования больных ишемической болезнью сердца.
Следующей исследуемой группой были больные ИБС, которые состояли из пациентов с острым коронарным синдромом без подъема сегмента SТ с последующей стабилизацией на уровне стенокардии напряжения разных функциональных классов. Для сопоставления эффекта лечения в подгруппах пациентов были проведены их повторные измерения после проведенной стандартизированной терапии, указанной в материалах и методах. Была проанализирована значимость изменения этих показателей в процессе лечения, а также статистические связи (корреляции) между уровнями показателей до лечения и их уровнями после лечения и величинами их изменений в процессе лечения.
Анализ распределений количественных показателей выявил, что показатель АТМ имеет три значимые связи:
– с дискретным показателем «перебои в работе сердца» при отсутствии жалоб в группе ОКС БПST (n = 12) с медианой АТМ, равной 1 с квартилями (1,0; 2,0), при наличии (n = 13) – 4 с квартилями (3,0; 4,0);
– с дискретным показателем «сердцебиения» при отсутствии жалоб в группе ОКС БПST (n = 19) с медианной АТМ равной 1 с квартилями (1,0; 2,0), при наличии (n = 6) – 3 с квартилями (2,0; 4,0);
– с дискретным показателем «головокружение» при отсутствии жалоб (n = 10) среднее геометрическое значение IgА к кардиомиозину равно 0,12 с 68 % доверительным интервалом, ДИ (0,10; 0,15), при наличии (n = 13) – 0,32 с 68 % ДИ (0,20; 0,41);
Показатель IgА к кардиомиозину в группе ОКС БПST имеет тоже три значимые связи:
– с показателем «перебои в работе сердца»: при отсутствии жалоб (n = 12) среднее геометрическое значение IgА к кардиомиозину равно 0,16 с 68 % доверительным интервалом, ДИ (0,14; 0,19), при наличии (n = 13) – 0,46 с 68 % ДИ (0,39; 0,41);
– с дискретным показателем «головокружение» при отсутствии жалоб (n = 11) среднее геометрическое значение IgА к кардиомиозину равно 0,13 с 68 % доверительным интервалом, ДИ (0,11; 0,15), при наличии (n = 14) – 0,38 с 68 % ДИ (0,22; 0,43);
– с показателем «сердцебиение»: при отсутствии жалоб (n = 18) среднее геометрическое значение IgА к кардиомиозину равно 0,14 с 68 % доверительным интервалом, ДИ (0,13; 0,16), при наличии (n = 7) – 0,36 с 68 % ДИ (0,21; 0,46).
Показатель IgG к кардиомиозину в группе ОКС имеет только одну статистически значимую связь с качественным показателем «перебои в работе сердца»: при отсутствии жалоб (n = 22) среднее геометрическое значение IgG к кардиомиозину равно 0,14 с 68 % доверительным интервалом, ДИ (0,13; 0,20), при наличии (n = 3) – 0,46 с 68 % ДИ (0,25; 0,53).
Анализ распределений количественных клинико-инструментальных показателей показал, что у более половины показателей распределения оказались сильно асимметричными. Для этих показателей приведены медианы и квартили; для остальных показателей приведены средние и стандартные отклонения. Также в клетке приведены численности, если они отличаются от численности соответствующей группы. Одиночный ноль, «0» в клетке означает, что вариабельность отсутствует.
Таблица 2
Результаты однофакторного непараметрического дисперсионного анализа показателей иммунного воспаления с клиническими жалобами (критерий Манна‒Уитни) Группа ОКС БП ST
|
Показатель |
IgG |
IgA |
ATM |
|
Перебои |
0,01 |
0,01 |
0,01 |
|
Сердцебиение |
0,06 |
0,004 |
0,01 |
|
Головокружение |
0,01 |
0,01 |
0,07 |
В табл. 4 приведены р-значения для оценки значимости изменений показателей в процессе лечения. Поскольку большинство распределений были далеки от нормального, были использованы два непараметрических критерия для связанных выборок, дополняющих друг друга – критерий знаков и критерий Вилкоксона.
Проведенный анализ показал, что в группе пациентов с ОКС БП ST статистически значимый эффект лечения имеет место для уровня Ig А к кардиомиозину, средней ЧСС днем, количества эпизодов тахикардии в сутки и количества желудочковой эктопической активности за сутки, то же справедливо (в меньшей степени) и для уровня Ig G к кардиомиозину.
Поскольку в группе ОКС БП ST имелись два обследовании, до и после лечения, были вычислены корреляции между значениями показателей для первого обследования и их значениями для второго обследования и разностными величинами (характеризующими эффект лечения). После проведенного стандартизированного лечения в группе больных ОКС БП ST значимо уменьшился уровень иммуноглобулинов G и A к кардиомиозину, общих анител к миокарду, индекс ШОКС, функциональный класс ХСН, средняя ЧСС днем, уменьшилась аритмическая активность (количество эпизодов тахикардии и в сутки, количество желудочковых экстрасистол в сутки; количество политопных желудочковых экстрасистол). При этом фракция выброса левого желудочка значимо не менялась. Результаты приведены в табл. 5.
Таблица 3
Результаты сравнения показателей в группе больных ОКС БП ST
|
Показатель |
Первое обследование (n = 25) |
Второе обследование (n = 25) |
Эффект лечения (изменение показателя, х2–х1) |
|
Ig G к кардиомиозину |
0,21 ± 0,14 |
0,19 ± 0,11 |
–0,017 ± 0,038 |
|
Ig A к кардиомиозину |
0,23 ± 0,16 |
0,21 ± 0,12 |
–0,021 ± 0,042 |
|
АТМ* |
52,5; (3,8; 719,9) |
33; (4,5; 246) |
0,63; (0,24; 1,62) |
|
Систолический размер ЛЖ |
34 ± 4,1 |
34 ± 4,2 |
–0,01 ± 0,87 |
|
Диастолический размер ЛЖ |
53 ± 4,2 |
53 ± 4,3 |
–0,01 ± 0,92 |
|
Толщина МЖП |
12,1 ± 2,2 |
12,1 ± 2,0 |
0,02 ± 0,62 |
|
Толщина ЗСЛЖ |
12,5 ± 2,2 |
12,5 ± 2,1 |
–0,02 ± 0,42 |
|
ФВ % |
58 ± 9 |
58 ± 8 |
–0,08 ± 1,63 |
|
Индекс ШОКС |
2,8 ± 1,2 |
2,4 ± 1,0 |
–0,32 ± 0,69 |
|
Тест 6-минутной ходьбы |
458 ± 52 |
467 ± 43 |
10 ± 24 |
|
ФК СН |
1,2 ± 0,5 |
1,1 ± 0,4 |
–0,16 ± 0,37 |
|
ЧСС днем |
76 ± 8 |
71 ± 5 |
–8 ± 7 |
|
ЧСС ночью |
60 ± 6 |
59 ± 5 |
–1 ± 5 |
|
Количество эпизодов тахикардии в сутки |
27; (17; 41) |
18; (11; 28) |
–4; (–11; –2) |
|
Количество эпизодов брадикардии в сутки |
10; (3; 18) |
9; (3; 15) |
0; (–1; 0) |
|
Количество наджелудочковых экстрасистол в сутки |
7; (2; 18) |
4; (1; 16) |
0; (–11; 0) |
|
Количество желудочковых экстрасистол в сутки |
11; (3; 29) |
9; (1; 29) |
0; (–2; 0) |
Примечание. * – для показателя АТМ приведены среднее геометрическое и 68 % ДИ.
Таблица 4
Значимость изменений в процессе лечения, группа ОКС БП ST
|
Показатель |
Критерий знаков |
Критерий Вилкоксона |
|
Ig G к кардиомиозину |
< 0,001 |
< 0,001 |
|
Ig А к кардиомиозину |
0,05 |
0,02 |
|
ATM |
0,07 |
0,04 |
|
ФВ % |
1,00 |
1,00 |
|
Индекс ШОКС |
0,07 |
0,04 |
|
Тест 6-минутной ходьбы |
1,00 |
0,16 |
|
ФК ХСН |
0,13 |
0,07 |
|
ЧСС днем (средняя) |
0,001 |
0,001 |
|
ЧСС ночью (средняя) |
0,05 |
0,05 |
|
Количество эпизодов тахикардии в сутки |
0,01 |
< 0,01 |
|
Количество эпизодов брадикардии в сутки |
0,11 |
0,14 |
|
Количество наджелудочковых экстрасистол в сутки |
0,58 |
0,53 |
|
Количество желудочковых экстрасистол в сутки |
0,01 |
0,01 |
|
Количество политопных желудочковых экстрасистол |
0,02 |
0,02 |
Диаграммы связей наиболее значимых клинических проявлений с показателями иммунологического ответа приведены на рисунках далее. В большей степени изменения в процессе лечения касаются желудочковой эктопической активности и аритмических событий.
Приведенная диаграмма (рис. 4) хорошо иллюстрирует, что у всех пациентов в результате лечения не увеличилось количество эпизодов тахикардии, а у 3-х пациентов с исходным количеством эпизодов более 100 в сутки произошло их заметное уменьшение.
Таблица 5
Эффект лечения в группе больных ОКС БП ST
|
Показатель |
2-е обсл. |
Эффект |
|
Ig G к кардиомиозину |
0,98 |
–0,63 |
|
Ig А к кардиомиозину |
0,97 |
–0,52 |
|
ATM |
0,94 |
–0,73 |
|
Индекс ШОКС |
0,84 |
–0,60 |
|
Тест 6-минутной ходьбы |
0,87 |
–0,48 |
|
ФК ХСН |
0,68 |
–0,67 |
|
ЧСС днем (средняя) |
0,53 |
–0,79 |
|
ЧСС ночью (средняя) |
0,58 |
–0,43 |
|
Количество эпизодов тахикардии в сутки |
0,86 |
–0,79 |
|
Количество эпизодов брадикардии в сутки |
0,98 |
–0,49 |
|
Количество наджелудочковых экстрасистол в сутки |
0,90 |
–0,51 |
|
Количество желудочковых экстрасистол в сутки |
0,93 |
–0,64 |
|
Количество политопных желудочковых экстрасистол |
0,84 |
–0,76 |
|
Паузы ЧСС |
0,86 |
–0,15 |
|
Эпизоды фибрилляции предсердий |
0,96 |
–0,21 |
|
Желудочковая тахикардия |
0,94 |
–0,47 |
Примечание. Коэффициенты корреляции Пирсона между результатами первого и второго обследований (2-й столбец) и между результатами первого обследования и величиной изменения показателей между обследованиями (3-й столбец).
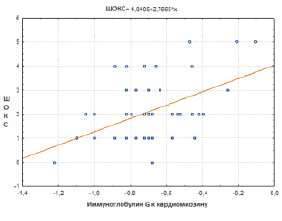
Рис. 1. Диаграмма корреляционной взаимосвязи между титром IgG к кардиомиозину и шкалой оценки клинического состояния у больных миокардитом
В табл. 6 приведены коэффициенты корреляции Спирмена между изменениями уровней показателей антител к миокарду и изменениями клинико-инструментальных показателей.
Результаты вычислений показали, что статистически значимые коэффициенты корреляции выявлены:
а) между изменением АТМ и исходным уровнем КАГ, изменениями индекса ШОКС, ФК ХСН, количества эпизодов тахикардии в сутки и количества желудочковых экстрасистол в сутки;
б) между изменением IgA и начальными уровнями фибриногена и СРБ, изменениями индекса ШОКС и количества желудочковых экстрасистол в сутки;
в) между изменением IgG и изменениями индекса ШОКС, теста 6-минутной ходьбы и ФК ХСН.
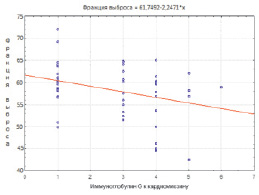
Рис. 2. Диаграмма корреляционной взаимосвязи между титром IgG к кардиомиозину и фракцией выброса левого желудочка
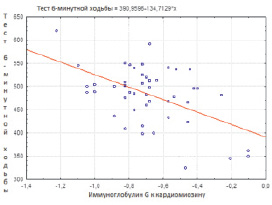
Рис. 3. Диаграмма корреляционной взаимосвязи между титром IgG к кардиомиозину и тестом 6-минутной ходьбы у больных миокардитом
Таблица 6
Результаты сравнения изменений показателей в группе ОКС БП ST в процессе лечения
|
Показатель |
IgG |
IgA |
ATM |
|
КАГ |
0,24 |
0,21 |
0,29 |
|
Фибриноген |
0,32 |
0,63 |
0,36 |
|
CРБ |
0,44 |
0,64 |
0,35 |
|
Индекс ШОКС |
0,48 |
0,53 |
0,73 |
|
Тест 6-минутной ходьбы |
–0,51 |
–0,17 |
–0,27 |
|
ФК ХСН |
0,57 |
0,41 |
0,60 |
|
Количество эпизодов тахикардии в сутки |
0,45 |
0,36 |
0,59 |
|
Количество желудочковых экстрасистол в сутки |
0,25 |
0,48 |
0,51 |
|
Количество политопных желудочковых экстрасистол |
0,12 |
0,09 |
0,13 |
Примечание. Коэффициенты корреляции Спирмена между изменениями показателей в процессе лечения. Жирным шрифтом выделены показатели, для которых p < 0,02.
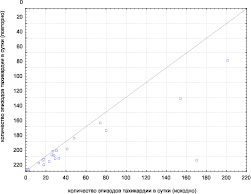
Рис. 4. Диаграмма корреляционной взаимосвязи эпизодов неустойчивой тахиаритмии у больных с ОКС БП ST
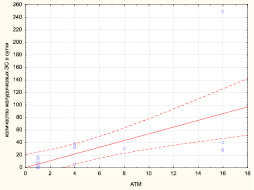
Рис. 5. Диаграмма корреляционной взаимосвязи между титром антител к миокарду и количеством желудочковых экстрасистол у больных с ОКС БП ST
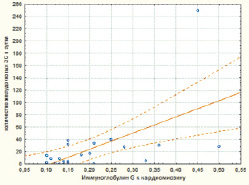
Рис. 6. Диаграмма корреляционной взаимосвязи между титром IgG к кардиомиозину и количеством желудочковых экстрасистол у больных с ОКС БП ST
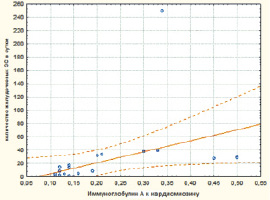
Рис. 7. Диаграмма корреляционной взаимосвязи между титром Ig А к кардиомиозину и количеством желудочковых экстрасистол у больных с ОКС БП ST
Выводы
1. Антитела к миокарду и иммуноглобулины классов A и G к кардиомиозину у больных хроническим миокардитом и ишемической болезнью сердца выявляются достоверно чаще по сравнению со здоровой группой контроля. Так, у больных миокардитом частота встречаемости антител к миокарду и Ig A и G к кардиомиозину составляла 36,6; 39,2 и 23,5 % соответственно. У больных ОКС без подъема сегмента ST антитела к миокарду и Ig A и G к кардиомиозину встречаются с частотой 20,1; 20,1 и 16,2 % соответственно
2. У больных хроническим миокардитом выявлены значимые корреляционные связи между увеличением концентрации в крови антител к миокарду, Ig A, Ig G к кардиомиозину и выраженностью клинических проявлений хронической сердечной недостаточности (снижением сократительной функции сердца, снижением результатов теста 6-минутной ходьбы). У больных ОКС без подъема сегмента ST установлены значимые корреляционные связи с желудочковой эктопической активностью.
3. В группе больных с хроническим миокардитом увеличенные показатели иммунного воспаления в большей степени ассоциированы с проявлениями неспецифического воспалительного процесса (фибриноген, r = 0,64, р < 0,05; СРБ, r = 0,66, р < 0,05), снижением фракции выброса левого желудочка r = –0,37, р < 0,05), индексом шкалы оценки клинического состояния при ХСН (r = 0,48, р < 0,05) и функциональным классом сердечной недостаточности (r = 0,56, р < 0,05). В группе больных ИБС увеличенные показатели иммунного воспаления ассоциированы с нестабильностью коронарного кровотока и нарушениями ритма сердца (увеличением частоты жалоб на «перебои» – p < 0,01, «сердцебиение» – p < 0,01; наличием синусовой тахикардии на ЭКГ, p < 0,01; выявлением желудочковой экстрасистолии, p < 0,02 и неустойчивой желудочковой тахикардии, p < 0,02 по данным холтеровского мониторирования ЭКГ).
Рецензенты:
Куликов А.Н., д.м.н., профессор кафедры пропедевтики внутренних болезней, главный специалист по функциональной диагностике, ФГКВОУ ВПО «Военно-медицинская академия им. С.М. Кирова», г. Санкт-Петербург;
Бернштейн Л.Л., д.м.н., профессор кафедры кардиологии им. М.С. Кушаковского, ГБОУ ВПО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, г. Санкт-Петербург.
Работа поступила в редакцию 27.11.2013.



