Для подтверждения пригодности методик анализа новых лекарственных средств принято использовать метод валидации. Ранее нами описана технология и анализ разработанных нами ректальных суппозиториев, содержащих диклофенак натрия (ДН) и кислоту ацетилсалициловую (КАС) по 0,05 г [5].
Целью исследования явилось подтверждение точности и достоверности разработанных методик анализа суппозиториев с помощью метода валидации. Для этой цели использованы критерии: специфичность, линейность, прецизионность, правильность.
Материалы и методы исследования
Качественный анализ ингредиентов суппозиториев проводили на пластинках «Сорбфил» в оптимальной системе хлороформ-ацетон-ледяная уксусная кислота (10:10:0,2) [4]. Диклофенак натрия обнаруживали в УФ-свете по появлению фиолетового пятна на зеленом фоне. Затем хроматограмму обрабатывали раствором железа (III) хлорида и нагревали в течение 5 минут в сушильном шкафу при температуре 105 °С. Кислоты ацетилсалициловая и салициловая проявлялись в виде синих пятен на желтом фоне.
Нами были изучены спектры поглощения 0,002 % растворов лекарственных веществ в 0,1 М растворе натрия гидроксида (рис. 1).
Из рис. 1 следует, что спектры ДН и КАС накладываются друг на друга. В этом случае возможно проводить количественный анализ в максимумах поглощения каждого ингредиента, используя метод Фирордта, который дает возможность рассчитать содержание каждого компонента в лекарственном средстве. Причем анализ будет тем точнее, чем больше разность удельных показателей поглощения для выбранной длины волны.
Для подтверждения линейности спектрофотометрического определения ДН и КАС были построены градуировочные графики, рассчитаны уравнения градуировочных графиков и коэффициенты корреляции.
Проверку значимости коэффициента а проводили путем построения 6 графиков для каждого лекарственного вещества, рассчитывая каждый раз уравнение градуировочного графика. Значения шести коэффициентов а статистически обрабатывали и рассчитывали стандартное отклонение, величину t-критерия и сравнивали с табличным значением.
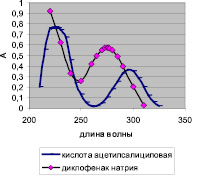
Рис. 1. Спектры поглощения: 0,002 % растворов кислоты ацетилсалициловой и диклофенака натрия в 0,1 М растворе натрия гидроксида
Прецизионность (воспроизводимость) согласно материалам ICH – это характеристика случайного рассеяния. Для этой цели вычисляли величину стандартного отклонения (SD) и относительного стандартного отклонения (RSD). ICH рекомендует оценивать прецизионность по результатам определения не менее 9 аликвот образца (3 концентрации в 3 повторностях), которые позволят статистически рассчитать эти параметры [1].
Проверку внутрилабораторной воспроизводимости проводили два разных аналитика, выполняя анализ каждого ингредиента в одной лаборатории. Оценку вопроизводимости осуществляли путем расчета стандартного (SD) и относительного стандартного отклонения (RSD [2].
Для тестирования методики на правильность готовили модельные смеси с точным содержанием каждого из компонентов. Согласно рекомендациям ICH, необходимо проанализировать не менее 9 образцов на 3 уровнях концентраций, рассчитывая открываемость вещества [3].
Определения правильности методики спектрофотометрического определения проводили методом добавок.
Результаты исследования и их обсуждение
Система растворителей хлороформ-ацетон-ледяная уксусная кислота (10:10:0,2) позволяет четко разделить и идентифицировать указанные компоненты и кислоту салициловую – продукт деструкции КАС (рис. 2).
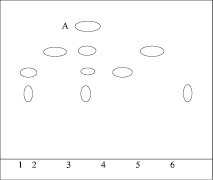
Рис. 2. Хроматограмма после термического разложения в течение 24 часов; 1 – КАС после термической обработки; 2 – ДН после термической обработки; 3 – cмесь после термической обработки; А – новое пятно (Rf = 0,9); 4 – СО КАС (Rf = 0,71); 5 – СО ДН (Rf = 0,81); 6 – СО КС (Rf = 0,49)
Установлено, что кислота ацетилсалициловая подвергается деструкции раньше, чем диклофенак натрия, поэтому появление дополнительного пятна кислоты салициловой (продукта разложения КАС) может быть критерием для оценки качества суппозиториев.
Таким образом, метод тонкослойной хроматографии позволяет доказать специфичность данной методики и идентифицировать диклофенак натрия, кислоту ацетилсалициловую и продукт деструкции КАС – кислоту салициловую.
Построенные для подтверждения линейности методик градуировочные графики приведены на рис. 3 и 4.
Значение коэффициента корреляции для обоих лекарственных веществ имеет величину 0,999, что подтверждает линейную зависимость функции от аргумента и коррелируется с допустимым значением коэффициента корреляции, который должен быть ≥ 0,99. Рассчитанное уравнение градуировочного графика и значение коэффициента корреляции подтверждают линейность методики.
Результаты определения значимости коэффициента а в уравнении градуировочного графика приведены в табл. 1, а прецизионности – в табл. 2 и 3.
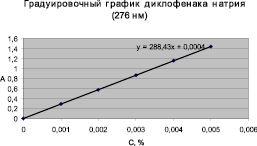
Рис. 3. Градуировочный график ДН (коэффициент корреляции 0,999)
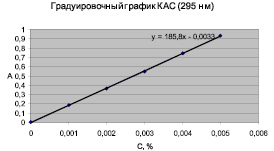
Рис. 4. Градуировочный график КАС (коэффициент корреляции 0,999)
Таблица 1
Результаты оценки коэффициента а
|
Лекарственное вещество |
Значение коэффициента а |
SD |
ta |
tтабл |
|
Диклофенак натрия |
288,3 |
1,069 |
97,07 |
2,78 |
|
Кислота ацетилсалициловая |
185,7 |
1,059 |
63,2 |
Таблица 2
Результаты определения прецизионности анализа КАС в суппозиториях
|
Уровень |
А276 |
А295 |
Навеска, г |
Р, г |
Найдено, мкг/мл |
Найдено в суппозитории, г |
Метрологические характеристики |
|
1 |
0,256 |
0,240 |
1,5502 |
2,0024 |
0,000749 |
0,0484 |
|
|
1 |
0,260 |
0,243 |
1,5516 |
0,000764 |
0,0493 |
||
|
1 |
0,252 |
0,238 |
1,5488 |
0,000756 |
0,0489 |
||
|
2 |
0,341 |
0,319 |
2,0014 |
0,001004 |
0,0502 |
||
|
2 |
0,345 |
0,325 |
2,0181 |
0,001030 |
0,0510 |
||
|
2 |
0,348 |
0,329 |
2,0485 |
0,001046 |
0,0511 |
||
|
3 |
0,425 |
0,403 |
2,5014 |
0,001279 |
0,0512 |
||
|
3 |
0,421 |
0,399 |
2,4995 |
0,001268 |
0,0508 |
||
|
3 |
0,416 |
0,391 |
2,4973 |
0,001230 |
0,0493 |
Таблица 3
Результаты определения прецизионности анализа ДН в суппозиториях
|
Уровень |
А276 |
А295 |
Навеска, г |
Р, г |
Найдено, мкг/мл |
Найдено в суппозитории, г |
Метрологические характеристики |
|
1 |
0,256 |
0,240 |
1,5502 |
2,0024 |
0,000747 |
0,0482 |
|
|
1 |
0,260 |
0,243 |
1,5516 |
0,000759 |
0,0490 |
||
|
1 |
0,252 |
0,238 |
1,5488 |
0,000733 |
0,0475 |
||
|
2 |
0,341 |
0,319 |
2,0014 |
0,000995 |
0,0498 |
||
|
2 |
0,345 |
0,325 |
2,0181 |
0,001004 |
0,0498 |
||
|
2 |
0,348 |
0,329 |
2,0485 |
0,001011 |
0,0493 |
||
|
3 |
0,425 |
0,403 |
2,5014 |
0,001234 |
0,0494 |
||
|
3 |
0,421 |
0,421 |
2,4995 |
0,001220 |
0,0489 |
||
|
3 |
0,416 |
0,416 |
2,4973 |
0,001212 |
0,0486 |
Из табл. 1 следует, что рассчитанное значение t-критерия больше табличного, следовательно, коэффициент а незначим.
Из табл. 2 и 3 следует, что относительное стандартное отклонение анализа КАС и ДН в суппозиториях составляет соответственно 2,13 и 1,71 % и не превышает допустимое стандартное отклонение (не более 3,7 %), что подтверждает прецизионность методики.
Результаты определения внутрилабораторной воспроизводимости проведены по критерию Фишера (табл. 4 и 5).
Таблица 4
Результаты определения внутрилабораторной воспроизводимости анализа кислоты ацетилсалициловой
|
№ п/п |
Найдено, г |
|||
|
1-й аналитик |
Метрологические характеристики |
2-й аналитик |
Метрологические характеристики |
|
|
1 |
0,0502 |
SD = 0,00117 RSD = 2,35 % |
0,0492 |
SD = 0,00132 RSD = 2,66 % |
|
2 |
0,0510 |
0,0498 |
||
|
3 |
0,0511 |
0,0512 |
||
|
4 |
0,0490 |
0,0515 |
||
|
5 |
0,0486 |
0,0482 |
||
|
6 |
0,0485 |
0,0488 |
||
|
|
|
|||
|
Критерий Фишера F = 1,13 F(99;5;5) = 10,97 |
||||
Таблица 5
Результаты определения внутрилабораторной воспроизводимости результатов анализа диклофенака натрия
|
№ п/п |
Найдено, г |
|||
|
1-й аналитик |
Метрологические характеристики |
2-й аналитик |
Метрологические характеристики |
|
|
1 |
0,0498 |
SD = 0,000611 RSD = 1,22 % |
0,0495 |
SD = 0,00147 RSD = 2,96 % |
|
2 |
0,0498 |
0,0491 |
||
|
3 |
0,0493 |
0,0515 |
||
|
4 |
0,0497 |
0,0514 |
||
|
5 |
0,0511 |
0,0482 |
||
|
6 |
0,0501 |
0,0484 |
||
|
|
|
|||
|
Критерий Фишера F = 2,43 F(99;5;5) = 10,97 |
||||
Из табл. 4 и 5 следует, что F ≤ F(99;5;5). Различие дисперсий 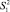 и
и 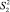 не может быть признано значимым с вероятностью P = 99, что позволяет сделать заключение о воспроизводимости результатов анализа обоих аналитиков.
не может быть признано значимым с вероятностью P = 99, что позволяет сделать заключение о воспроизводимости результатов анализа обоих аналитиков.
В табл. 6 и 7 приведены результаты определения правильности методик.
Полученные результаты открываемости находятся в пределах 98–102 % и подтверждают достаточную степень близости результатов и, следовательно, правильность методики.
Таблица 6
Результаты определения правильности анализа кислоты ацетилсалициловой
|
А276 |
А295 |
Найдено |
||
|
в мкг/мл |
в г |
R, % |
||
|
0,367 |
0,411 |
0,001506 |
0,0753 |
100,4 |
|
0,365 |
0,409 |
0,001499 |
0,0749 |
99,8 |
|
0,368 |
0,413 |
0,001515 |
0,0758 |
101,1 |
|
0,394 |
0,503 |
0,002005 |
0,1003 |
100,3 |
|
0,392 |
0,505 |
0,002023 |
0,1012 |
101,2 |
|
0,391 |
0,499 |
0,001988 |
0,09938 |
99,4 |
|
0,420 |
0,595 |
0,002506 |
0,1253 |
100,2 |
|
0,415 |
0,592 |
0,002503 |
0,1215 |
100,1 |
|
0,410 |
0,588 |
0,002491 |
0,1246 |
99,6 |
Таблица 7
Результаты определения правильности анализа диклофенака натрия
|
А276 |
А295 |
Найдено |
||
|
в мкг/мл |
в г |
R, % |
||
|
0,485 |
0,386 |
0,001493 |
0,0747 |
99,6 |
|
0,484 |
0,384 |
0,001489 |
0,07452 |
99,3 |
|
0,481 |
0,383 |
0,001479 |
0,0740 |
98,7 |
|
0,629 |
0,454 |
0,001990 |
0,0995 |
99,5 |
|
0,627 |
0,452 |
0,001984 |
0,09927 |
99,3 |
|
0,631 |
0,453 |
0,00200 |
0,10002 |
100,0 |
|
0,743 |
0,521 |
0,002489 |
0,1244 |
99,5 |
|
0,774 |
0,519 |
0,002493 |
0,1247 |
99,8 |
|
0,779 |
0,520 |
0,002510 |
0,1256 |
100,5 |
Выводы
Полученные результаты подтверждают валидность разработанных методик анализа диклофенака натрия и кислоты ацетилсалициловой и возможность их использования для анализа ингредиентов суппозиториев указанного состава.
Рецензенты:
Кодониди И.П., д.фарм.н., доцент кафедры органической химии, Пятигорский медико-фармацевтический институт, филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Андреева И.Н., д.фарм.н., профессор кафедры туризма, институт сервиса и технологий (филиала) ДГТУ, г. Пятигорск.
Работа поступила в редакцию 10.10.2013.




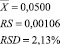
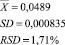
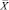 = 0,0498
= 0,0498
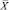 = 0,0503
= 0,0503
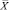 = 0,0500
= 0,0500
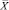 = 0,0497
= 0,0497