Вариабельность ритма сердца (ВРС) является одним из механизмов адаптации организма к меняющимся внешним и внутренним факторам и отражает степень напряжения регуляторных систем на любое стрессовое воздействие [1]. Острое нарушение мозгового кровообращения приводит не только к повышению уровня катехоламинов плазмы, но и изменениям автономной регуляции сердечно-сосудистой системы, что может повышать электрическую нестабильность миокарда [2–4], поэтому анализ ВРС в динамике может быть полезным для оценки церебральной функции и течения заболевания.
Цель работы: изучить вариабельность ритма сердца и циркадный индекс частоты сердечных сокращений при остром ишемическом инсульте в динамике.
Материалы и методы исследования
Работа выполнена на базе неврологического и кардиологического отделений ГБУЗ РМ «Республиканская клиническая больница № 4» и поликлиники № 2 ГБУЗ РМ «Республиканская клиническая больница № 5» г. Саранска в 2007–2012 г. В исследование включено 216 пациентов в возрасте от 40 до 84 лет. Основную группу (ОГ) составили 108 больных с АГ и ишемическим инсультом, мужчин – 55 (50,93 %), женщин – 53 (49,07 %) в возрасте от 40 до 84 лет, средний возраст – 61,63 ± 1,13 года. Критерии включения: АГ и ишемический характер поражения вещества головного мозга с давностью развития очаговых неврологических симптомов не более 3-х суток. Характер и локализация очагового поражения головного мозга были верифицированы с помощью компьютерной томографии. Локализация инсульта у 91 (84,26 %) больного была в каротидной системе, из них у 45 (41,67 %) – справа, и у 46 (42,59 %) – слева, у остальных 17 (15,74 %) – в вертебрально-базилярной системе. По данным ультразвукового дуплексного сканирования брахиоцефальных сосудов и транскраниального дуплексного сканирования, атеротромботический инсульт диагностирован у 88 (81,48 %) пациентов; лакунарный инсульт – у 20 (18,52 %) пациентов. Тяжесть инсульта оценивалась к моменту окончания лечения в стационаре по классификации Гусева Е.И. (1962 г.). Легкий инсульт был у 20 (18,52 %), средней тяжести – у 80 (74,07 %), тяжелый – у 8 (7,41 %) больных.
Группу контроля (ГК) составили 78 больных АГ без инсульта: мужчин – 39 (50,00 %), женщин – 39 (50,00 %) в возрасте от 43 до 78 лет, средний возраст – 59,24 ± 1,17.
Критериями исключения для ОГ и ГК были: острый коронарный синдром, хроническая сердечная недостаточность III-IV функциональных классов по классификации Нью-Йоркской ассоциации сердца, фибрилляция предсердий постоянная форма.
Группу здорового контроля (ГЗК) составили 30 практически здоровых добровольцев: мужчин – 15 (50,00 %), женщин – 15 (50,00 %) в возрасте 46–75 лет, средний возраст – 58,83 ± 1,28. Критерии исключения для ГЗК: сердечно-сосудистые заболевания в анамнезе, курение, злоупотребление алкоголем.
Пациенты перечисленных групп были сопоставимы по возрасту и полу, а ОГ и ГК – по сопутствующей патологии (табл. 1).
Таблица 1
Сравнительная клинико-демографическая характеристика пациентов, включенных в исследование
|
Показатели |
ОГ (n = 108) |
ГК (n = 78) |
ГЗК (n = 30) |
|
Мужчины |
55 (50,93 %) |
39 (50,00 %) |
15 (50,00 %) |
|
Женщины |
53 (49,07 %) |
39 (50,00 %) |
15 (50,00 %) |
|
Средний возраст, годы |
61,63 ± 1,13 |
59,24 ± 1,17 |
58,83 ± 1,28 |
|
Давность АГ, годы |
10,67 ± 0,93 |
11,88 ± 1,45 |
– |
|
Сопутствующие заболевания: Стенокардия напряжения Инфаркт миокарда в анамнезе Сахарный диабет 2 типа |
50 (46,30 %) 11 (10,19 %) 25 (23,15 %) |
45 (57,69 %) 13 (16,67 %) 15 (19,23 %) |
– – – |
|
Окружность талии (ОТ), см |
101,23 ± 2,24 |
100,47 ± 1,82 |
90,67 ± 1,90*# |
|
ИМТ, кг/м2 |
28,94 ± 0,60 |
29,93 ± 0,67 |
27,03 ± 0,68*# |
|
Глюкоза натощак, ммоль/л |
5,95 ± 0,22 |
5,65 ± 0,16 |
4,41 ± 0,07*# |
|
Калий, ммоль/л |
4,26 ± 0,10 |
– |
– |
Примечание. Достоверность различия с показателями больных – * ОГ (Р < 0,05), # – ГК (Р < 0,05).
Методы обследования. Клиническое обследование больных включало: сбор анамнеза, осмотр пациента и антропометрическое обследование (масса тела (МТ) в кг, индекс МТ (ИМТ = МТ(кг)/рост(м2)) и окружность талии (ОТ) в см). Антропометрическое обследование проводили в подостром периоде инсульта (при выписке из стационара). Всем больным определяли глюкозу крови, 40 пациентам ОГ – калий сыворотки крови.
Холтеровское монторирование (ХМ) проводилось с использованием системы «МИОКАРД-ХОЛТЕР» на 2-е сутки госпитализации, то есть на 2–3 сутки от развития инсульта и в динамике через 10 дней лечения. ХМ пациентам ГК и ГЗК проводилось 1 раз. ВРС оценивали по временным показателям: SDNN (мс) – стандартное (среднеквадратичное) отклонение полного массива последовательных интервалов RR (NN), представляющее суммарный эффект вегетативной регуляции сердца; SDNNi (мс) – индекс SDNN, среднее значение стандартных отклонений последовательных 5-минутных участков суточной записи RR интервалов, отражающее вариабельность с цикличностью 5 минут; RMSSD (мс) – среднеквадратичная разница между соседними интервалами RR, отражающая активность парасимпатического звена вегетативной регуляции; pNN50 (%) – количество последовательных интервалов RR, различие между которыми превышает 50 мс выраженное в процентах к общему числу кардиоинтервалов, отражающеестепень преобладания парасимпатического звена регуляции над симпатическим (относительное значение). Циркадный профиль оценивали по циркадному индексу (ЦИ), который рассчитывали как отношение средней дневной к средней ночной частоте сердечных сокращений (ЧСС).
Интегральное заключение ВРС оценивалось методом «анализа коротких участков», разработанным Г.В. Рябыкиной и А.В. Соболевым [5] по количеству участков с малой вариабельностью (%): если больше 60 %, то «Резко снижена», от 30 до 60 % – «Умеренно снижена», меньше 30 % – «Норма».
Полученные результаты обрабатывались методом вариационной статистики на персональном компьютере с использованием программы Excel путем расчета средних арифметических величин (M) и ошибок средних (m). Для оценки достоверности различий двух величин использовали двухвыборочный и парный критерий Стьюдента (t). Достоверными считали различия при значении P < 0,05. Для оценки взаимосвязи двух величин использовали коэффициент корреляции Пирсона (r).
Результаты исследования и их обсуждение
Средняя ЧСС в исследуемых группах была одинаковой (рис. 2). Максимальное снижение SDNN отмечено у пациентов ОГ: на 11,36 % (P < 0,01) ниже, чем в ГК и на 18,07 % (P < 0,001) ниже, чем в ГЗК. SDNNi в ОГ был минимальным, однако разница была статистически незначима. Межгрупповых различий показателей rMSSD и pNN50 не было.
Известно, что показатели SDNN и SDNNi отражают суммарный эффект вегетативной регуляции сердца, поэтому их снижение свидетельствует об ослаблении вегетативной регуляции сердечно-сосудистой системы в целом (как симпатической, так и парасимпатической) и снижении адаптационных возможностей сердечно-сосудистой системы, что является неблагоприятным фактором.
ЦИ у больных ОГ был самым низким и составил 1,12: ниже, чем в ГК – на 5,08 % (P < 0,001) и ниже, чем ГЗК – на 11,11 % (P < 0,001). При индивидуальной оценке ЦИ оказалось, что у больных ОГ ригидный циркадный профиль ритма встречался на 28,78 % чаще (Р < 0,001), чем в ГК (в 85,19 % случаев против 56,41 %) и на 61,86 % чаще (P < 0,001), чем в ГЗК (в 85,19 % случаев против 23,33 %).
Таблица 2
Вариабельность ритма сердца, ЦИ и синусовая аритмия (М ± m) (n, %)
|
Показатели |
ОГ (n = 108) |
ГК (n = 78) |
ГЗК(n = 30) |
|
ЧСС за сутки |
69,21 ± 0,98 |
69,61 ± 1,12 |
71,10 ± 1,45 |
|
SDNN, мс |
112,00 ± 3,45 |
126,35 ± 4,21 P1 < 0,01 |
136,70 ± 5,58 P1 < 0,001 |
|
SDNNi, мс |
48,81 ± 1,67 |
49,82 ± 2,06 |
51,27 ± 1,94 |
|
rMSSD, мс |
27,53 ± 1,42 |
27,71 ± 1,91 |
25,83 ± 1,63 |
|
pNN50, % |
6,18 ± 0,73 |
6,47 ± 0,82 |
5,70 ± 1,09 |
|
ЦИ |
1,12 ± 0,01 |
1,18 ± 0,01 P1 < 0,001 |
1,26 ± 0,01 P1 < 0,001 P2 < 0,001 |
|
Интегральная оценка |
|||
|
Нормальная |
39 (36,11 %) |
31 (39,74 %) |
15 (50 %) |
|
Умеренно снижена |
26 (24,07 %) |
27 (34,62 %) |
12 (40 %) |
|
Резко снижена |
43 (39,82 %) |
20 (25,64 %) P1 < 0,05 |
3 (10 %) Р1 < 0,001 Р2 < 0,001 |
|
Синусовая аритмия |
35 (32,41 %) |
44 (56,41 %) P1 (P < 0,002) |
28 (90,33 %) P1 (P < 0,001) P2 (P < 0,001) |
Примечание. P1 – ошибка достоверности различий в сравнении c ОГ; P2 – с ГК.
Циркадная изменчивость параметров сердечного ритма является оригинальным проявлением ВРС и отражает функциональные резервы сердечно-сосудистой системы при адаптации к суточному циклу свободной активности. Существенное снижение ЦИ у пациентов ОГ свидетельствует о выраженном нарушении центрального и вегетативного звена регуляции ритма сердца, что может ассоциироваться с неблагоприятным прогнозом и высоким риском аритмогенных синкопальных состояний и внезапной смерти.
При оценке ВРС методом «анализа коротких участков» снижение вариабельности у больных ОГ и ГК было более заметным. Так, в ОГ количество пациентов с резко сниженной ВРС было в 1,55 раза больше (P < 0,05), чем в ГК, и в 3,98 раза больше (P < 0,001), чем в ГЗК.
Интересным наблюдением было то, что с уменьшением ВРС уменьшалась распространенность синусовой аритмии в ОГ и ГК в сравнении с практически здоровыми пациентами, причем частота выявления синусовой аритмии в ОГ была меньше в 1,74 раза (P < 0,002), чем в ГК, и в 2,79 раза (P < 0,001), чем в ГЗК.
Синусовая аритмия присуща как здоровым, так и больным людям. Дыхательная аритмия свидетельствует о нормальном функционировании вегетативной нервной системы и, как правило, расценивается как благоприятный фактор, а исчезновение дыхательной аритмии и вообще синусовой аритмии обусловлено снижением функции вегетативной нервной системы и имеет неблагоприятный прогноз [6].
При корреляционном анализе выявлена статистически значимая связь показателей ВРС с тяжестью инсульта, возрастом, уровнями глюкозы и калия крови, ИМТ и ОТ.
SDNN отрицательно коррелировал с тяжестью инсульта (r = –0,203; P < 0,05), с уровнем глюкозы крови (r = –0,388; P < 0,001), ИМТ (r = –0,313; P < 0,002) и ОТ (r = –0,395; P < 0,001). SDNNi отрицательно коррелировал с возрастом (r = –0,231; P < 0,02), с уровнем глюкозы крови (r = –0,415; Р < 0,001), ОТ (r = –0,372; P < 0,001), положительно и умеренно – с уровнем калия сыворотки крови (r = 0,400; P < 0,05).
rMSDD был отрицательно связан с уровнем глюкозы (r = –0,280; P < 0,005) и прямо – с уровнем калия сыворотки крови (r = 0,310; Р < 0,05), pNN50 – отрицательно с уровнем глюкозы (r = –0,239; P < 0,02).
Тяжесть снижения ВРС по интегральной оценке коррелировала положительно с тяжестью инсульта (r = 0,189; P < 0,05), возрастом (r = 0,285; P < 0,005), уровнем глюкозы крови (r = 0,271; P < 0,005), ОТ (r = 0,251; Р < 0,05) и отрицательно с уровнем калия (r = –0,377; P < 0,02).
В динамике через 10 дней лечения тяжесть снижения ВРС увеличилась как по данным временных показателей (рис. 1), так и по интегральному заключению (рис. 2). ЦИ увеличился на 1,79 % (P < 0,005) (с 1,12 ± 0,01 до 1,14 ± 0,01, что свидетельствует о начинающемся восстановлении адаптации организма к циклу дневной активности через 10 дней лечения.
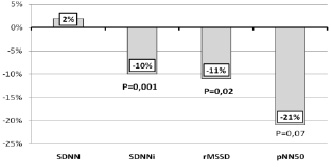
Рис. 1. Динамика временных показателей ВРС через 10 дней лечения (∆, %). Примечание. Р – ошибка достоверности динамики показателя
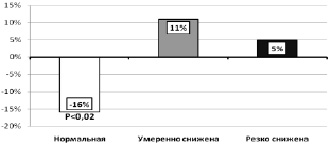
Рис. 2. Динамика ВРС по интегральной оценке через 10 дней лечения (∆, %). Примечание. Р – ошибка достоверности динамики показателя
По данным литературы, нарушения ВРС могут сохраняться по окончании острого периода инсульта [2, 7]. Мы предполагаем, что снижение ВРС при инсульте может иметь отсроченный характер. Вероятно, в острейшем периоде инсульта ВРС поддерживается повышением напряжения механизмов регуляторных систем, а через 10 дней происходит их истощение, что приводит к ослаблению вегетативной регуляции и дополнительному снижению ВРС. Не исключается и негативное влияние лекарственных препаратов на ВРС. По нашему мнению, этот вопрос нуждается в дальнейшем изучении.
Выводы
1. В острейшем периоде инсульта снижается адаптация организма, проявляющаяся снижением вариабельности ритма сердца и циркадного индекса частоты сердечных сокращений.
2. Наряду с тяжестью инсульта дополнительными факторами риска снижения вариабельности ритма сердца являются возраст, гипокалиемия и метаболические нарушения, такие как гипергликемия и абдоминальное ожирение.
3. Через 10 дней лечения тяжесть снижения вариабельности ритма сердца увеличивается вследствие уменьшения вегетативной регуляции и начинает восстанавливаться адаптация организма к циклу дневной активности, проявляющаяся повышением циркадного индекса.
Рецензенты:
Инчина В.И., д.м.н., профессор, заведующая кафедрой клинической фармакологии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск;
Мосина Л.М., д.м.н., профессор кафедры госпитальной терапии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.
Работа поступила в редакцию 03.06.2013.



