Ревматоидный артрит (РА) относится к числу наиболее распространенных и тяжелых хронических воспалительных заболеваний, которое приводит к быстрой инвалидизации, сокращению продолжительности жизни [2, 3]. Это гетерогенное с точки зрения патогенеза заболевание, где дефекты клеточного иммунореагирования и гиперпродукция фактора некроза опухоли α (TNF-α) являются важным, но далеко не единственным механизмом воспаления и тканевой деструкции [1, 4, 5].
Данные экспериментальных исследований свидетельствуют о фундаментальной роли В- лимфоцитов в иммунопатогенезе РА, где В-лимфоциты участвуют в активации СД4+ Т клеток по Th-1 типу в синовиальной ткани, обладают способностью взаимодействовать с иммунными комплексами и «презентировать» широкий спектр аутоантигенов [7].
В связи с этим уточнение предикторов воспаления у больных РА остается актуальным в течение заболевания и выборе терапии.
Цель исследования – изучить характер воспаления у больных ревматоидным артритом в комплексной оценке субпопуляции лимфоцитов и моноцитарно/макрофагального фактора сыворотки крови.
Материалы и методы исследования
Под наблюдением находилось 56 больных, из них 42 (75 %) женщины (средний возраст – 38,7 ± 4,03 лет, 14 (25 %) мужчин (средний возраст – 43,2 ± 1,98 лет).
Все больные поступали в период обострения заболевания. Контрольную группу составили 18 здоровых доноров, сопоставимых с исследуемой группой по полу и возрасту.
Диагноз заболевания ставился на основании клинической картины и верифицировался при функциональных и лабораторных методах исследования (ASR, 1983 г.).
Все пациенты на момент госпитализации были обследованы клиническими и иммунологическими методами и дали письменное согласие на исследование. Иммунологическое исследование включало определение субпопуляций лимфоцитов (СД4+, СД8+, СД16+, СД25+, СД95+, HLA– DR+) с использованием моноклональных антител, сывороточных иммуноглобулинов (IgA, IgM, IgG) методом радиальной иммунодиффузии в геле по Mancini (1965), уровня циркулирующих иммунных комплексов (ЦИК) по P. Falck (1979). Цитокиновый статус определяли по экспрессии провоспалительных цитокинов (TNF-α, IL-1 β, интерферон гамма – IFN-Y) при помощи иммуноферментного анализа в плазме крови с использованием тест–систем ООО «Вектор – Бест (г. С.-Петербург). Уровень иммуноферментов (моноцитарно-хемотаксического протеина – MCP-1 и колониестимулирующего фактора – G-CSF) исследовали иммуноферментным методом трехфазного иммуноферментного анализа с использованием тест–систем ЗАО « Вектор – бест (Новосибирская область).
Статистическую обработку данных исследования проводили с помощью программного обеспечения STATISTICA for Windows (версии 6.0), при множественных сравнениях учитывали соответствующую поправку (Гланс С., 1999; Реброва О.Ю., 2002). Сравнение количественных признаков в группах проводилось по критериям Крускала–Уоллиса, по ранговому критерию множественного сравнения U Манна–Уитни.
Результаты исследования и их обсуждение
Анализ субпопуляций лимфоцитов периферической крови выявил изменения у больных РА. Так, у больных с минимальной активностью РА субпопуляционные структуры не выходили за статистически значимые изменения и были близки к контрольной группе, в группе больных с умеренной активностью были уже значимые изменения со снижением СД3+ и повышением СД 4+ лимфоцитов (51,6 ± 0,5 % и 42,5 ± 0,3 %, p < 0,05) при контроле (68,1 ± 1,4 и 39,7 ± 1,2 % соответственно) при нарастании отношения СD4+/СD8+ до 1,7 ± 0,04 ( в контроле 1,4 ± 0,04) (рисунок).
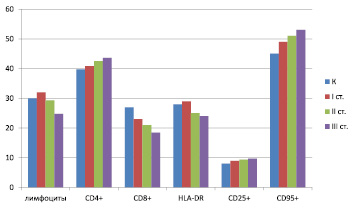
Содержание лимфоцитов у больных ревматоидным артритом. Примечание: I – минимальная активность РА; II – умеренная активность РА; III – высокая активность РА; К – контрольная группа; достоверность различий * – p < 0,05
У больных РА формирование иммунного ответа идет по двум путям: клеточного в виде выраженного увеличения Т-лимфоцитов (CD4+) на фоне снижения CD3+ Т лимфоцитов и гуморального с повышением уровня иммуноглобулина G (до 19,3 ± 2,3 и 26,0 ± 2,4 ед. соответственно активности при контроле 15,4 ± 1,4 ед.).
В целом снижение Т-лимфоцитов с цитотоксичностью (CD3+, CD8+) при высокой активности РА характеризует понижение активации Th 1 (клеточного пути) с нарастанием гуморального (В-звена) пути иммунитета по мере повышения активности. Корреляционный анализ выявил множество прямых статистически значимых связей между основными субпопуляциями лимфоцитов, показателями Т-клеточного и В-лимфоцитарного иммунитета, что свидетельствует о формировании Th 2 (гуморального) пути и способствует развитию хронического воспаления. Так, HLA-DR коррелирует с СD8+, CD16+ (r = 0,61; r = 0,68 соответственно), CD25+ c CD4+, СD16+ (r = 0,67; r = 0,73 соответственно), а IgG с CD25 (r = 0,56), ЦИК – с CD3+ (r = 0,63).
Была выявлена обратная связь показателей В-звена к антителам почечного антигена (АПА) (CD3+, r = –0,59), что подтверждает формирование Th2 (гуморального) пути иммунитета.
Нами также была изучена цитокиновая сеть как показатель, регулирующий функциональное состояние клеток фагоцитарного звена иммунитета.
Исследование показателей способности клеток крови к продукции провоспалительных цитокинов (TNF-α, IL-1 β, IFN-Y), участвующих в реакции воспаления, показало их повышение во всех группах больных.
Уровень интерлейкина 1 β (IL-1 β) высоко значимо превышал его значения в контрольной группе и составил для больных высокой активности 87,6 ± 5,34 пг/мл (в контроле – 11,6 ± 0,67 пг/мл p < 0,01) или был выше в 8 раз (табл. 1).
Также высоко значимо нарастал уровень экспрессии TNF-α 71,20 ± 5,62 пг/мл при высокой активности, до 43,54 ± 3,86 пг/мл – при умеренной активности, и до 18,10 ± 1,28 пг/мл при минимальной активности (в группе контроля 7,6 ± 0,89 пг/мл, p < 0,01). Выявлена прямая корреляционная связь уровня TNF-α c активностью процесса (r = 0,48), болевым синдромом (r = 0,32). Полученные нами высокие показатели TNF-α и IL-1 β у больных РА свидетельствуют о глубоких нарушениях цитокинового статуса у этих больных, что согласуется с данными других исследований [1, 6, 7].
Таблица 1
Уровень экспрессии цитокинов у больных ревматоидным артритом
|
Показатели |
IL-1 β пг/мл |
TNF-α пг/мл |
IFN-Y пг/мл |
|
Контроль n = 16 |
11,6 ± 0,67 |
7,6 ± 0,89 |
39,6 ± 6,74 |
|
РА I ст. активн. n = 8 |
22,4 ± 4,68* |
18,10 ± 1.28* |
48,2 ± 4,48 |
|
РА II ст. активн.n = 26 |
47,2 ± 7,63* |
43,54 ± 3,86** |
62,0 ± 4,50* |
|
РА III ст. активн.n = 22 |
87,6 ± 5,34** |
71,20 ± 5,62** |
54,7 ± |
Примечание. Значения достоверны с группой контроля: * – p < 0,05; ** – p < 0,01; изучение хемокинов моноцитов/макрофагов MCP – 1 и G – CSF в группе больных РА и сопоставление с результатами группы контроля представлено в табл. 2.
Установлен большой разброс показателей MCP-1 в группе больных РА. Сопоставление данных больных РА с показателями контрольной группы показало значимое увеличение сывороточного уровня хемокина MCP-1.
Таблица 2
Показатели цитокинов фагоцитоза и ангиогенеза у больных ревматоидным артритом
|
Показатели |
P |
Mean |
Confid 95 |
Confid + 95 % |
Media |
Minim |
Maxim |
Q1 |
Q2 |
|
Больные n = 42 |
0,001 |
MCP – 1 пг/мл |
|||||||
|
318,36 |
175,6 |
679,3 |
298,64 |
52,65 |
489,10 |
148,20 |
371,50 |
||
|
Здоровые n = 16 |
143,83 |
46,1 |
240,2 |
109,79 |
–10,19 |
236,24 |
40,51 |
163,82 |
|
|
Больные n = 42 |
0,025 |
G–CSF пг/мл |
|||||||
|
26,51 |
12,15 |
38,87 |
18,67 |
1,99 |
148,30 |
8,32 |
33,27 |
||
|
Здоровые n = 16 |
7,13 |
–0,33 |
14,60 |
5,20 |
–10,19 |
46,14 |
–0,11 |
13,32 |
|
Примечание. Достоверность различий между группами с поправкой Kruskal–Wallis.
Наибольшие показатели отмечались у больных РА по содержанию MCP-1 и составили 298,64 ± 16,53 пг/мл, превышая контрольную группу (109,79 ± 36,06 пг/мл) в 2,5 раза, разброс результатов составил 52,65 и 489,10 пг/мл (в контроле – 10,19 и 236,24 пг/мл).
Исследование содержания фактора G–CSF как показателя ангиогенеза определило его повышение в группе больных РА до 18,67 ± 3,58 пг/мл (при контроле 5,20 ± 1,16 пг/мл, p = 0,025), что подтверждало включение сосудистого русла и капиллярной сети в течение заболевания.
С целью определения направленности формирования иммунного ответа у больных РА была исследована продукция IFN-Y и IL-1 β (табл. 3).
Отмечено увеличение IFN-Y значимо во 2 группе с тенденцией к повышению в 1 и 3 группах, но одновременно и более значимо нарастали показтели IL-1 β до 87,6 ± 9,21 пг/мл (p < 0,01) при высокой активности и до 23,5–46,5 пг/мл в группах с минимальной и умеренной активностью, превышая контроль в 2 и 4 раза.
Таблица 3
Продукция цитокинов клетками крови у больных ревматоидным артритом
|
Показатели |
Исследуемые группы |
|||
|
контроль |
1 группа |
2 группа |
3 группа |
|
|
IFN-Y, пг/мл |
32,6 ± 6,74 |
48,2 ± 4,48 |
62,0 ± 4,5* |
54,7 ± 5,4 |
|
IL-1 β, пг/мл |
11,6 ± 2,30 |
23,5 ± 2,41* |
46,5 ± 4,8** |
87,6 ± 9,21** |
Примечания: различия в группах статистически значимы относительно контроля: * – p < 0,05; ** – p < 0,01;
1 группа – больные РА минимальной активности;
2 группа – больные РА умеренной активности;
3 группа – больные РА высокой активности.
Полученные данные позволяют утверждать, что происходит активация Th1 пути иммунного ответа (IFN-Y), но нарастает активность Th2 (увеличение IL-1 β) c активностью заболевания.
В целом у больных РА иммунная защита характеризуется активацией врожденных факторов иммунитета с привлечением клеток фагоцитарного звена, формированием иммунного ответа вначале по Th1 пути (IFN-Y) и активацией гуморальной защиты по мере нарастания активности РА с нарастанием аутоиммунного воспаления. Предиктором воспаления при РА определены IL-1 β и MCP-1, которые опосредуют степень активности процесса.
Таким образом, данные настоящего исследования показывают пути иммунного реагирования при РА, где уже при минимальной активности начинают вовлекаться факторы воспаления как IL-1 β, THF-α и MCP-1.
По мере нарастания активности РА IL-1 β, MCP-1 становятся основными предикторами аутоиммунного воспаления с вовлечением Th2 пути иммунного реагирования, приводят к прогрессированию заболевания, утрате функции суставов.
Рецензенты:
Никуличева В.И., д.м.н., профессор кафедры терапии и семейной медицины БГМУ, г. Уфа;
Сахаутдинова Г.М., д.м.н., профессор кафедры поликлинической терапии БГМУ, г. Уфа.
Работа поступила в редакцию 12.04.2013.



