Среди ранних репродуктивных потерь доминируют спонтанные аборты и неразвивающаяся или замершая беременности (далее – НБ), в сумме составляющие 80-90 % случаев невынашивания в 1-м триместре. Несмотря на интенсивные клинические исследования [5, 6], многие механизмы возникновения ранних репродуктивных потерь беременности ещё полностью не изучены, что объясняет значительный процент неудачных исходов лечения. Современные возможности иммуногистохимического выявления многих продуктов синцитиотрофобласта (далее – СТБ) ворсин – хорионического гонадотропина человека – β-hGC, плацентарной щёлочной фосфатазы – PLAP, рецептора фактора роста сосудов – VEGFR-3 позволяют определить молекулярные и структурные особенности развития плаценты в 1-м триместре физиологической беременности [1], но они редко используются при анализе патологии. Часто регистрируемая при ультразвуковом исследовании матки ретрохориальная гематома (далее – РХГ) приводит к отслойке плаценты и гибели эмбриона, но патогенез столь грозного осложнения, приводящего к НБ, недостаточно изучен.
Цель исследования – иммуногистохимическое определение гемореологических условий возникновения РХГ как непосредственной причины ранней потери беременности.
Материал и методы исследования
Изучены соскобы из полости матки у 39 женщин с НБ, у которых при ультразвуковой сонографии на сроках гестации от 4 до 11,5 недель после оплодотворения (далее – п.о.) было констатировано наличие РХГ различного объема в маточно-плацентарной области, т.е. в месте соединения ранней плаценты и стенки матки. Из них у 30 пациенток был выявлен эмбрион без признаков сердцебиения, у 9 – эмбрион отсутствовал (анэмбриония). Средний возраст матерей составлял 29 ± 1,3 лет, в анамнезе у них часто регистрировались медицинские аборты, длительное употребление внутриматочных противозачаточных спиралей, предыдущие НБ или спонтанные аборты. Группу сравнения составили 20 соматически здоровых женщин, которым беременность была прервана в течение 1-го триместра путём медицинского аборта. Из соскобов после промывки их водой выбирали ворсины плаценты, особенно из зон межворсинчатого тромбоза и более плотные фрагменты ткани (париетальный эндометрий и маточно-плацентарную область). 5–6 выбранных кусочков фиксировали в 10 %-м нейтральном буферном растворе формалина 24–48 часов и обрабатывали по стандартной гистологической технике. Срезы толщиной 3–5 микрон окрашивали гематоксилином-эозином. Кроме того, после депарафинизации на срезах выявляли экспрессию рецепторов к человеческому хорионическому β-гонадотропному гормону – β-hGC как основному гормону, синтезируемому СТБ, начиная с ранних стадий беременности; к рецепторам 3 типа сосудистого эндотелиального фактора роста далее – VEGFR-3 как маркёру ангиобластов и эндотелиальных клеток в процессе васкуло- и ангиогенеза ворсин и активность PLAP. После нанесения первичных антител в дальнейшем указанные продукты выявлялись с помощью Universal SH Detection Kit. Для этого депарафинированные в ксилоле срезы регидратировали через спирты снижающейся концентрации, выдерживали в 1 % растворе перекиси водорода и метанола в течение 10 минут для погашения активности эндогенной пероксидазы. Далее срезы промывали в 0,15 М трис-буфере. Маркёры были детектированы с помощью пероксидаза-авидин-биотинового метода. Конечный продукт реакции определяли с помощью 3,3’-диаминобензидина (DAB, Sigma Chemical Co), содержащий 0,01 % перекиси водорода в течение 2–3 мин. Срезы в течение 30 с контрастировали гематоксилином Майера, дегидратировали, просветляли в ксилоле. Постоянный положительный и отрицательный контроли были включены в каждую серию исследования. Препараты исследовали и фотодокументировали под световым микроскопом Leica DM500 и Leica DM4000 c использованием системы Leica Application Suite и цифровой фотокамеры высокого разрешения. Интенсивность экспрессии рецепторов определяли полуколичественным методом с учётом интенсивности окрашивания следующим образом: 0 – негативная реакция; 1 – признаки иммуноэкспрессии в виде слабого окрашивания цитоплазмы клеток; 2 – умеренно выраженная (несомненная) экспрессия; 3 – максимальные экспрессия и значения процента положительных клеток. Гистохимический коэффициент определяли по соответствующей формуле HS (Histochemical score) = ∑P(i)хi, в которой i – интенсивность окрашивания, выраженная в баллах от 0 до 3-х, P(i) – процент клеток, окрашенных с разной интенсивностью. Результат подсчёта НS-показателя трактовали следующим образом: от 0 до 10 – отрицательный; от 10 до 100 – слабоположительный; от 100 до 300 – положительный. Давность образования гематомы определяли полуколичественным методом (таблица), используя морфологические критерии, разработанные Миловановым А.П. [2]. Статистический анализ полученных результатов производили с использованием программы с «Statistica v. 6.0» фирмы StatSoft Inc. (USA).
Результаты исследования и их обсуждение
При патоморфологическом анализе микропрепаратов, окрашенных гематоксилином-эозином, основное внимание уделялось маточно-плацентарной области, которая визуализировалась по внутреннему, выстилающему слою фибриноида Рора, якорным ворсинам с пролиферацией цитотрофобласта, гестационным признакам перестройки спиральных артерий и фрагментам прилежащей РХГ. Исследованы все имеющиеся ворсины, но более тщательно – непосредственно контактирующие с материнскими эритроцитами. Наиболее значимым структурным феноменом в маточно-плацентарной области была поверхностная цитотрофобластическая инвазия с редко выявляемым внутрисосудистым компонентом (внутрисосудистым цитотрофобластом), который на продольных срезах спиральных артерий встраивался в сохранный слой эндотелиальных клеток, а на поперечных срезах формировал лишь неполные, так называемые, цитотрофобластические «пробки». Характерно, что в просветах таких «пробок» видны материнские эритроциты, даже на самых ранних сроках беременности (от 4 до 7 недель п.о., рис. 1, А). В большинстве ворсин обнаружены существенные структурные повреждения апикальной части и щёточной каймы СТБ, он уплощён, его микроворсинки укорочены и редки. Ворсинчатый цитотрофобласт представлен прерывистым слоем, в строме ворсин – мезенхима с редкими капиллярами на фоне увеличения числа плацентарных макрофагов.
Критерии оценки давности гематомы по А.П. Милованову [1999]
|
Степень (в баллах) |
Давность гематомы |
|
0 |
В «свежих» (до 30–60 минут) гематомах эритроцитарные массы имеют четкие контуры, интенсивную (максимально выраженную) окраску, отсутствие лейкоцитов и фибрина, может наблюдаться краевое стояние лейкоцитов в спиральных артериях |
|
1 |
От 1 часа до 2 суток интенсивность окраски эритроцитов снижена, в гематоме и вокруг спиральных артерий выявляются лейкоцитарные скопления различной выраженности в виде очаго-диффузной рыхлой инфильтрации либо периваскулярно в виде муфт, фибробласты в очаге кровоизлияния отсутствуют |
|
2 |
От 2 суток до 4–7 суток эритроцитарные массы бледно оражневого или желтовато-бурого цвета; зернистые, с нечёткими контурами; лейкоциты с распадом, в очаге присутствуют макрофаги, часть которых нагружена пигментом (гемосидерином), по краю очага фибробласты |
|
3 |
Давность от 4–7 суток до 1,5–2 недель. Эритроциты практически бесцветные «выщелоченные», в большей части лизированные в виде бесструктурной массы, в очаге большое количество макрофагов, в том числе с внеклеточным расположением гранул, в гематоме большое количество фибрина, периваскулярный отек |
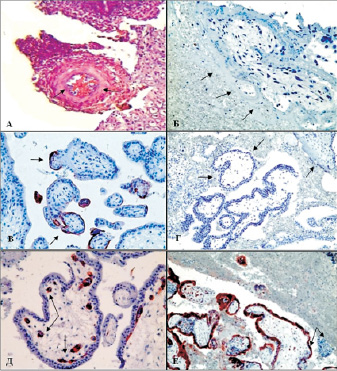
Рис. 1. Морфологическая картина и экспрессия иммуногистохимических маркёров в плаценте человека на разных сроках гестации при НБ:А – неполная цитотрофобластическая «пробка» с эритроцитами матери в просвете спиральной артерии, ранний срок 6-7 нед. п.о. Окраска гем.-эоз., ув. х200. Б – ворсина плаценты с отсутствием щёточной каймы СТБ, прямое взаимодействие с материнской кровью с оголенной поверхностью СТБ, окраска гем.-эоз., ув. х400. В – появление реакции на PLAP на 5-й нед. п.о., ранняя недостаточная компенсаторная и антикоагулянтная реакция, ув. х200. Г – отсутствие иммуноэкспрессии PLAP в ворсинах, окружённых гематомой на 8 нед. п.о., увел. х200.Д – изолированные тяжи и трубочки – истинный васкулогенез, иммуноэкспрессиия VEGFR-3, ув. х400. Г – снижение иммуноэкспресии β-hGC в зоне РХГ, ув. х200
В максимальном объёме эти изменения ворсин были выражены в зонах межворсинчатого тромбоза, в которых щёточная кайма СТБ практически отсутствовала, и материнские элементы крови, главным образом, эритроциты, непосредственно прилегали к «оголённому» эпителию ворсин (рис. 1, Б).
Учитывая разнообразные причины, приводящие к формированию РХГ, определенный интерес представляла оценка давности их образования. Она была обусловлена сроками гестации. На протяжении 5–7 недель гестации п.о. преобладали «свежие» и ранние гематомы при относительно сохранных материнских эритроцитах (оценка от 0 до 1 балла, 85 % наблюдений). На сроках гестации от 8 до 11 недель п.о. выявлена большая давность РХГ (1 балл – 16,3 %, 2 балла – 26,2 % и 3 балла – 47,5 %) с признаками распада эритроцитов и выходом гемосидерина в плазму, появлением сидерофагов. Иными словами, ранние гематомы были взаимосвязаны с преждевременным началом маточно-плацентарного кровотока через неполноценные цитотрофобластические «пробки» в спиральных артериях, а поздние гематомы формировались в процессе нарастающего объема материнской крови, т.е. на тех сроках гестации, когда маточно-плацентарный кровоток регистрировался с помощью современных ультразвуковых сканнеров [7, 8, 10]. Иммуногистохимическое исследование вышеуказанных маркеров существенно дополнило патогенез формирования РХГ. Если в группе сравнения иммуноэкспрессия PLAP в области щеточной каймы СТБ выявлялась лишь на 7-й неделе п.о. [1], то в ворсинах окруженных материнскими эритроцитами, её очаговая экспрессия была уже видна на 5-й неделе п.о. (опережающее появление). Это явление можно расценить как раннюю, но недостаточную компенсаторную реакцию, поскольку PLAP является маркером полноценной щеточной каймы и обладает выраженными антикоагуляционными свойствами [2, 9]. Характерной является негативная реакция PLAP в ворсинах, окруженных плотными гематомами после 8–10 недели п.о. (рис. 1, Г). Балльная оценка иммуноэкспрессии PLAP при РХГ столь вариабельна, что подсчёт средних значений явно нецелесообразен. Более наглядной была диаграмма индивидуальных значений коэффициентов PLAP в группах сравнения в зависимости от сроков гестации (рис. 2). Реакция на VEGFR-3 подтвердила слабую васкуляризацию ворсин плаценты, которая соответствовала стадии васкулогенеза. Этот маркер выявлял ангиобласты и эндотелиоциты в виде изолированных трубочек и тяжей с начинающимися узкими просветами (рис. 1, Д), в то время как в группе сравнения в те же гестационные сроки выявлялась уже более протяженная капиллярная сеть, т.е. ангиогенез путём почкования капилляров. Полуколичественная оценка иммуноэкспрессииVEGFR-3 в группе невынашивания составила HS = 122,05 ± 8,9, что почти в 2 раза ниже, чем в группе сравнения – HS = 223,08 ± 9,43 (р < 0,001). Иммуноэкспрессия β-hGC была «мозаичной» как в целом, так и в пределах одной и той же ворсины. Кроме небольших участков с выраженной иммуноэкспрессией этого плацентарного гормона [1], в препаратах наблюдался СТБ со следами его иммуноэкспресии, реакция была слабой или отсутствовала даже в синцитиальных почках и свободных симпластах, т.е. в тех производных СТБ, в которых при медицинских абортах отмечена максимальная экспрессия β-hGC.
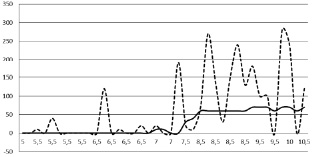
Рис. 2. Динамика иммуноэкспрессии активности плацентарной щелочной фосфатазы (PLAP) на ранних этапах беременности в плаценте человека при НБ. Обозначения: по оси ординат – значения коэффициента HS, по оси абсцисс – недели гестации. Сплошная линия – колебания индивидуальных значений показателя при нормальной беременности, прерывистая линия – при НБ
Особо следует отметить то, что резкое снижение, либо отсутствие иммуноэкспресии β-hGC отмечалось в очагах деструкции СТБ, которые замещались комочками фибриноида. Гранулоподобная экспрессия этого гормона отмечена в прилежащем фибриноиде и отсутствовала в пролиферирующем слое ворсинчатого цитотрофобласта. Суммарный HS-коэффициент иммуноэкспресии β-hGC составил 208,9 ± 68,9, что намного меньше аналогичного показателя в группе сравнения (267,69 ± 7,34). Суммируя представленные выше данные, следует подчеркнуть, что главным патогенетическим звеном (инициальным фактором НБ) является недостаточная цитотрофобластическая инвазия, которая не обладает должным объёмом и глубиной продвижения стромального и особенно внутрисосудистого цитотрофобласта. Согласно нашим результатам, это подтверждается уменьшением количества пролиферирующего цитотрофобласта в основании якорных ворсин, неглубоким проникновением стромального цитотрофобласта в сторону спиральных артерий маточно-плацентарной области, и, главное, отсутствием полностью облитерирующих их просвет цитотрофобластических «пробок», не пропускающих эритроциты матери в межворсинчатое пространство ранней плаценты. Мы наблюдали полные цитотрофобластические «пробки» в группе сравнения на 5–7 неделях п.о. и, соответственно, адекватное развитие щёточной каймы СТБ, васкуляризации ворсин в необходимом для этого низкокислородном окружении. В дальнейшем при становлении всех основных структурных компонентов ворсин уже в целом сформировавшейся плаценты осуществляется постепенно нарастающий объем маточно-плацентарного кровотока, то есть переход к более эффективному гемохориальному обмену (рис. 3, часть I).
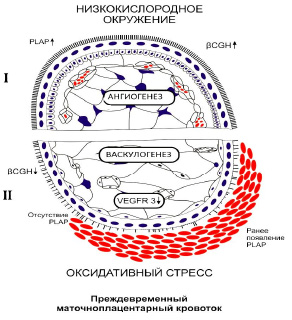
Рис. 3. Схема патогенеза ретрохориальной гематомы
При НБ складывается принципиально иное неблагоприятное микроокружение эмбриона и плаценты. Возникает маточно-плацентарный кровоток из зияющих спиральных артерий на 5–7 неделях гестации, когда компоненты ворсин ещё не готовы к приему артериальной крови, богатой кислородом и свободными радикалами, повреждающими, прежде всего, щёточную кайму СТБ [7], его гормонпродуцирующую функцию, синтез многочисленных плацентарных белков, переход васкулогенеза в ангиогенез. Раньше всего страдают гипокоагуляционые свойства щеточной каймы, которая первая контактирует с материнской артериальной кровью. Возникают гемореологические условия для образования «свежей» РХГ и гибели эмбриона. Если компенсаторных возможностей щеточной каймы СТБ в виде ранней иммуноэкспрессии PLAP оказывается достаточно или материнская кровь поступает в небольшом объеме, то возможен благоприятный исход небольшой краевой РХГ. Такие случаи нами наблюдаются в практике. Но чаще всего структурно незрелая щеточная кайма СТБ не готова принять возрастающие объёмы артериальной крови на 9–11 неделях п.о. Возникает оксидативный стресс, полное отсутствие PLAP, что приводит к образованию «поздних» форм РХГ с гибелью эмбриона (рис. 3, часть II).
Выводы
Ретрохориальная гематома представляет собой тяжёлое, подчас смертельное для эмбриона, осложнение I триместра беременности. Её возникновение связано с недостаточностью цитотрофобластической инвазии, отсутствием обтурирующих цитотрофобластических «пробок» в спиральных артериях маточно-плацентарной области, что приводит к преждевременному началу материнского кровотока в межворсинчатом пространстве ранней плаценты. Артериальная кровь, кроме кислорода, несёт в себе его свободные радикалы, которые усугубляют повреждение щеточной каймы, в частности, вызывая дефицит её важнейшего фермента – PLAP, обеспечивающего в нормальных условиях противосвёртывающие свойства СТБ. Это объясняет формирование гестационно ранних (на 5–7 неделях п.о.) и гестационно поздних (на 8–11 неделях п.о.) РХГ. Полученные данные по патогенезу РХГ при неразвивающейся беременности могут послужить базой для разработки принципиально новых подходов к лечению ранних потерь беременности и, в частности, перспектив использования препаратов антиоксидантов.
Рецензенты:
Маслякова Г.Н., д.м.н., профессор, заведующая кафедрой патологической анатомии, ГОУ ВПО «Саратовский ГМУ имени В.И. Разумовского», г. Саратов;
Чарышкин А.Л., д.м.н., профессор, заведующий кафедрой факультетской хирургии, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Работа поступила в редакцию 03.06.2013.



