Репаративные процессы в лечение ран остаются краеугольным камнем хирургии, значение которого еще более возрастает с увеличением количества стихийных бедствий, производственных и бытовых травм, военных конфликтов [10, 5, 4, 8]. Известно множество исследований, направленных на изучение гистологических и гистохимических аспектов заживления ран у человека [1, 3, 6, 4], однако полностью морфологические аспекты заживления ран, в том числе на фоне применения различных методов лечения, еще до конца не выяснены [7, 5, 2, 4].
Цель исследования – морфологически обосновать целесообразность использования коллагена и способы его введения при лечении кожных ран.
Материалы и методы исследования
Исследования проводились на 96 половозрелых белых крысах самцах массой 250 ± 25 г. Работа включала 4 группы животных – 1 контрольную и 3 опытные по 6 животных в каждой. Всем животным под эфирным наркозом на выбритом от шерсти участке в области передней поверхности средней трети бедра наносили стандартную линейную рану 1,0×0,5 см. Лечение проводили сразу после моделирования. Для лечения применялся гидролизат коллагена с содержанием сухого вещества 16 %. В первой опытной группе лечение заключалось в аппликационном нанесении гидролизата коллагена на область раны. Во второй опытной группе гидролизат коллагена вводили вокруг раны инъекционно, перпендикулярно к поверхности раны, на глубину 0,5 см, из расчета 2 мл на 1 см3, что позволило выполнить оптимальное введение вещества по всему объему тканей околораневой зоны, без лишней травматизации тканей. В третьей опытной группе применялся комплексный подход инъекционно-аппликационного введения – сначала выполнялись инъекции, а затем аппликации гидролизатом коллагена. Во всех опытных группах лечение проводилось однократно на первые сутки от начала моделирования раны. В контрольной группе лечение не применялось.
Для оценки эффективности применяемого лечения проводили морфологическое исследование тканей в области раны с постановкой гистохимических реакций. Взятие материала для морфологического исследования осуществлялось на 1, 3, 7 и 11-е сутки от начала лечения. Материал фиксировали в 10 % нейтральном формалине, изготавливали парафиновые срезы. Для структурно-функциональной оценки восстановительных процессов в пределах эпидермиса проводили анализ гистохимических реакций при выявлении РНК с Азуром Б по S. Shea и сульфгидрильных групп (SH-групп) белков по Шевремону и Фредерику [9, 11]. Визуально оценивалась интенсивность цветной гистохимической реакции и топохимия осадка. Для количественного анализа определяли продукты гистохимических реакций в пределах базального и шиповатого слоёв как наиболее функционально активных, обеспечивающих репаративные процессы в эпидермисе, с помощью анализатора изображений «Видеотест». Статистическую обработку результатов осуществляли с помощью программы Statistica 6. Достоверность различий оценивали по двухстороннему критерию Стьюдента с поправкой Ньюмана‒Кейлса.
Результаты исследований и их обсуждение
Выявление РНК у животных контрольной группы показало наличие продукта гистохимической реакции в виде базофильной субстрации различной степени интенсивности. Наиболее интенсивная базофилия наблюдается в пределах базального и шиповатого слоев, что косвенно указывает на активные метаболические процессы на данном уровне. Поверхностно расположенные слои дают менее интенсивную гистохимическую реакцию. Визуальная оценка содержания РНК в клетках эпидермиса позволила установить, что продукт реакции откладывается в виде пылевидной базофилии в цитоплазме, встречаются клетки с более крупными гранулами в перинуклеарной зоне или по периферии цитоплазмы. По данным микрофотометрии, средняя оптическая плотность РНК в клетках базального и шиповатого слоев составила 0,24 ± 0,01 усл. ед. Определение SH-групп в пределах эпидермиса показало разнообразие гистохимической реакции на уровне различных слоев. Наибольшее количество сульфгидрильных групп отмечается в роговом слое, менее выраженная реакция отмечается в глубжележащих слоях эпидермиса. SH-группы распространены в основном диффузно или в виде мелкозернистой массы. Более высокая реакционная способность определяется в поверхностных слоях интактного эпителиального пласта по сравнению с эпидермисом околораневой зоны. Средний уровень оптической плотности SH-группы в клетках базального и шиповатого слоев составил 0,26 ± 0,01 усл. ед. На 3-и сутки у животных контрольной группы на фоне репаративных процессов изменяются гистохимические показатели. Интенсивность окраски эпителиальных клеток при выявлении РНК усиливается, выраженность реакции выше в глубоких слоях эпидермиса, где преобладает равномерное отложение продукта реакции, в отдельных клетках наблюдается локализация базофильного материала в перинуклеарной зоне. Среднее значение оптической плотности РНК составляет 0,26 ± 0,01 усл. ед. Анализ гистохимической реакции выявления сульфгидрильных групп в пределах слоев эпидермиса в области раны позволил установить, что визуально не определяется особенностей в топохимии осадка. Количественная оценка средней оптической плотности SH-групп в клетках базального и шиповатого слоев (0,26 ± 0,01 усл. ед.) констатирует сохранение уровня предыдущего экспериментального срока. На 7-е сутки в пределах раневого дефекта продолжается эпителизация, выражающаяся в увеличении толщины и протяженности пласта новообразованного эпидермиса. Данные морфологические преобразования сочетаются с повышением обменных процессов, что подтверждается увеличением среднего значения оптической плотности РНК (0,30 ± 0,01 усл. ед.) в пределах базального и шиповатого слоев. Количество сульфгидрильных групп в эпидермисе увеличивается, средняя оптическая плотность в пределах базального и шиповатого слоев составляет 0,28 ± 0,02 усл. ед. На 11-е сутки в препаратах контрольной группы в области новообразованного эпидермиса при выявлении РНК определяется выраженная базофилия на уровне глубоких слоев. Установлено увеличение уровня РНК (0,31 ± 0,02 усл. ед.) на фоне существенного снижения оптической плотности SH-групп (0,27 ± 0,01 усл. ед.), что может свидетельствовать о незавершенности процессов стратификации эпидермиса.
Выбор эффективных методов регионального воздействия на ткани в области раны определяется необходимостью не только стимулировать репаративные процессы в зоне дефекта тканей, но и создавать оптимальные условия для пролиферативных превращений, обеспечивающих качественное восстановление кожи.
На 1-е сутки в первой опытной группе после аппликации гидролизата коллагена при выявлении РНК выявляется умеренная цитоплазматическая базофилия с более выраженной реакцией в пределах базального и шиповатого слов, где среднее значение оптической плотности составило 0,25 ± 0,01 усл. ед., не имея достоверных отличий от контрольного уровня. Выявление SH-групп показало, что по краям раны эпидермис характеризуется невысоким уровнем средней оптической плотности SH-групп (0,26 ± 0,02 усл. ед.), не отличающийся от контрольных значений. На 3-и сути после лечения в эпидермисе отмечается стимуляция синтетических процессов, о чем свидетельствует повышение метаболической активности в пределах базального и шиповатого слоев – среднее значение оптической плотности повышено (0,27 ± 0,01 усл. ед.) по сравнению с контролем и с предыдущим экспериментальным сроком. Процессы реэпителизации раны характеризуются незначительным повышением среднего значения оптической плотности сульфгидрильных групп (0,26 ± 0,01 усл. ед.).
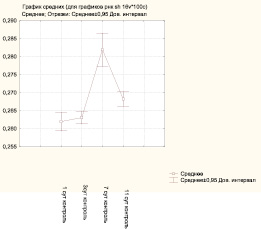
Рис. 1. Значения средней оптической плотности SH-групп в клетках базального и шиповатого слоев контрольной группы
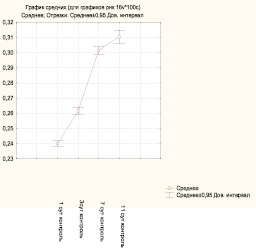
Рис. 2. Значения средней оптической плотности РНК в клетках базального и шиповатого слоев контрольной группы
На 7-е сутки процесс регенерации усиливается, что выражается в восстановлении целостности кожного покрова почти у всех животных; это находит подтверждение в гистохимических показателях: среднее значение оптической плотности РНК составляет 0,31 ± 0,02 усл. ед., превышая контрольный уровень. Отмечается отложение продуктов реакции при выявлении SH-групп преимущественно в поверхностных слоях, что указывает на процессы ороговения. В функционально активных слоях среднее значение сульфгидрильных групп превышает контрольный уровень и составляет 0,29 ± 0,01 усл. ед. На 11-е сутки в первой опытной группе толщина слоев увеличена по сравнению с эпидермисом интактной кожи в основном за счет глубжележащих слоев. Среднее значение оптической плотности РНК в клетках базального и шиповатого слоев составляет 0,32 ± 0,01 усл. ед., что превышает уровни контрольной группы и предыдущего экспериментального срока. Это свидетельствует о том, что ремоделирование раны продолжается на фоне повышенной синтетической активности эпидермиса. Выявление сульфгидрильных групп показало, что качественных особенностей в распределении продуктов гистохимической реакции не отмечалось, количественный анализ указывает на тенденцию к снижению среднего значения оптической плотности SH-групп (0,28 ± 0,01 усл. ед.) по сравнению с предыдущим экспериментальным сроком, что свидетельствует о стабилизации процессов дифференцировки в пределах эпидермиса.
Во второй опытной группе после инъекционного введения гидролизата коллагена в область раны на 1-е сутки активизируются синтетические процессы на уровне базального и шиповатого слоев эпидермиса, это отражается повышением уровня РНК и SH-групп. Средний уровень оптической плотности РНК составляет 0,25 ± 0,01 усл. ед., а сульфгидрильных групп 0,27 ± 0,02 усл. ед.; данные показатели превышают контрольные значения. На 3-и сутки в результате структурно-метаболических преобразований тканей в зоне восстановления кожных покровов на фоне реэпителизации раны происходит усиление пролиферативных процессов, что сопровождается повышением уровня РНК (0,27 ± 0,01 усл. ед.) по сравнению с контрольной группой; в сравнении с первой опытной группой достоверных отличий не отмечается. Среднее значение оптической плотности РНК в пределах базального и шиповатого слоев составляет 0,27 ± 0,01 усл. ед. Среднее значение оптической плотности SH-групп составляет 0,27 ± 0,02 усл. ед. На 7-е сутки после инъекционного введения гидролизата коллагена на фоне полного восстановления кожного дефекта отмечается усиление метаболических процессов с повышением изучаемых характеристик. Среднее значение оптической плотности РНК в клетках базального и шиповатого слоев достоверно превышает аналогичный показатель у животных контрольной группы и составляет 0,32 ± 0,01 усл. ед. Топохимия осадка при данной гистохимической реакции без особенностей. Среднее значение оптической плотности SH-групп также превышает контрольный уровень, но сохраняется уровень первой опытной группы, что подчеркивает синхронность процессов дифференцировки эпидермиса в этих экспериментальных группах (0,29 ± 0,01 усл. ед.). На 11-е сутки в восстановленном эпидермисе отмечается стабилизация синтетических процессов, но толщина слоев отличается от интактной кожи, что свидетельствует о незавершении стратификации в пределах эпидермиса. Среднее значение оптической плотности РНК составляет 0,34 ± 0,004 усл. ед. Для данной экспериментальной группы характерно снижение содержания SH-групп в пределах базального и шиповатого слоев, среднее значение оптической плотности составляет 0,27 ± 0,01 усл. ед.
На 1-е сутки после аппликационно-инъекционного введения гидролизата коллагена качественная характеристика гистохимических реакций не отличается от предыдущих экспериментальных групп. Величина среднего значения оптической плотности РНК в пределах функционально активных слоев составляет 0,26 ± 0,01 усл. ед., незначительно превышая контрольный уровень, что создает условия для интенсификации пролиферативных процессов. Среднее значение оптической плотности SH-групп (0,28 ± 0,02 усл. ед.) также превышает контрольный уровень, что потенцирует восстановительные процессы, так как сульфгидрильные группы играют важную роль в жизнедеятельности эпителиальных клеток. На 3-и сутки начинается восстановление целостности кожных покровов, эпидермис перемещается от периферии к центру, что коррелирует с гистохимическими показателями – среднее значение оптической плотности РНК составляет 0,29 ± 0,01 усл. ед., превышая контрольный уровень. Показатели функционально активных групп белков сохраняют уровень предыдущего экспериментального срока, среднее значение оптической плотности SH-групп – 0,28 ± 0,02 усл. ед. На 7-е сутки отмечается заполнение дефекта сформированным эпидермисом. Выраженность процесса стратификации приближается к уровню интактной кожи. Среднее значение оптической плотности РНК в клетках базального и шиповатого слоев составляет 0,33 ± 0,02 усл. ед., что достоверно превышает значение данного показателя в контрольной группы. Сходная количественная динамика наблюдается при выявлении SH-групп, среднее значение оптической плотности этих групп белков возрастает, достигая максимальных значений в этом эксперименте (0,34 ± 0,02 усл. ед.). На 11-е сутки стабилизация гистохимических реакций сопровождается процессами преобразований в пределах восстановительного эпидермиса. Среднее значение оптической плотности РНК (0,33 ± 0,02 усл. ед.) достоверно отличается от контрольной группы, но не изменяется на протяжении от последнего экспериментального срока. Уровень содержания сульфгидрильных групп превышает контрольные значения и составляет 0,29 ± 0,01 усл. ед., но по сравнению с предыдущим сроком наметилась тенденция к снижению, что указывает на стабилизацию процессов стратификации эпидермиса.
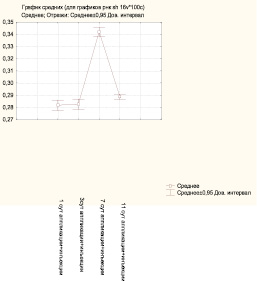
Рис. 3. Значения средней оптической плотности SH-групп в клетках базального и шиповатого слоев в опытной группе после аппликационно-инъекционного введения коллагена
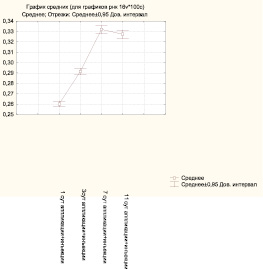
Рис. 4. Значения средней оптической плотности РНК в клетках базального и шиповатого слоев в опытной группе после аппликационно-инъекционного введения коллагена
Анализ результатов гистохимических реакций показал, что в опытных группах после аппликационного и инъекционного введения гидролизата коллагена сохраняется динамика восстановительных процессов, соответствующая направленности преобразований у животных контрольной группы; накопление РНК в процессе эпидермизации раны; повышение содержания SH-групп по мере дифференцировки эпидермиса с последующим снижением, что соответствует завершению процессов стратификации в области раны, но уровень гистохимических реакций достигает наибольших значений в третьей опытной группе после аппликационно-инъекционного метода введения.
Выводы
1. Использование гистохимических методов позволяет морфологически обосновать улучшение результатов при использовании комбинированного способа введения гидролизата коллагена при лечении ран.
2. Применение аппликационно-инъекционного введения гидролизата коллагена способствует стимулированию репаративных процессов, сокращает сроки лечения с улучшением косметического результата.
3. Наибольшая эффективность лечения асептических ран в третьей опытной группе проявляется степенью восстановительных преобразований, выражающихся в прогрессирующем накоплении РНК в функционально активных слоях эпидермиса на фоне эпидермизации раны; максимальном содержании SH-групп к 7-м суткам с последующим снижением, что соответствует ускорению стратификации эпидермиса, приближающегося по толщине и степени дифференцировки к интактным кожным покровам.
Рецензенты:
Корденко А.Н., д.м.н., профессор кафедры анатомии и физиологии, ГБОУ ВПО «Воронежский государственный педагогического университет;, г. Воронеж;
Малеев Ю.В., д.м.н., доцент кафедры оперативной хирургии с топографической анатомией, ГБОУ ВПО ВГМА им. Н.Н. Бурденко Минздрава России, г. Воронеж.
Работа поступила в редакцию 16.05.2013.



