Исследование реакции организма на различные имплантируемые материалы является основополагающей в дальнейшем решении использовать данный материал для создания тканеинженерных конструкций, способных выполнять функции отдельного органа. Эксперименты с биорезорбируемыми полимерами призваны ответить на ряд дополнительных вопросов, отражающих принципиальную способность биорезорбируемых полимерных конструкций сохранять биологическую инертность в условиях поддержания хронического воспаления вследствие их длительной клеточной резорбции in vivo. При этом обязательно следует учитывать выраженность хронического воспаления, сопровождающего этап клеточной биодеградации полимерных структур [4].
На сегодняшний день одной из нерешенных проблем в кардиохирургии является отсутствие протезов для замещения артерий малого диаметра. Возможный путь решения данной проблемы – создание сосуда непосредственно в организме на основе биодеградируемого сосудистого графта. При этом одними из основных требований к сополимерному каркасу являются достаточно высокая биосовместимость, обеспечивающая возможность выступить в роли носителя клеток, пластичность, механическая прочность, длительная скорость биодеградации и низкая токсичность продуктов собственной деградации. В силу всего вышеперечисленного мы остановили свой выбор на наиболее подходящих для этих целей полимерах – сополимере полигидроксибутирата с гидроксивалератом (ПГБВ) в поликапролактоне (ПКЛ).
Сополимер ПГБВ относится к группе полиоксиалканоатов, получаемых микробиологическим путем при бактериальной ферментации сахаров или липидов. В силу особенностей биосинтеза материалов этой группы существует возможность получения широкого спектра значений скорости деградации, достигающих 6 месяцев, и механических параметров, что позволяет применять полиоксиалканоаты в различных областях медицинской науки и практики [5]. Высокая биосовместимость ПГБВ обусловлена тем, что мономер (3-гидроксимасляная кислота), образующий данный полимер, – естественный метаболит клеток и тканей высших животных и человека [3]. Однако основным недостатком ПГБВ является жесткость и хрупкость, что обусловливает необходимость его использования в сочетании с другими полимерами.
В роли пластифицирующего полимера может выступить поликапролактон. В ряде работ доказана способность ПКЛ образовывать прочные и эластичные нити [7]. Этот полимер обладает малой скоростью гидролиза эфирной связи (до 3 лет) и способен обеспечить сохранность биодеградируемого каркаса до того момента, пока на его месте не сформируется собственный новый сосуд. Продукты гидролиза поликапролактона утилизируются макрофагами и глиальными клетками с возможным возникновением воспалительной реакции, однако в случае его совместного использования с более биосовместимыми полимерами эти недостатки можно нивелировать. В настоящее время существует ряд экспериментальных работ, доказывающих пригодность поликапролактона в качестве основы для создания сосудистых графтов [11].
На этапе экспериментальных разработок тканеинженерных конструкций широко используется применение мультипотентных мезенхимальных стромальных клеток, выступающих в качестве удобной модели для изучения биосовместимости in vitro, а также для оценки взаимодействия функционально активной клеточной линии с носителями из биодеградируемых полимеров. Мультипотентные мезенхимальные стромальные клетки костного мозга (ММСК КМ) способны секретировать как компоненты внеклеточного матрикса (фибронектин, коллаген, протеогликаны, ламинин) [8; 9; 10], так и комплекс цитокинов с противовоспалительным и антиапоптотическим действием и хемокинов, участвующих в поддержании гемопоэза (ИЛ 1, ИЛ 6, ИЛ 7, ИЛ 8, ИЛ 11, факторы роста стволовых клеток и гепатоцитов, макрофагальный, гранулоцитарно-макрофагальный) [6; 8; 12]. Известен хоминг-эффект ММСК КМ, реализующийся через выработку цитокина SDF-1 [10]. Поэтому в случае заселения поверхности биодеградируемого полимерного носителя функционально активными клетками необходимо иметь четкую уверенность, что культивирование подобных клеточных линий не сократит сроки биодеградации полимерного матрикса.
Цель исследования – изучить биосовместимость и сроки биодеградации матриксов на основе полигидроксибутирата с гидроксивалератом и поликапролактона, потенциально пригодных для создания каркаса сосудистого графта. Оценить влияние ММСК КМ, культивированных на поверхности матриксов, на изменение скорости биодеградации последних.
Материал и методы исследования
Двухмерные матриксы в виде пленок получали методом полива растворов полимеров в хлороформе на обезжиренную поверхность стекла. Использовали пленочные матриксы (ПМ) следующего состава: ПМ № 1 – композиция 5 % ПГБВ ММ 2307 кДa (производитель – институт биохимии и физиологии им. Г.К. Скрябина СО РАН (г. Пущино, Московская область) и 10 % ПКЛ ММ 80000 кДa (Sigma, США); ПМ № 2 – композиция 7,5 % ПГБВ и 10 % ПКЛ. Культуру ММСК КМ получали путем выделения костного мозга бедренных костей крыс линии Wistar. Культивирование клеток проводили при 37 °С и 5 % СО2 в среде DMEM, содержащей 1 % HEPES буфера, 10 % эмбриональной бычьей сыворотки, 1 % L-глутамина, 100 ед/мл пенициллина, 0,1 мкг/мл стрептомицина, 0,1 мкг/мл амфотерицина В. Фенотип каждого пассажа определяли методом проточной цитофлуориметрии с использованием моноклональных антител CD90, CD45, CD106 и CD11b, меченных флуорохромами. ММСК КМ 4 пассажа высевали на матрицы, расположенные в 6-луночных культуральных планшетах, в концентрации 4,1∙105 на лунку и культивировали в течение 7 дней. За сутки до окончания культивирования в две контрольные лунки с ПМ № 1 и № 2 добавляли флуорохром РКН26 с последующим подсчетом меченных ММСК КМ, видимых в десяти полях зрения микроскопа, усредненных и пересчитанных на единицу площади в 1 мм2. Детекцию жизнеспособности, апоптоза и некроза ММСК КМ до и после культивирования на матриксах различного состава, осуществляли методом проточной цитофлуориметрии с окрашиванием ММСК КМ красителем Annexin V, меченным РЕ, в комбинации с 7-AAD (BD Biosciences, США).
Эксперименты по имплантации проводили на 6-месячных крысах–самцах линии Wistar массой 300–350 грамм. Все манипуляции с животными проводили с учетом требований и принципов гуманного обращения с экспериментальными животными согласно приказу № 742 13.11.84 «Об утверждении правил проведения работ с использованием экпериментальных животных». Матриксы с клетками (опыт) и без них (контроль) имплантировали подкожно 90 крысам-самцам линии Wistar после предварительной наркотизации путем внутрибрюшинной инъекции тиопентала натрия из расчета 50 мг/кг. Выведение животных из эксперимента с оценкой гистологической картины осуществляли через 1, 2, 3, 4 недели в течение первого месяца после имплантации, а затем ежемесячно вплоть до 12 месяцев. Оценку гистологической картины проводили на световом микроскопе AXIO Imager A1 (Carl Zeiss, Германия) с предварительным окрашиванием образцов гематоксилин-эозином по общепринятой методике.
Экспрессию сосудисто-эндотелиального ростового фактора (VEGF), косвенно отражающего наличие жизнеспособного пула ММСК КМ в тканях после имплантации матриксов с данным типом клеток, оценивали с помощью иммунофлуоресцентного окрашивания замороженных срезов (толщина 14 мкм). Срезы предварительно фиксировали ацетоном. Окрашивание осуществляли поликлональными антителами кролика к VEGF крысы. В качестве вторичных антител использовали ослиные антитела против иммуноглобулинов кролика, конъюгированные с FITC (Millipore, США). Полученные препараты анализировали при помощи флюоресцентного микроскопа «Axio Imager.A1» (Carl Zeiss, Германия).
Результаты исследования и их обсуждение
Перед культивированием на матриксах количество жизнеспособных ММСК КМ 4 пассажа составило 99,6 %. При этом 89,3 % клеток были CD 90+, 45–, 106–, 11b–, что соответствовало общепринятому фенотипу ММСК. Количество клеток на ПМ № 1 и ПМ № 2 через 7 дней культивирования достоверно не различалось и соответствовало 361,3 ± 7,7 и 404,8 ± 5,5 кл/мм2.
При сравнении развития клеточного апоптоза и некроза среди ММСК КМ, культивированных в течение 7 дней на ПМ № 1 и ПМ № 2, оказалось, что введение большей доли ПГБВ в сополимерную композицию увеличивало относительное число жизнеспособных клеток (таблица). В сравнении с результатами тестирования матрикса из чистого 10 % ПКЛ [1] видно, что относительное количество жизнеспособных ММСК КМ при введении в состав ПКЛ полигидроскибутирата с гидроксивалератом возросло в 1,7 раза, а относительное число ММСК КМ в состоянии раннего апоптоза сократилось более чем в 2 раза (р < 0,05). Следовательно, введение ПГБВ в состав ПКЛ значительно повысило биосовместимость сополимерных матриксов.
При изучении гистологической картины выявлено, что воспалительная реакция в тканях вокруг имплантированных сополимерных матриксов № 1 и № 2 без клеток однотипна, проявлялась в виде умеренной и очаговой лимфо-гистиоцитарной инфильтрации и сохранялась в течение 1 месяца. Однако частота встречаемости воспалительной реакции в тканях вокруг ПМ № 1 в 2 раза превосходила таковую в случае с ПМ № 2 (66,7 % против 33,3 %; р < 0,05). Следовательно, биосовместимость матриксов in vivo выше у образцов, содержащих в своем составе 7,5 % ПГБВ.
Относительное число ММСК жизнеспособных, в апоптозе и некрозе после 7 дней культивирования на пленочных матриксах
|
Пленочный матрикс |
Процентное соотношение ММСК КМ, снятых с поверхностей матриксов различного состава |
|||
|
живые, % |
ранний апоптоз, % |
поздний апоптоз, % |
некроз, % |
|
|
ПМ № 1 |
72,5 |
25,3 |
1,9 |
0,3 |
|
ПМ № 2 |
73,2 |
24,8 |
1,6 |
0,4 |
|
ПКЛ [1] |
43,7 |
54,4 |
1,3 |
0,5 |
При изучении частоты воспалительной реакции со стороны окружающих тканей вокруг ПМ № 1 и № 2 с ММСК КМ выявлено, что воспалительные изменения в тканях нивелировались в 2 раза быстрее, чем вокруг образцов без клеток (14 дней против 1 месяца, р < 0,05), что косвенно подтвердило противовоспалительное влияние ММСК КМ. При этом начало резорбции клеточных матриксов № 1 и № 2 началось на 1 месяц позже, чем бесклеточных.
Так, биодеградация ПМ № 2 (с 7,5 % включением ПГБВ) (рис. 1) без клеток началась через 1 месяц после подкожной имплантации, о чем свидетельствовало появление многокамерных фиброзных капсул с расположенным внутри полимером и образование внутри капсул фиброзно-коллагеновых перемычек, подтверждавших образование микроэрозий на поверхности имплантированных матриксов.
При этом признаки резорбции подобного матрикса с ММСК КМ обнаружены на 1 месяц позже, т.е. через 2 месяца подкожной имплантации. Следует отметить, что распад полимерных матриксов на основе 7,5 % ПГБВ и 10 % ПКЛ в течение 7 месяцев эксперимента выявлялся только микроскопически, тогда как визуально нарушение целостности матриксов без клеток было отмечено спустя 8 месяцев эксперимента.
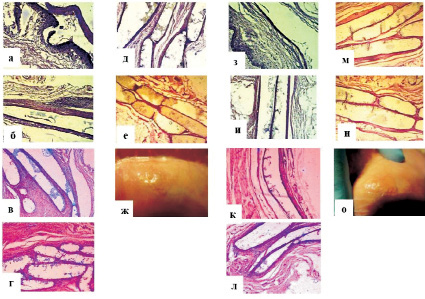
Рис. 1. Динамика биодеградации бесклеточных и клеточных матриксов на основе 7,5 % ПГБВ и 10 % ПКЛ (ув. х 100; окраска гематоксилин-эозином):а – инфильтрация тканей и формирование капсулы вокруг бесклеточного ПМ № 2 через 2 недели подкожной имплантации; б – инкапсулирование бесклеточного ПМ № 2 через 1 месяц имплантации; в – формирование многокамерной фиброзной капсулы вокруг бесклеточного ПМ № 2 через 2 месяца имплантации; г – многокамерная фиброзная капсула вокруг бесклеточного ПМ № 2 через 4 месяца имплантации; д – многокамерная фиброзная капсула вокруг бесклеточного ПМ № 2 через 6 месяцев имплантации; е – инкапсулирование фрагментов бесклеточного ПМ № 2 в многокамерной фиброзной капсуле через 8 месяцев имплантации; ж – фрагментирование поверхности бесклеточного ПМ № 2 через 8 месяцев имплантации на макропрепаратах; з – инфильтрация тканей и формирование капсулы вокруг ПМ № 2 с ММСК КМ через 2 недели подкожной имплантации; и –инкапсулирование ПМ № 2 с ММСК КМ через 1 месяц имплантации; к – начало формирования многокамерной капсулы вокруг ПМ № 2 с ММСК КМ через 2 месяца имплантации; л – формирование многокамерной фиброзной капсулы вокруг ПМ № 2 с ММСК КМ через 4 месяца имплантации; м – многокамерная фиброзная капсула вокруг ПМ № 2 с ММСК КМ через 6 месяцев имплантации; н – многокамерная фиброзная капсула вокруг ПМ № 2 с ММСК КМ через 8 месяцев имплантации; о – фрагментирование поверхности ПМ № 2 с ММСК КМ через 8 месяцев имплантации на макропрепаратах
Введение меньшей доли ПГБВ в ПМ № 1 (рис. 2) значимо продлило скорость резорбции данных образцов.
Микроскопические признаки медленной биодеградации бесклеточных матриксов с 5 % включением ПГБВ начали появляться лишь через 3 месяца после подкожной имплантации, на что указывало появление многокамерной тонкостенной полости, в которой располагался матрикс, и отсутствие внутри полости фиброзно-коллагеновых перемычек, свидетельствовавших об отсутствии эрозий на поверхности сополимерных образцов. Наличие ММСК КМ на ПМ № 1 также отсрочило начало резорбции на 1 месяц, которая визуализировалась микроскопически через 4 месяца имплантации. В последующие сроки и вплоть до 12 месяцев эксперимента медленная биодеградация клеточных и бесклеточных образцов ПМ № 1 не привела к макроскопическим изменениям целостности поверхности матриксов и выявлена лишь микроскопически.
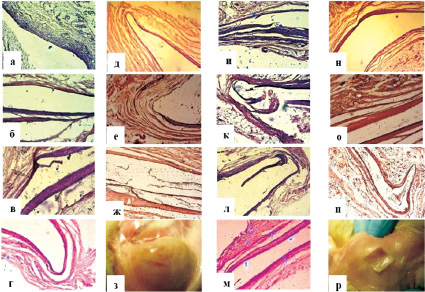
Рис. 2. Динамика биодеградации бесклеточных и клеточных матриксов на основе 5 % ПГБВ и 10 % ПКЛ (ув. х 100; окраска гематоксилин-эозином):а – инфильтрация тканей и формирование капсулы вокруг бесклеточного ПМ № 1 через 2 недели подкожной имплантации; б – инкапсулирование бесклеточного ПМ № 1 через 1 месяц имплантации; в – формирование однокамерной фиброзной капсулы вокруг бесклеточного ПМ № 1 через 2 месяца имплантации; г – начало формирования многокамерности фиброзной капсулы вокруг бесклеточного ПМ № 1 через 4 месяца имплантации; д – отсутствие динамики в формировании многокамерной фиброзной капсулы вокруг бесклеточного ПМ № 1 через 6 месяцев имплантации; е – продолжение медленного формирования многокамерной фиброзной капсулы вокруг бесклеточного ПМ № 1 через 8 месяцев имплантации; ж – бесклеточный ПМ № 1 через 12 месяцев имплантации – картина, аналогичная периоду в 8 месяцев; з – целостность поверхности бесклеточного ПМ № 1 на макропрепаратах через 12 месяцев имплантации; и – инфильтрация тканей и формирование капсулы вокруг ПМ № 1 с ММСК КМ через 2 недели подкожной имплантации; к – инкапсулирование ПМ № 1 с ММСК КМ через 1 месяц имплантации; л – образование однокамерной фиброзной капсулы вокруг ПМ № 1 с ММСК КМ через 2 месяца имплантации; м – однокамерная фиброзная капсула вокруг ПМ № 1 с ММСК КМ через 4 месяца имплантации; н – начало формирования многокамерной фиброзной капсулы вокруг ПМ № 1 с ММСК КМ через 6 месяцев имплантации; о – продолжение медленного формирования многокамерной фиброзной капсулы вокруг ПМ № 1 с ММСК КМ через 8 месяцев имплантации; п – 12 месяцев подкожной имплантации ПМ № 1 с ММСК КМ – отсутствие явной динамики в сравнении с 8 месяцами; р – целостность поверхности ПМ № 1 с ММСК КМ на макропрепаратах через 12 месяцев имплантации
Известно, что только жизнеспособный клеточный пул способен оказывать на окружающие ткани полноценный паракринный эффект. Косвенным отображением жизнеспособности и длительности пребывания ММСК КМ на матриксах может явиться определение в тканях, окружающих матриксы с клетками, сосудистого эндотелиального фактора роста (VEGF), выделяемого ММСК КМ. Наряду с этим общеизвестным является факт, что макрофаги и фибробласты, в том числе участвующие в инкапсулировании и резорбции полимеров, также обладают способностью синтезировать VEGF [2]. Однако в нашем эксперименте пик образования многокамерных капсул и распад матриксов за счет массивной миграции клеток моноцитарно-макрофагальной системы в зону имплантации выявлены спустя 4 месяца. При этом пик экспрессии VEGF в окружающих матриксы тканях пришелся на первые 3–4 месяца эксперимента. Поэтому полученная динамика VEGF и нивелирование разницы в сроках биорезорбции клеточных и бесклеточных матриксов к концу эксперимента позволили нам считать оправданной использование VEGF для оценки жизнеспособности ММСК КМ на матриксах после имплантации. Нами отмечено, что максимальная экспрессия данного ростового фактора наблюдалась в течение первого месяца подкожной имплантации матриксов с клетками с заметным снижением в последующие периоды (рис. 3). К концу 4 месяца достоверной разницы в окрашивании флуоресцентным красителем на VEGF тканей вокруг клеточных и бесклеточных матриксов не зафиксировано.
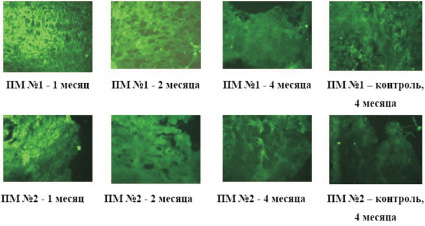
Рис. 3. Внутритканевая экспрессия VEGF вокруг пленочных матриксов с ММСК КМ в сравнении с контролем (матриксы без клеток) в различные временные интервалы подкожной имплантации (ув. ×200)
Таким образом, в хроническом 12-месячном эксперименте наряду с оценкой динамики формирования фиброзно-коллагеновых капсул вокруг имплантированных подкожно пленочных матриксов нами выявлен краткосрочный воспалительный ответ в течение первого месяца, что является обязательным первичным ответом организма на любой раздражитель, включая чужеродный материал [4]. При этом через 1 месяц лимфогистиоцитарная инфильтрация сводилась к минимуму, а стенка формируемых капсул состояла в основном из фибробластоподобных клеток и коллагеновых волокон. В дальнейшие сроки мы наблюдали продолжение формирования капсул вокруг ПМ № 2 и № 1 с тенденцией образования многокамерных капсул через 1–3 месяца вокруг бесклеточных матриксов и 2–4 месяца при имплантации клеточных матриксов. Макрофаги с определяемым внутри фагоцитированным полимером располагались, как правило, у внутренней стенки капсулы рядом с сополимерной пленкой и не участвовали в инфильтрировании стенок капсулы и прилежащих тканей. Таким образом, распад матриксов не приводил к поддержанию хронического воспаления в окружающих тканях и, следовательно, не оказывал отрицательного эффекта на функции последних. Нами отмечено, что увеличение на 2,5 % доли ПГБВ в составе матриксов на основе ПГБВ и ПКЛ способствовало укорочению сроков биодеградации сополимерных образцов на 4 месяца, что является нежелательным в случае создания сосудистого импланта на основе данной композиции полимеров. ММСК КМ сохраняли жизнеспособность на матриксах в течение первых 4 месяцев, повысив биологическую инертность сополимерных композиций на ранних сроках имплантации.
Выводы
1. Наиболее подходящей для создания каркаса гибридного сосудистого графта является композиция 5 % ПГБВ + 10 % ПКЛ, обладающая высокой биосовместимостью in vitro и in vivo и продолжительным сроком биодеградации, превышающим 12 месяцев.
2. Заселение поверхности сополимерных матриксов мультипотентными мезенхимальными стромальными клетками костного мозга, обладающими противовоспалительным и антиапоптотическим потенциалом, повышает биосовместимость сополимерных конструкций и не сокращает срок биорезорбции последних.
Рецензенты:
Лисаченко Г.В., д.м.н., профессор, зав. кафедрой патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия Минздравсоцразвития России», г. Кемерово;
Будаев А.В., д.м.н., профессор кафедры патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия Минздравсоцразвития России»,г. Кемерово.
Работа поступила в редакцию 08.05.2013.



