Материалы и методы исследования
Щёлочи взаимодействуют с оксидом кремния и силикатами, переводя кремний в растворимые соединения. Соединения кремния являются примесями в железных рудах всех месторождений, поэтому одним из способов химического обогащения железных руд является их обработка растворами щелочей [4]. Обогащение железных руд с помощью щелочей было исследовано в Болгарии [5], России [2], США [7]. Франции [6]. Результаты этих исследований свидетельствуют о том, что большое значение имеет выбор объекта исследования, щелочи и её концентрации, а также температуры.
В нашей работе в качестве объекта исследования использовался рядовой криворожский концентрат следующего состава ( %): Fe2O3 – 92,5, SiO2 – 4,31, Al2O3 – 0,76, CaO – 0,38, MgO – 0,020, TiO2 – 1,81, сера – 0,051, фосфор – 0,042.
Обработка концентрата растворами гидроксида натрия проводилась в стальных открытых реакторах ёмкостью 25 мл. Размеры реакторов соответствовали размерам гнёзд центрифуги, поскольку после опыта проводилось центрифугирование. Порция руды массой 50 г помещалась в реактор, который прогревался в электрической печи до заданной температуры. Во время разогрева реактора готовился раствор щёлочи определённой концентрации, который в платиновой чашке подогревался на электроплите до той же температуры. Нагретый раствор щёлочи вливался в реактор с концентратом, и с этого момента начинается отсчёт времени. Температура в электропечи во время процесса выщелачивания поддерживалась постоянной точностью ±2 °С. Через определённое время реактор вынимался из печи и центрифугировался. Раствор сливался в мерную колбу, а обработанный концентрат подвергался трёхкратной промывке нагретой дистиллированной водой, и промывные воды приливались к основному раствору, в котором определялось содержание кремния.
Для определение кремния использовался широко распространенный фотометрический метод [1], основанный на образовании кремнемолибденового комплексного соединения при взаимодействии кремниевой кислоты с молибдатом аммония в кислом растворе:
H2SiO3 + 12(NH4)2MoO4 + 12H2SO4 = H4[Si(Mo3O10)4]·2H2O + 12(NH4)2SO4 + 9H2O.
Можно измерять оптическую плотность растворов получаемого по этой реакции желтого кремнемолибденового соединения H4[Si(Mo3O10)4]·2H2O, но более целесообразно его восстановление c получением кремнемолибденовой «сини»:
H4[Si(Mo3O10)4] + 4FeSO4 + 2H2SO4 = H8[(Mo2O5)Si(Mo2O7)5] + 2Fe2(SO4)3.
Колориметрирование «сини» в сравнении с колориметрированием желтого комплекса является более чувствительным методом. Это объясняется тем, что максимум поглощения света желтым комплексом находится при 352 ммк, то есть в той области, где сказывается поглощение света свободным молибдатом аммония (он является реактивом и присутствует в растворе в значительном избытке), спектр поглощения которого представляет собой широкую полосу, растущую от 360 ммк к ультрафиолетовой области [1]. Поэтому желтый комплекс колориметрируют при 400 ммк, то есть идут на снижение чувствительности.
Максимум поглощения молибденовой «сини» находится при 815 ммк, а минимум – при 420 ммк, и колориметрирование можно вести как при 815 ммк, так и при 650 ммк – при обоих значениях оптическая плотность пропорциональна концентрации кремния [3]. Благодаря поглощению в красной области, присутствие молибдата аммония не сказывается, и чувствительность метода возрастает в 25 раз по сравнению с анализом желтого комплекса [1].
«Синие» молибденовые комплексы удобно применять при анализе растворов, содержащих железо, так как соли железа сильно поглощают свет в ближней ультрафиолетовой области и частично в видимой части спектра. Поэтому определение кремния в виде желтых комплексов в присутствии растворённых солей железа затруднительно, тогда как на поглощение «сини» в красной и инфракрасной частях спектра полоса железа не накладывается. По этой причине восстановление желтого комплекса можно проводить сульфатом двухвалентного железа. Следует иметь в виду, что для кремнемолибденовых комплексных кислот (как желтых, так и синих) характерна большая устойчивость в сильнокислой среде.
Результаты исследования и их обсуждение
Предварительные опыты были проведены с целью нахождения оптимального размера частиц рудного концентрата, соотношения массы раствора и концентрата (соотношения Ж:Т) и наилучшего выщелачивающего реагента. Поэтому было проведено три серии опытов, в каждой из них изменялся лишь один параметр, остальные поддерживались постоянными.
Для проведения первой серии опытов, в которой изменялся размер частиц (фракционный состав) руды, исходный концентрат был рассеян на шесть фракций, и в каждой из них было определено содержание кремния. Результаты этой серии опытов приведены в табл. 1.
Таблица 1
Зависимость степени извлечения кремния из руды в раствор от размера частиц руды. Постоянные условия: Т = 100 °C, ω(NaOH) = 40 %, Ж:Т = 10:1, t = 3 ч
|
Размер частиц руды, мм |
Содержание SiO2 в данной фракции, % |
Номер опыта |
Степень извлечения кремния (SiO2) из руды в раствор a, % |
|||
|
В опытах без перемешивания: |
В опытах с перемешиванием: |
|||||
|
в каждом опыте |
среднее |
в каждом опыте |
среднее |
|||
|
< 0,075 |
3,82 |
1 2 3 |
20,3 21,0 19,5 |
20,3 |
23,0 23,3 22,5 |
22,9 |
|
0,075–0,15 |
3,75 |
4 5 6 |
19,0 21,0 20,3 |
20,1 |
27,8 23,0 26,6 |
26,3 |
|
0,15–0,25 |
3,55 |
7 8 9 |
22,2 18,2 19,9 |
20,1 |
25,5 23,4 25,0 |
24,6 |
|
0,25–0,5 |
3,95 |
10 11 12 |
22,4 21,6 18,0 |
19,0 |
22,7 23,0 23,0 |
22,9 |
|
0,5–1,0 |
4,35 |
13 14 15 |
17,5 16,7 19,5 |
17,9 |
21,3 19,6 20,1 |
20,3 |
|
1,0–2,0 |
4,85 |
16 17 18 |
13,5 14,5 14,0 |
14,4 |
18,0 17,5 18,6 |
18,0 |
Из табл. 1 видно, что степень извлечения кремния в опытах без перемешивания тем больше, чем меньше размер частиц руды. В опытах с перемешиванием степень извлечения на несколько процентов выше, и максимум извлечения (26,3 %) наблюдается при размерах частиц 0,075–0,15 мм. Поэтому дальнейшие опыты проводились только с этой фракцией.
Опыты по изучению зависимости степени извлечения кремния от соотношения Ж:Т проводились без перемешивания пульпы при 100 °C и концентрации щёлочи 40 %. За 3 ч выщелачивается 9,2 % кремния при Ж:Т, равном 2:1, 15,4 % – при Ж:Т, равном 5:1, 20,3 % – при Ж:Т, равном 10:1 и 20,8 % – при Ж:Т, равном 20:1. Таким образом, прирост извлечения (∆a) при переходе Ж:Т от 2:1 к 5:1 составляет 6,2 %, а при переходе от 5:1 к 10:1 – 4,9 %. Но дальнейшее увеличение избытка щёлочи даёт незначительный эффект, поэтому дальнейшие опыты проводились при Ж:Т, равном десяти.
В опытах по определению зависимости степени извлечения кремния от природы реагента были испытаны вода и растворы карбоната натрия, гидроксида калия и гидроксида натрия. Результаты этих опытов приведены в табл. 2.
Таблица 2
Степень извлечения кремния из руды в раствор при применении различных реагентов. Постоянные условия: размер частиц руды 0,075–0,15 мм; Т = 100 °C; Ж:Т = 10:1; ω = 40 %; t = 3 ч
|
Реагент |
Массовая доля реагента в растворе w, % |
Степень извлечения кремния (SiO2) a, % |
|||
|
опыт 1 |
опыт 2 |
опыт 3 |
средняя |
||
|
NaOH |
40 |
19,0 |
21,0 |
20,3 |
20,1 |
|
KOH |
40 |
10,5 |
12,6 |
9,8 |
10,6 |
|
Na2CO3 |
40 |
1,9 |
1,9 |
1,9 |
1,9 |
|
H2O |
– |
1,4 |
0,9 |
1,3 |
1,2 |
Из полученных результатов следует, что по эффективности выщелачивания кремния изученные реагенты располагаются в ряд NaOH > KOH > Na2CO3 > H2O, а их выщелачивающее действие приблизительно соответствует соотношению 20:10:2:1. Самый эффективный реагент – гидроксид натрия, поэтому в дальнейших опытах использовались растворы только этой щёлочи. В этих опытах изучалось влияние концентрации гидроксида натрия и температуры на степень выщелачивания кремния.
Гидроксид натрия – самая распространённая щёлочь, получаемая в химической промышленности. Температура кипения растворов этой щелочи (°С) повышается при увеличении концентрации и равна (°С): при 10 % – 103,4, 20 % – 108,1, 30 % – 119,0, 40 % – 131,4, 50 % – 142,5. Следовательно, при использовании растворов высокой концентрации можно проводить выщелачивание при атмосферном давлении при температурах до 140 °С.
Влияние концентрации гидроксида натрия
Влияние концентрации гидроксида натрия на степень выщелачивания кремния изучалось в интервале 10–50 % при постоянной температуре 100 °C и постоянном соотношении Ж:Т, равном 10:1. Полученные результаты приведены в табл. 3 и на рисунках в координатах степень выщелачивания a–время t (рис. 1) и скорость выщелачивания ∆a ̸∆t–t (рис. 2).
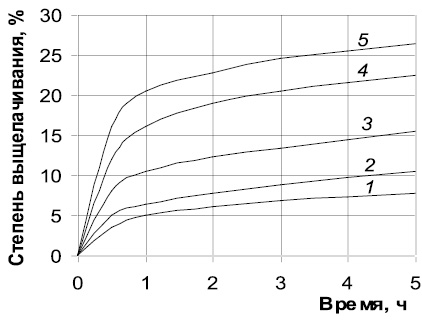
Рис. 1. Выщелачивание кремния из криворожского концентрата при 100 °С раствором гидроксида натрия с массовой долей 10 % (1), 20 % (2), 30 % (3), 40 % (4) и 50 % (5)
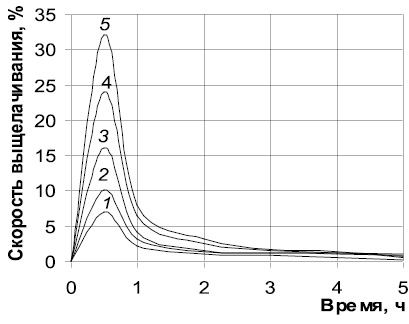
Рис. 2. Скорость выщелачивания кремния из криворожского концентрата при 100 °С раствором гидроксида натрия с массовой долей 10 % (1), 20 % (2), 30 % (3),40 % (4) и 50 % (5)
Таблица 3
Степень выщелачивания кремния и скорость процесса при различных концентрациях гидроксида натрия. Постоянные условия: размер частиц руды 0,075–0,15 мм; Т = 100 °C; Ж:Т = 10:1
|
Массовая доля NaOH, % |
Время выщелачивания, ч |
Концентрация SiO2 в растворе, г/л |
Степень выщелачивания кремния, % |
Скорость выщелачивания, ∆a ̸∆t |
|
10 |
0,5 1,0 2,0 3,0 4,0 5,0 |
0,12 0,18 0,21 0,24 0,26 0,28 |
3,5 5,0 6,0 6,8 7,3 7,7 |
7,0 3,0 1,0 0,8 0,5 0,4 |
|
20 |
0,5 1,0 2,0 3,0 4,0 5,0 |
0,18 0,23 0,28 0,31 0,35 0,38 |
5,0 6,4 7,7 8,8 9,7 10,5 |
10,0 2,8 1,3 1,1 0,9 0,8 |
|
30 |
0,5 1,0 2,0 3,0 4,0 5,0 |
0,29 0,34 0,38 0,43 0,48 0,50 |
8,0 10,5 12,2 13,3 14,4 15,4 |
16,0 5,0 1,7 1,1 1,1 1,0 |
|
40 |
0,5 1,0 2,0 3,0 4,0 5,0 |
0,43 0,57 0,67 0,74 0,77 0,81 |
12,0 16,0 18,9 20,4 21,5 22,5 |
24,0 8,0 2,9 1,5 1,1 1,0 |
|
50 |
0,5 1,0 2,0 3,0 4,0 5,0 |
0,57 0,70 0,81 0,88 0,92 0,94 |
16,0 20,4 22,8 24,5 25,4 26,4 |
32,0 8,8 2,4 1,7 0,9 1,0 |
Опытные данные, приведенные в табл. 3, свидетельствуют о том, что с повышением концентрации гидроксида натрия степень выщелачивания кремния из руды в раствор увеличивается. Так, если при массовой доле щёлочи 10 % степень выщелачивания за 5 ч составляет лишь 7,7 %, то при массовой доле 50 % она достигает 26,4 %.
При одной и той же концентрации степень выщелачивания возрастает с увеличением времени процесса, но из рис. 1 видно, что быстрое увеличение a в начале опыта сменяется затем медленным ростом этой величины. Кинетика выщелачивания наглядно иллюстрируется в координатах: скорость выщелачивания ∆a∆t – время t (рис. 2). Для всех концентраций высокая скорость выщелачивания наблюдается в первые 30 мин, но в дальнейшем она уменьшается и после 3 ч становится крайне низкой и практически одинаковой для всех концентраций. Максимальная степень извлечения кремния, достигнутая в этой серии опытов, составляет 26,4 % при концентрации гидроксида натрия 50 % и времени выщелачивания 5 ч.
Влияние температуры
Влияние температуры изучено в интервале 80–125 °C при концентрации гидроксида натрия 40 % и Ж:Т, равном 10:1. Опыты проведены вначале без перемешивания, а затем повторены с перемешиванием. Полученные результаты приведены в табл. 4.
Из таблицы видно, что повышение температуры приводит к увеличению степени выщелачивания кремния: при 80 °C она составляет 18,0 % за 5 ч, а при 125 °C – 35,0 %. Применение перемешивания приводит к дополнительному выщелачиванию кремния. Максимальный показатель в этой серии опытов составляет 41,0 % при температуре 125 °C и времени выщелачивания 5 ч.
Графические зависимости степени и скорости выщелачивания от времени имеют такой же вид, что и в предыдущей серии опытов, поэтому они не приводятся.
Таблица 4
Степень выщелачивания кремния и скорость процесса при различных температурах. Постоянные условия: размер частиц руды 0,075–0,15 мм; ω(NaOH) = 40 %; Ж:Т = 10:1
|
Температура, °C |
Время выщелачивания, ч |
Опыты без перемешивания |
Опыты с перемешиванием |
||
|
Степень выщелачивания, % |
Скорость процесса, ∆a∆t |
Степень выщелачивания, % |
Скорость процесса, ∆a∆t |
||
|
80 |
0,5 1,0 2,0 3,0 4,0 5,0 |
8.0 11,6 14,3 15,9 17,1 18,0 |
16,0 7,2 2,7 1,6 1,2 0,9 |
10,0 13,8 16,5 18,1 19,0 19,6 |
20,0 7,6 2,7 1,6 0,9 0,6 |
|
100 |
0,5 1,0 2,0 3,0 4,0 5,0 |
11,5 15,6 18,9 20,4 21,5 22,5 |
23,0 8,2 3,3 3,0 1,1 1,0 |
15,2 21,0 25,1 27,4 28,7 29,5 |
30,4 11,6 4,1 2,3 1,3 0,8 |
|
115 |
0,5 1,0 2,0 3,0 4,0 5,0 |
13,4 19,2 22,6 24,5 26,0 27,6 |
26,8 11,6 3,4 1,9 1,5 1,6 |
19,0 24,8 29,3 31,6 33,0 34,4 |
38,0 11,6 4,5 2,3 1,4 1,4 |
|
125 |
0,5 1,0 2,0 3,0 4,0 5,0 |
16,8 22,7 27,5 30,5 32,7 34,8 |
33,6 11,8 4,8 3,0 2,2 1,8 |
22,8 29,5 35,1 38,0 39,7 41,0 |
45,8 13,4 5,6 4,9 1,7 1,3 |
Максимальное выщелачивание кремния
Поскольку повышение концентрации щёлочи и температуры приводит к увеличению степени выщелачивания, то были проведены опыты по обработке концентрата 50 %-м раствором гидроксида натрия при температуре 140 °C (температура кипения этого раствора равна 142,5 °C) с применением перемешивания. Получены следующие результаты.
Таблица 5
|
Время выщелачивания (ч): |
0,5 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
|
Содержание SiO2 в растворе (г/л): |
0,89 |
1,20 |
1,53 |
1,67 |
1,76 |
1,82 |
|
Степень выщелачивания SiO2 (%): |
27,5 |
33,5 |
42,0 |
47,0 |
49,2 |
50,6 |
Видно, что в этих опытах достигнуто выщелачивание 50,6 % кремния. С целью достижения ещё большей очистки были проведены опыты по многократной обработке одной и той же порции концентрата свежими порциями 50 %-го раствора щёлочи при 140 °C. Но повторная обработка не даёт существенного результата: если при первой обработке извлекается 50,6 % кремния, то после второй обработки свежим раствором щёлочи также в течение 5 ч степень выщелачивания кремния достигает 56,1 % (прирост 5,5 %), а после третьей обработки – 57,3 % (прирост 1,2 %). Исходя из этого, применение многократной обработки свежими порциями раствора щёлочи нецелесообразно.
Вывод
Обработка рядового криворожского концентрата растворами гидроксида натрия с массовой долей NaOH от 10 до 50 % при температурах от 80 до 140 °C, которые возможны при атмосферном давлении, обеспечивает выщелачивание до 50 % примесей кремния, но этого недостаточно для получения сверхчистого железорудного концентрата. Поэтому необходимо продолжение исследований при более высоких температурах, достижение которых возможно при использовании специальных химических реакторов – автоклавов.
Рецензенты:
Ерёмин Л.П., д.х.н., профессор кафедры неорганической химии Томского государственного педагогического университета, г. Томск;
Коробочкин В.В., д.т.н., профессор, заведующий кафедрой общей химической технологии Национального исследовательского Томского политехнического университета, г. Томск.
Работа поступила в редакцию 11.04.2013.



