Поиск новых лекарственных препаратов с нейротропной активностью привел к открытию нового ряда биологически активных веществ (БАВ) – гидразидов фосфорилированных уксусных кислот. Ранее сотрудниками кафедры фармакологии ГБОУ ВПО «КГМУ МЗ РФ» было установлено, что данные БАВ проявляют выраженные психотропные свойства, обладают антигипоксической активностью, улучшают процессы восприятия и запоминания, обладают низкой токсичностью и не проявляют антихолинэстеразной активности [7, 8].
Одним из наиболее активных представителей этого ряда является натриевая соль ацетилгидразино-4-хлорфенилфосфиновой кислоты (Na-CPAH), синтезированная на кафедре органической химии ГБОУ ВПО КНИТУ. В предыдущих работах мы установили, что исследуемое БАВ обладает выраженной антидепрессивной активностью и способностью положительно влиять на процессы обучения и памяти [6], а также разработали оптимальные методики качественного и количественного анализа Na-CPAH [5].
Важной задачей фармацевтического анализа является определение содержания посторонних примесей в лекарственных препаратах. В этой связи представляло интерес провести экспериментальную работу по выбору условий определения посторонних примесей в Na-CPAH. [1].
Целью настоящей работы является разработка методик определения доброкачественности субстанции Na-CPAH, необходимых для оценки качества данного лекарственного вещества с целью ее стандартизации.
Объектом исследования является субстанция БАВ Na-CPAH, физико-химичекие свойства которого нами были ранее изучены [5]. В качестве обязательных параметров доброкачественности ГФ регламентирует включать в ФС следующие разделы: «прозрачность раствора», «цветность раствора», «рН», «посторонние примеси», «потеря в массе при высушивании», «хлориды», «сульфаты», «сульфатная зола и тяжелые металлы», «мышьяк» и т.д. [2, 3].
Параметр «прозрачность раствора» определяли путем визуального сравнения одинакового объема испытуемой жидкости с эталоном I при освещении электрической лампы матового стекла мощностью 40 Вт, расположенной над образцом, просматривая растворы перпендикулярно вертикальной оси пробирок на черном фоне через 5 мин после приготовления эталона. Опалесценция анализируемого раствора не должна превышать опалесценцию эталона.
Прозрачность раствора. 0,1 г субстанции растворяют в 10 мл свежепрокипяченной и охлажденной воды. Полученный раствор должен быть прозрачным или выдерживать сравнение с эталоном I.
Цветность раствора определяли по стандартам для бесцветных жидкостей – раствор анализируемого вещества должен выдерживать сравнение с эталоном В9. Сравнивали окраску в отраженном свете на матово-белом фоне.
Цветность раствора. Окраска раствора, полученного в испытании на прозрачность раствора, должна быть бесцветной или выдерживать сравнение с эталоном B9.
Посторонние примеси. Хроматографические методы анализа примесей в препаратах являются наиболее чувствительными и избирательными, позволяющими определить чистоту лекарственного вещества.
Синтез натриевой соли ацетилгидразино-4-хлорфенилфосфиновой кислоты состоит из трех стадий [6].
I стадия.
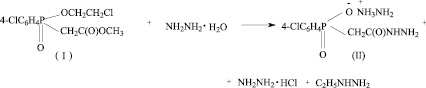
II стадия.
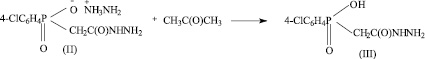
III стадия.
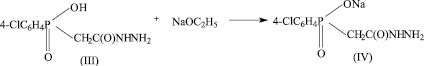
Одной из возможных примесей является промежуточный продукт синтеза ацетилгидразино-4-хлорфенилфосфиновая кислота (III) (HO-CPAH). Нами предложена методика определения чистоты БАВ Na-CPAH методом ТСХ. Были проведены экспериментальные исследования по параметрам методики, приведенным ниже.
Для хроматографирования выбраны пластины Sorbfil (10×15 см), марка ПТСХ-АФ-А-УФ, аналитические (ТУ 26-11-17-89), на алюминиевой подложке.
В качестве стандартного образца вещества свидетеля (СОВС) использовалась ацетилгидразино-4-хлорфенилфосфиновая кислота (чистота 100 %), полученная в лаборатории органического синтеза КНИТУ. Данное соединение было охарактеризовано с помощью спектральных методов анализа в инфракрасной и ультрафиолетовой областях.
Чувствительностью обнаружения примеси 0,25 мкг.
Определен способ детектирования – в ультрафиолетовом свете при 254 нм.
Предварительно изучена хроматографическая подвижность Na-CPAH и его возможных примесей в нижеприведенных системах растворителей, рекомендованных для фосфорорганических соединений [4]:
1. Хлороформ:ацетон:этанол (6:6:1).
2. Хлороформ:ацетон (1:1).
3. Хлороформ:этанол:аммиак (15:35:1).
4. Хлороформ:ацетон:этанол:вода (24:4:4:1).
5. Ацетон:этанол:аммиак (10:10:0,5).
6. Хлороформ:ацетон:этанол (9:3:1).
7. Бензол:этанол (9:1).
8. Этанол:бензол:аммиак (30:20:1).
9. Этанол:хлороформ:NaOH (80:20:5).
Изучена возможность использования в качестве подвижной фазы воды, ацетона, хлороформа, спирта этилового, эфира, раствора аммиака, а также смесей указанных растворителей.
Для наиболее эффективного анализа веществ нами было проведено изучение оптимального количества наносимого вещества и его примеси. С этой целью наносили на линию старта хроматографических пластинок вещества в количестве 5, 10, 50, 100 и 200 мкг/мл.
На линию старта хроматографической пластинки «Sorbfil» наносили 100 мкг/мл водного раствора исследуемого БАВ и 0,5 мкг/мл его возможной примеси (HO-CPAH), хроматографирование осуществляли восходящим способом.
На основании результатов проведенных исследований для определения примесей в субстанции Na-CPAH выбрана система растворителей – этанол:хлороформ:аммиака раствор концентрированный 25 % (80:20:5), в которой пятна изучаемой субстанции БАВ и примеси HO-CPAH (Rf 0,58 и 0,42 соответственно) компактны, имеют четкие границы и достаточную степень разделения.
Проверка пригодности хроматографической системы проводится по хроматограмме образца субстанции, содержащего известное количество примеси: пятна должны быть четко видны на хроматограмме и разделяться между собой (рис. 1).
Ацетилгидразино-4-хлорфенилфосфиновая кислота – посторонняя примесь БАВ Na-CPAH ‒ была обнаружена лишь в одной из пяти серий субстанции (рис. 2).
Посторонние примеси. Определение проводят методом ТСХ.
Испытуемый раствор: 0,1 г субстанции растворяют в 10 мл воды очищенной.
На линию старта пластинки «Sorbfil» (10×15 см) наносят 10 мкл (100 мкг) испытуемого раствора и раствор СОВС, содержащий 0,5 мкг примеси. Пластинку с нанесенными пробами сушат на воздухе, помещают в камеру со смесью этанол:хлороформ:аммиака раствор концентрированный 25 % (80:20:5) и хроматографируют восходящим методом. Когда фронт подвижной фазы дойдет до конца пластинки, ее вынимают из камеры, сушат на воздухе и просматривают в УФ-свете при 254 нм. Пятно посторонней примеси на хроматограмме испытуемого раствора по совокупности величины и интенсивности поглощения не должно превышать пятно на хроматограмме раствора сравнения (не более 0,5 %).

Рис. 1. Хроматограмма проверки пригодности хроматографической системы. Условные обозначения:  и
и  – Na-CPAH;
– Na-CPAH; и
и  – HO-CPAH
– HO-CPAH
Потерю в массе при высушивании для изучаемой субстанции предлагается определять при температуре 100–105 °С. Субстанцию высушивали до постоянной массы.
Потеря в массе при высушивании. Около 0,5 г (точная навеска) субстанции сушат при температуре от 100 до 105 °С до постоянной массы. Потеря в массе не должна превышать 0,5 %.
Рис. 2. Хроматограмма определения посторонних примесей в субстанции Na-CPAH
Содержание хлоридов в анализируемом БАВ определяли согласно требованиям ГФ. Опалесценция, появившаяся в испытуемом растворе, не должна превышать эталон. Предельная чувствительность реакции – 0,0001 мг (0,1 мкг) хлорид-иона в 1 мл раствора.
Хлориды. 0,5 г субстанции растворяют в 25 мл воды. 10 мл полученного раствора должны выдерживать испытание на хлориды (не более 0,01 % в субстанции).
Содержание сульфатов в изучаемом БАВ основывалось на способности сульфат-ионов образовывать с растворами солей бария белый осадок. Испытуемый раствор должен выдерживать испытание в сравнении с эталоном.
Сульфаты. 10 мл раствора, полученного в испытании на хлориды, должны выдерживать испытание на сульфаты (не более 0,05 % в субстанции).
Для определения сульфатной золы точную навеску субстанции помещали в предварительно взвешенный фарфоровый тигель, смачивали в 1 мл серной кислоты концентрированной и прокаливали при температуре около 600 °С до постоянной массы в муфельной печи. По окончании прокаливания тигель охлаждали в эксикаторе и взвешивали.
Сульфатная зола и тяжёлые металлы. Сульфатная зола из 1 г субстанции (точная навеска) не должна превышать 0,1 % и должна выдерживать испытание на тяжёлые металлы (не более 0,0005 % в субстанции).
Мышьяк. 0,5 г субстанции не должны давать реакции на мышьяк.
Выводы
1. Разработанные методики определения прозрачности, цветности раствора, рН, потери в массе при высушивании, примесей хлоридов, сульфатов, мышьяка, сульфатной золы и тяжелых металлов позволяют надежно контролировать доброкачественность БАВ Na-CPAH.
2. Подобранные оптимальные условия хроматографирования БАВ Na-CPAH способствуют высокочувствительному определению посторонних примесей в субстанции.
Рецензенты:
Егорова С.Н., д.фарм.н., профессор, заведующая кафедрой ФПК и ППС, ГБОУ ВПО «КазГМУ», г. Казань;
Шакирова Д.Х., д.фарм.н., профессор кафедры управления и экономики фармации, ГБОУ ВПО «КазГМУ», г. Казань.
Работа поступила в редакцию 04.02.2013.



