Ожоги являются одним из наиболее часто встречающихся видов травматизма. Так, по данным 30 ожоговых центров за год за помощью обратилось около 157000 пострадавших, из них было госпитализировано 22057 пациентов, из которых у 1919 (8,7 %) больных травма закончились летальным исходом [1]. Для сравнения, в Соединенных Штатах Америки ежегодно около 2 млн человек получают ожоги, из которых приблизительно 100 тыс. требуют госпитализации и до 5000 случаев заканчиваются летально. При этом наиболее частой причиной смерти пострадавших от ожогов остаются инфекция и инфекционные осложнения ожоговой болезни, из которых превалируют пневмония и сепсис [8].
Общеизвестно, что все ожоги либо первично инфицированы, либо бактериальная обсемененность раны наступает уже в первые часы после травмы. Кроме непосредственной угрозы для жизни больного, имеющаяся инфекция значительно замедляет эпителизацию ожоговых ран, в том числе препятствуя своевременному оперативному лечению по восстановлению кожного покрова, а также ведет к формированию гипертрофических и келоидных рубцов. Инфекция ожоговых ран при длительном существовании может осложняться генерализацией, развитием сепсиса, ведет к развитию системного воспалительного ответа, результатом которого может явиться полиорганная недостаточность и смерть [2, 3, 4. 8]. Факторами риска летальности при ожогах являются:
• Неадекватная антибактериальная терапия, либо адекватная, но начало которой отсрочено более чем на 24 часа.
• Имеющиеся MRSA (метициллин-резистентные) и MRSE (аминогликозидустойчивые) штаммы микроорганизмов.
• Шок.
• Возраст (дети до 10 лет и взрослые старше 60 лет).
• Бактериемия, пневмония, наличие сопутствующих заболеваний.
• Не санированный первичный локус инфекции.
• Продолжительность антибактериального лечения менее 14 дней.
Таким образом, одной из основных составляющих лечения больных с термической травмой является адекватная антибактериальная защита пациента.
Инфекции у обожженных разделяют на три типа (по G. Magliacani и M.Stella, 1994) [10]:
1. Нозокомиальные инфекции, связанные с окружающей средой больницы, полирезистентной флорой, характеризующейся перекрестным инфицированием через определенные источники.
2. Ятрогенные инфекции, связанные с инвазивными диагностическими и лечебными процедурами.
3. Оппортунистические инфекции, связанные с обычной флорой и иммунокомпрометированным хозяином.
По гистологическим признакам ожоговой раневой поверхности различают стадии развития инфекционного процесса в ране (B.A. Pruitt, 1993; М.Г. Крутиков, 2000) [2, 11]:
I. Колонизация:
а) поверхностная – микробы на ожоговой раневой поверхности;
б) проникновение – микроорганизмы в толще ожогового струпа;
в) пролиферация – появление и изменение численности микробов в пространстве под струпом.
II. Инвазия:
а) микроинвазия – мелкие фокусы микрооргинизмов в измененной ткани соседнего с подструпом пространства;
б) генерализация – микрофокальное или широко распространенное проникновение микробов глубже в измененную подкожную ткань;
в) микрососудистая – вовлечение небольших кровеносных и лимфатических сосудов.
Условно-патогенная микрофлора выявляется на ожоговой поверхности уже в первые сутки с момента травмы. В последующем бактерии могут проникать в разрушенные волосяные фолликулы, а при глубоких ожогах ‒ в подкожно-жировую клетчатку и далее по кровеносным и лимфатическим сосудам разноситься по всему организму, вызывая генерализованную микробную инвазию. Генерализация инфекции наиболее часто происходит при площади ожоговых ран более 15 % поверхности тела (у детей до 12 лет – более 5 % поверхности тела), при площади глубоких ожоговых ран более 5 % поверхности тела, при наличии сопутствующих заболеваний (сахарный диабет, ОРВИ, пневмония, другие очаги острой и хронической инфекции), при иммунодефицитных состояниях, базисном лечении иммунодепрессантами и кортикостероидами, а также при сочетании с термоингаляционной травмой. Все перечисленные состояния требуют назначения антибактериальных препаратов по абсолютным показаниям, причем начало системной терапии антибиотиками должно происходить в первые 12–24 часа после травмы для предотвращения генерализации [4].
Адекватная стартовая антибактериальная терапия является основным фактором лечения ожоговой болезни и выживаемости пациентов. При этом при назначении антибиотиков выбранные препараты должны по возможности охватывать весь спектр потенциальных возбудителей инфекции и выбираться с учетом риска мультирезистентности возбудителей.
В литературе, посвященной лечению ожоговой болезни, описаны основные схемы назначения антибиотиков [2, 3, 4, 5, 6, 7, 8, 9 ,10, 11]. Однако вопросы длительности применения того или иного антибактериального препарата, а также схемы перехода между антибиотиками, общая продолжительность антибактериальной терапии рассмотрены недостаточно полно. Это является существенным при лечении больных с тяжелыми обширными ожогами, длительно находящимися на стационарном лечении, в терапии которых приходится задействовать антибактериальные препараты III–IV поколения, а также так называемые «антибиотики резерва».
Цель ‒ определение оптимальных схем назначения, длительности и эффективности использования того или иного антибактериального препарата, схем перехода между препаратами и явилось целью нашей работы.
Материалы и методы исследования
За период с 2009 по 2012 гг. нами было обследовано 118 пациентов в возрасте от 18 до 65 лет с ожогами от 10 % до 35 % поверхности тела. Из них 72 пациента (61 %) были мужчины и 46 (39 %) – женщины. Из общего числа пациентов более половины (81 больной – 68,6 %) изначально при поступлении в стационар были госпитализированы в отделение реанимации и интенсивной терапии для ожоговых больных, где находились до стабилизации состояния от 8 до 35 дней. Из общего числа обследованных больных у 32 (27,1 %) были выявлены различные сопутствующие заболевания, у 26 (22 %) пациентов имелась термоингаляционная травма.
До начала антибактериальной терапии в течение первых суток с момента получения травмы у всех исследованных пациентов (100 %) был проведен бактериальный мониторинг раневых поверхностей. В последующем бактериологическое обследование повторялось каждые 5–7 дней до излечения пациента и выписки из стационара. Исследование выполнялось диско-диффузионным методом (в соответствии со стандартом NCCLS). Кроме раневого отделяемого исследовались кровь, моча, экссудат трахеобронхеального дерева, удаленные магистральные катетеры. Также использовался метод определения минимальной подавляющей концентрации препарата (МПК).
Микрофлора ожоговых ран была представлена, как правило, ассоциациями грамположительных и грамотрицательных микроорганизмов, а также грибов. Наиболее часто встречались St. aureus (40,4 %), Ps. Aeruginosa (31,6 %), реже встречались St. saprophyticus, Proteus, Candida albicans и tropicalis, Acinetobacter baumannii. Из комбинаций наиболее часто встречались Staph. aureus и Ps. Aeruginosa (41,3 %). Кроме того, в процессе лечения ожоговой травмы из всех выявленных штаммов стафилококка у 61,7 % больных выявлялись так называемые MRSA штаммы (рис. 1). Устойчивость синегнойной палочки выявлена была в 37,7 % случаев (рис. 2).
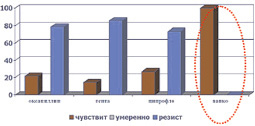
Рис. 1. Резистентность штаммов St. aureus
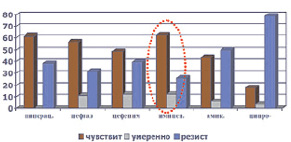
Рис. 2. Резистентность госпитальных штаммов Ps. aeruginosae
При поступлении больных в стационар микробный фон и селективная чувствительность микроорганизмов к препаратам были неизвестны. Однако, учитывая статистические данные проведенного ранее бактериального мониторинга у пациентов с аналогичной травмой, а также опираясь на принятый в 2004 году и периодически обновляемый формуляр антибактериальных препаратов для пациентов с термической травмой, при поступлении в стационар взрослым больным была назначена эмпирическая антимикробная терапия: цефалоспорины II–III поколения (Цефуроксим, Цефотаксим). При подозрении на развитие синегнойной инфекции – терапия назначалась в сочетании с аминогликозидами (Гентамицин, Амикацин) [2, 4, 8]. У детей стартовая терапия включала «защищенные» пенициллины (амоксициллин + клавулановая кислота) или как альтернативный препарат – линкозамид (Линкомицин) [6].
В последующем при сохраняющихся ожоговых поверхностях, при снижении чувствительности микроорганизмов к проводимой терапии, на 10–14 сутки выполнялся переход на цефалоспорины III–IV поколения (Цефотаксим, Цефепим) в сочетании с аминогликозидами (Амикацин), фторхинолоны I–II поколения (Ципрофлоксацин). Показаниями для смены антибактериального препарата были отсутствие чувствительности выделенной флоры к используемому препарату, а также отсутствие положительной динамики состояния пациента, нарастание симптомов системной воспалительной реакции через 48–72 часа.
В дальнейшем при выявлении MRSA и MRSE микроорганизмов, снижении чувствительности к вводимым антибиотикам (повышении МПК > 1 мг/л), что наблюдалось к 22–26 суткам, используемые препараты меняли на гликопептиды (Ванкомицин) и фторхинолоны III–IV поколения (Левофлоксацин, Моксифлоксацин) в качестве монотерапии, либо назначалось сочетание цефалоспоринов III–IV поколения (Цефоперазон+сульбактам, Цефепим) с гликопептидом (Ванкомицин). В некоторых случаях применялись карбапенемы (Имипинем, Меропенем) – при сохранении к ним чувствительности микроорганизмов. Использование подобной терапии осуществлялось еще в течение 8–12 дней. Кроме того, начиная с 8–10 дня от начала антибактериальной терапии из-за снижения колонизационной резистентности желудочно-кишечного тракта и повышения риска развития кандидоза, использовались противогрибковые препараты (Нистатин, Флюконазол) и пробиотики (эубиотики).
Таким образом, в процессе исследования мы, как правило, следовали классической схеме ЭСКАЛАЦИОННОЙ антибиотикотерапии, т.е. назначали изначально антибиотики с относительно нешироким спектром активности, предполагая малую вероятность наличия у пациента в ранние сроки после травмы устойчивых возбудителей [2, 4, 6, 8], а затем переходили на препараты резерва.
Однако, данная схема не всегда может быть использована: например, в случаях индивидуальной непереносимости и аллергии на те или иные группы препаратов у больных, когда у пациента отягощен преморбидный фон, имеется длительный догоспитальный этап, ожоги инфицированы, когда предполагается активная хирургическая тактика, а также в случаях, когда больной по своему состоянию и течению ожоговой болезни уже достиг «потолка» применения антибиотиков, т.е. в терапии были задействованы все препараты «резерва». В подобной ситуации встает вопрос: как быть, если у пациента сохраняется необходимость использования антибактериальных препаратов?
В данном случае имеется лишь два выхода: увеличение срока использования «переносимого» пациентом препарата (под контролем бактериального мониторинга), в том числе с увеличением дозы для создания адекватной подавляющей концентрации, а также использование ДЕ-ЭСКАЛАЦИОННОЙ терапии, суть которой заключается в переходе от препаратов широкого спектра действия к препарату, селективно действующему на конкретный микроорганизм [4]. В ходе исследования нами использовались оба данных направления.
При использовании де-эскалационной терапии с учетом выявленных при бактериологическом исследовании микроорганизмов и их чувствительности к антибиотикам производился отказ от применения препаратов III–IV поколения и «резерва» в пользу незадействованных до настоящего момента антибиотиков I–II поколения, «защищенных» пенициллинов (Амоксиклав), линкозамидов (Линкомицин), противотуберкулезных средств (Рифампицин) и т.д. вплоть до полного временного отказа от системной противомикробной терапии с усилением местного компонента лечения ран [4]. В некоторых случаях, например, при выявлении аллергии у пациентов переход на другие группы препаратов осуществлялся эмпирически, без учета данных бактериального мониторинга, основываясь на клинических проявлениях и данных лабораторного исследования.
Увеличение продолжительности применения антибактериальных средств более 10–14 дней (несмотря на приведенные в аннотации к препаратам и описанные в руководствах по использованию лекарственных средств сроки [7]) проводилось также под контролем бактериального исследования пациентов, и было обусловлено длительностью течения болезни и особенностью лечения больных с термической травмой. Учитывалось общее состояние больного, показатели лабораторных и клинических исследований.
Критериями эффективности антибактериальной терапии явились:
• Регресс системной полиорганной недостаточности.
• Отсутствие нагноения в ране (стерильные посевы на 3,7 сутки).
• Отсутствие генерализации инфекции и вторичных очагов.
Доза вводимого препарата в некоторых случаях увеличивалась в 1,5–2,0 раза, что создавало адекватную подавляющую концентрацию препарата в крови и тканях. Увеличение дозы обусловлено не только ростом резистентности микроорганизмов, но и измененной фармакокинетикой у ожоговых больных, о чем писал Zaske et al. еще в 1976 г. К тому же бактериальный киллерный эффект не является зависимым от концентрации, а является функцией времени, в течение которого поддерживаются концентрации на уровне, приблизительно в 4 раза превышающем МПК. В то же время нет никаких доказательств того, что токсичность препарата соответствует высоким его концентрациям (Moellering R.C., 1994) [5].
Исходя из данных постулатов, в среднем, прием антибиотиков одной группы и поколения (например, цефалоспоринов II–III поколения + аминогликозида) продлевался до 30 ± 5 дней. При исследовании именно к этому времени чувствительность имеющихся на ранах микроорганизмов к данным препаратам приближалась к минимальной. Однако при увеличении длительности использования одного препарата или сочетания препаратов сохранялась возможность продолжить адекватную терапию пациентам, переходя на описанные выше схемы по эскалационной программе, не теряя возможность в случае крайней необходимости использовать препараты резерва и не формируя к ним антибиотикорезистентности.
Результаты исследования и их обсуждение
Анализируя полученные результаты исследования, нами составлены схемы оптимальной системной антибактериальной терапии ожоговой болезни (табл. 1 и 2).
Таблица 1
Схема эскалационной антибактериальной терапии
|
Стартовая эмпирическая эскалационная |
Альтернатива |
Длительность, дней |
Продолжение (второй курс) |
Альтернатива |
Длительность, дней |
Резерв (третий курс) |
|
«Защищенные» пенициллины (амоксициллин/клавуланат), цефалоспорины I поколения (цефазолин) |
Линкозамид (линкомицин), цефалоспорины II–III поколения (цефуроксим, цефотаксим) |
10–14 До 30 ± 5 |
Цефалоспорины III–IV поколения (цефтазидим, цефепим) +аминогликозиды (амикацин) |
Карбапенемы (меропенем, имипенем/цилостатин), фторхинолоны I–II поколения (Ципрофлоксацин) +аминогликозиды (амикацин) |
10–14 До 30 ± 5 |
Гликопептиды (ванкомицин), фторхинолоны III–IV поколения (левофлоксацин, моксифлоксацин), липопептид (даптомицин) |
Таблица 2
Схема де-эскалационной антибактериальной терапии
|
Стартовая эмпирическая Де-эскалационная |
Альтернатива |
Длительность, дней |
Продолжение (второй курс) |
Альтернатива |
Длительность, дней |
|
Гликопептиды (ванкомицин), фторхинолоны III–IV поколения (левофлоксацин, моксифлоксацин), липопептид (даптомицин) |
Карбапенемы (меропенем, имипенем/цилостатин), фторхинолоны I–II поколения (Ципрофлоксацин) + аминогликозиды (амикацин) |
14–20 при MRSA- до 28–42 |
«защищенные» пенициллины (амоксициллин/клавуланат), цефалоспорины I поколения (цефазолин) |
Линкозамид (линкомицин), противотуберкулезные средства (рифампицин) |
14–20 До 30 ± 5 |
Выводы
Таким образом, основываясь на проведенном исследовании, можно сделать вывод, что больным с тяжелой термической травмой, требующим длительной противомикробной терапии, наряду с адекватной санацией раневых (ожоговых) поверхностей для эффективного лечения ожоговой болезни целесообразно применять эскалационную схему противомикробной системной терапии, в том числе допустимо использование антибиотиков до 30 ± 5 дней без их смены, если сохраняется к ним чувствительность микроорганизмов или имеются клинические и лабораторные данные эффективности лечения. Кроме того, допустимо применение де-эскалационной терапии, а также переход от препаратов «резерва» на препараты I–II поколения вплоть до временной полной отмены антибиотиков.
Рецензенты:
Волчегорский И.А., д.м.н., профессор, член-корреспондент РАМН, заслуженный деятель науки РФ, заведующий кафедрой фармакологии, ГБОУ ВПО «Челябинская государственная медицинская академия Министерства здравоохранения России», проректор по учебной работе, г. Челябинск;
Атманский И.А., д.м.н., заведующий кафедрой травматологии и ортопедии, ГБОУ ВПО «Челябинская государственная медицинская академия Министерства здравоохранения России», г. Челябинск.
Работа поступила в редакцию 08.02.2013.



