Основной проблемой герниопластики остается рецидив грыжи, нет единого мнения о подходящем пластическом материале [4]. Многие материалы вызывают осложнения, даже широко используемая полипропиленовая сетка и ее аналоги [1]. Амниотическая оболочка успешно применяется в офтальмохирургии [3], отохирургии [2]. Она не вызывает воспалительных явлений и спаечного процесса, улучшает заживление раны и ее эпителизацию [6]. Для целей герниопластики амниотическая оболочка ранее не применялась.
Цель работы – изучить морфологические изменения, происходящие в тканях брюшной стенки при имплантации амниотической оболочки и ее комбинированного варианта с полипропиленовой сеткой.
Материал и методы исследования
Изучены гистологические препараты, полученные при имплантации амниотической оболочки и комбинированного эндопротеза из амниотической оболочки, обернутой вокруг полипропиленовой сетки, фиксированные к париетальной брюшине в брюшной полости 60 белых крыс линии Vistar. Размеры имплантатов из лиофилизированной амниотической оболочки имели стандартную толщину 0,1 мм. Экспериментальный гистологический материал при имплантации амниотической оболочки забирался в сроки 7 суток, 1 месяц и 3 месяца. Для комбинированного варианта – 14 суток, 1 и 3 месяца. Операции проведены на кафедре госпитальной хирургии, гистологические препараты изготовлены на кафедре гистологии, цитологии и эмбриологии КемГМА. Для фиксации и окраски использовали инновационный фиксатор-краситель (Патент на изобретение № 2408887). Методом световой микроскопии изучено 480 препаратов. Морфометрическую обработку полученных результатов проводили с использованием программы Bio Vision Professional, цветные фотографии гистологических препаратов обработаны с помощью программы Adobe Photoshop CS3. Использован световой микроскоп МС 300 Micros Austria с цифровой камерой CAM V400. Для исследования показателей лизиса и регенерации использованы цифровые показатели камеры (цпк). Статистическую обработку данных проводили с использованием программ Microsoft Office Excel 2003 и Statistica 6.1, описание количественных признаков представлено в формате: медиана (Ме) и интерквартильный размах (25-й; 75-й процентили), при сравнении двух независимых выборок – критерий Манна‒Уитни (U), динамики – критерий Вилкоксона. При проверке нулевых гипотез критическое значение уровня статистической значимости принималось равным 0,05.
Результаты исследования и их обсуждение
Через 7 суток нахождения амниотической оболочки (АО) в брюшной полости (БП) отмечается неоднородная реакция тканей реципиента на имплантат. Петли АО, которые вывернуты амниотическим эпителием наружу, остаются интактными по отношению к органам брюшной полости, и не подвергаются выраженным морфологическим изменениям (рис. 1). Петли же АО, у которых снаружи оказалась соединительнотканная пластинка, претерпевают резко выраженные морфологические изменения. По всей ее площади происходит мощная инфильтрация нейтрофильными лейкоцитами (Нл), количество которых в инфильтрате преобладает среди других клеток инфильтрата (см. рис. 1). Происходит сращение с толстым кишечником и сальником тех петель, которые вывернуты соединительнотканной пластинкой наружу. В ядрах клеток амниотического эпителия вне зависимости от расположения петель обнаруживается кариопикноз и хроматинолиз.
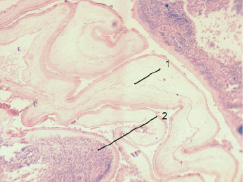
Рис. 1. АО вывернута эпителием наружу, через 7 суток в БП изменения отсутствуют (1), АО вывернута соединительнотканной пластинкой наружу – произошла инфильтрация (2) (о. Композиция № 1, Патент № 2408887, ув. 10×10)
Однако при имплантации АО через 7 суток в центре каждой ее петли прорастает новая рыхлая волокнистая неоформленная соединительная ткань (РВНСТ). Появляется много активных фибробластов (Фб), кровеносных сосудов, что характеризует активно начинающийся неоколлагеногенез и васкулогенез.
Через 1 месяц после имплантации в БП АО мощные клеточные инфильтраты окружают остатки бывшей соеднительнотканной пластинки (рис. 2), которые теперь представляют собой небольшие прослойки промежуточного вещества бледной окраски, незначительной толщины. Клетки, преобладающие в инфильтрате, представлены МФ, эпителиоидными клетками (ЭК) количество которых возросло в два раза. Появляется большое количество КИТ. А количество эозинофилов (Эо) сократилось. На месте лизированных частей АО разрастается РВНСТ, количество фибробластов возросло, что говорит о высокой скорости репарации.
Через 3 месяца остатков АО не обнаружено, произошел полный лизис имплантата. На месте имплантации присутствует новая РВНСТ с кровеносными сосудами, толщина которой удвоилась по сравнению с предыдущим сроком. Как видно из табл. 1, количество фибробластов достоверно возросло по сравнению с предыдущими сроками. Количество клеток макрофагального ряда, напротив, резко сокращается, по-видимому, ввиду того, что лизис имплантата завершен.
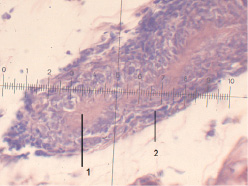
Рис. 2. Остатки соединительнотканной пластинки АО (1) в БП через 1 месяц, окруженные инфильтратом (2) (о. Композиция № 1, Патент № 2408887, ув. 10×10)
Таблица 1
Показатели клеточной реакции при имплантации АО в брюшную полость в разные сроки
|
Клетки Сроки |
Количество клеток в поле зрения в зоне имплантации АО при увеличении 40×10, Ме (25-й; 75-й;) |
||||||
|
Нл |
ТК |
Эо |
Фб |
МФ |
ЭК |
КИТ |
|
|
7 суток (1) |
42,5 (39,5; 46) |
3 (3; 4) |
8 (7; 9) |
5 (4; 5,5) |
21 (19,5; 23,5) |
12 (11,5; 14) |
0 |
|
1 месяц (2) |
0 |
0 |
3 (3; 4) |
9 (8; 9) |
43 (42; 44,5) |
18 (17; 19) |
10 (9; 11) |
|
3 месяца (3) |
0 |
0 |
2 (1,5; 3) |
27,5 (26; 29,5) |
9 (8; 10) |
3 (2; 4,5) |
2 (1; 3) |
|
Т- Вилкоксона (р) |
р1-2 = 0,0001 |
р1-2 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0032 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
При имплантации комбинированного эндопротеза через 14 суток после нахождения в БП происходит его значительная инфильтрация нейтрофильными лейкоцитами и лимфоцитами. Количество нейтрофилов в инфильтрате значительно меньше, чем при имплантации АО. Отмечается начальный лизис соединительнотканной пластинки АО макрофагами и эпителиоидными клетками. Клетки инородных тел в этот срок отсутствуют.
Через 1 месяц инфильтрация в зоне нахождения комбинированного эндопротеза нарастает. В большом количестве тучные клетки и эозинофилы находятся в зоне расположения пропиленового компонента. В составе комбинированного эндопротеза лизис соединительнотканной пластинки АО замедлен, окраска ее обычная. Количество МФ вдвое меньше, чем при имплантации только амниотической оболочки в этот срок. Количество ЭК незначительно увеличивается. КИТ не обнаружены. Имеется сращение комбинированного эндопротеза с сальником, что говорит о воспалительной реакции организма на имплантат.
Через 3 месяца в брюшной полости происходит инкапсуляция комбинированного эндопротеза. Самая тонкая часть этой капсулы приходится на ту зону, где находится АО. Участки АО, расположенные дальше от элементов сетки, имеют вид мелких оксифильных участков промежуточного вещества, окруженных МФ, ЭК и КИТ. В комбинированном эндопротезе происходит разграничение компонентов. Вокруг полипропиленовой сетки, которая смещается в сторону от АО, формируется макрофагальная гранулема (рис. 3). Как видно из табл. 2, в составе гранулемы численно преобладают макрофаги, но в ней также присутствуют эозинофилы, эпителиоидные клетки и клетки инородных тел.
При сравнительном анализе двух экспериментальных групп лизис АО в организме реципиента за 3 месяца происходит в полном объеме, по сравнению с ним в составе комбинированного эндопротеза лизис АО замедлен (табл. 3), и даже через 3 месяца обнаружены остатки соединительнотканной пластинки.
Отмечено положительное влияние АО на репарацию, лизис АО происходит с постепенной заменой на собственные ткани реципиента в отличие от комбинированного эндопротеза, в составе которого находится полипропиленовая сетка, которая способствует воспалительной реакции окружающих тканей и тормозит регенерацию. При межгрупповом сравнении количество новой соединительной ткани и неоангиогенез нарастает в динамике и наиболее выражен при имплантации АО, чем КЭ (табл. 4).
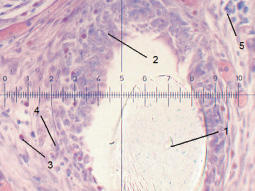
Рис. 3. КИТ (5), МФ, ЭК (4), эозинофилы (3) в составе макрофагальной гранулемы (2) вокруг полипропиленовой нити (1) в составе комбинированного эндопротеза в БП через 3 месяца (о. Композиция № 1, Патент № 2408887, ув. 40×10)
Таблица 2
Показатели клеточной реакции при имплантации комбинированного эндопротеза в брюшную полость в разные сроки
|
Клетки Сроки |
Количество клеток в поле зрения в зоне имплантации КЭ, при увеличении 40×10, Ме (25-й; 75-й;) |
||||||
|
Нл |
ТК |
Эо |
Фб |
МФ |
ЭК |
КИТ |
|
|
14 суток (1) |
16 (15; 17) |
0 |
0 |
0 |
11 (10; 12,5) |
8 (7; 9) |
0 |
|
1 месяц (2) |
9 (8; 10) |
2 (1; 3) |
3 (2; 4) |
3 (2; 4) |
24 (22,5; 26) |
10 (9; 12) |
0 |
|
3 месяца (3) |
0 |
0 |
17 (16; 18,5) |
12 (11; 14,5) |
87 (86; 89) |
9 (8,5; 10,5) |
4,5 (4; 5,5) |
|
Т- Вил-коксона (р) |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0007 р2-3 = 0,0494 |
р2-3 = 0,0001 |
Таблица 3
Степень лизиса имплантатов АО и КЭ в брюшной полости в разные сроки
|
Вид имплантата Сроки |
Толщина биологической части имплантата (цпк), увеличение 10×10, Ме (25-й; 75-й;) |
U-критерий Манна‒Уитни; p |
|
|
Амниотическая оболочка (АО) |
Амниотическая оболочка в составе комбинированного эндопротеза (КЭ) |
||
|
7–14 суток (1) |
92 (91; 94) |
98 (97,5; 99) |
рао-кэ = 0,0001 |
|
1 месяц (2) |
42,5 (41,5; 44,5) |
79 (77,5; 81) |
рао-кэ = 0,0001 |
|
3 месяца (3) |
0 |
24 (23; 25) |
рао-кэ = 0,0001 |
|
Т-критерий Вилкоксона (р) |
р 1-2 = 0,0001 р 2-3 = 0,0001 |
р 1-2 = 0,0001 р 2-3 = 0,0001 |
|
Через 7 суток наименьшие морфологические изменения в виде начального лизиса и хроматинолиза происходят с петлями, покрытыми снаружи амниотическим эпителием, если снаружи находится соединительнотканная пластинка, происходит ее мощная инфильтрация нейтрофилами, подрастание сальника. АО быстро подвергается биодеградации, при имплантации в ткани переднего отдела глаза полный лизис наступает через 18–20 суток [3], при имплантации в БП имплантат полностью лизируется через 3 месяца с заменой на собственные ткани реципиента. Имплантация АО происходит без участия клеток макрофагального ряда [5], но уже через 7 суток обнаружены МФ и ЭК, количество которых нарастает в 1,5–2 раза через 1 месяц, появляется множество КИТ. Только к 3 месяцам, когда лизис АО завершен, количество этих клеток уменьшается. В составе комбинированного эндопротеза лизис тормозится, по-видимому, негативным влиянием полипропилена. Происходит разграничение компонентов, вокруг полипропилена через 3 месяца формируется макрофагальная гранулема [4] и воспалительная реакция приобретает характер хронической. Комбинированный эндопротез через месяц инкапсулируется [4] и происходит его сращение с органами брюшной полости (сальник).
Таблица 4
Оценка регенерации при имплантации амниотической оболочки (АО) и комбинированного эндопротеза (КЭ) в брюшную полость в разные сроки
|
Показатель регенерации Сроки |
Количество новых кровеносных сосудов, Ме (25-й; 75-й;) |
U-критерий Манна-Уитни |
Толщина новой соединительной ткани (цпк), Ме (25-й; 75-й;) |
U-критерий Манна‒Уитни |
||
|
Группы наблюдения |
АО |
КЭ |
АО |
КЭ |
||
|
7/14 суток (1) |
2 (2; 3) |
0 |
рао-кэ = 0,0001 |
12,3 (11,15;14,2) |
0 |
рао-кэ = 0,0001 |
|
1 месяц (2) |
3 (2,5; 3) |
1 (1; 2) |
pао-кэ = 0,0001 |
58,15 (53,1;61,8) |
27,05 (25,45;28,2) |
рао-кэ = 0,0001 |
|
3 месяца (3) |
7 (6; 8) |
5 (5; 6) |
pао-кэ = 0,0003 |
123 (120,6;125,25) |
89,15 (87,9;90,2) |
рао-кэ = 0,0001 |
|
Т- Вилкоксона (р) |
р1-2 = 0,0303 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
р1-2 = 0,0001 р2-3 = 0,0001 |
||
Выводы
1. Амниотическая оболочка, снаружи которой располагается амниотический эпителий, а соединительнотканная пластинка внутри, пригодна для целей герниопластики, не вызывает воспалительных явлений, лизис происходит с заменой на собственные ткани реципиента.
2. Комбинированный эндопротез из амниотической оболочки и полипропиленовой сетки для целей герниопластики непригоден, поскольку способствует длительной воспалительной реакции, репарация собственных тканей несостоятельна.
Рецензенты:
Богданов В.Р., д.б.н., профессор кафедры биологии с основами генетики и паразитологии, ГБОУ ВПО Кем ГМА Минздрава России, г. Кемерово;
Бураго Ю.И., д.м.н., профессор, заведующий кафедрой судебной медицины, ГБОУ ВПО Кем ГМА Минздрава России, г. Кемерово.
Работа поступила в редакцию 8.02.2013.



