В современном обществе, по словам Чучалина А.Г. [8], хроническая обструктивная болезнь легких (ХОБЛ) наряду с артериальной гипертонией (АГ), ишемической болезнью сердца и сахарным диабетом составляют ведущую группу хронических заболеваний; на их долю приходится более 30 % среди всех других форм патологии человека. По прогнозу на период до 2020 года, составленному экспертами ВОЗ, ХОБЛ станет не только одной из самых распространенных форм патологии человека, но войдет в число лидирующих причин смертельных исходов. Увеличение смертности обусловлено нарастанием эпидемии курения и изменением демографических показателей – ростом в популяции числа пожилых и старых людей [8]. Чрезвычайно важной характеристикой ХОБЛ является ее неуклонно прогрессирующее и инвалидизирующее течение, что приносит социально-экономический ущерб не только самим больным, членам их семей, но и обществу в целом.
В настоящее время ВОЗ для сравнения социального ущерба от ХОБЛ в разных странах использует показатель DALY (год жизни, измененный или потерянный в связи с нетрудоспособностью). Согласно прогнозам экспертов, к 2020 году ХОБЛ станет 5-й причиной потерь DALYs в мире, пропустив вперед только ишемическую болезнь сердца, цереброваскулярные заболевания, депрессии и несчастные случаи [4]. Сочетание ХОБЛ и АГ в среднем встречается в 35 % случаев [2]. На протяжении более 40 последних лет дискутируется вопрос о выделении симптоматической «пульмоногенной» АГ у пациентов с ХОБЛ [5]. Впервые связь АГ с бронхообструктивным синдромом была отмечена Н.М. Мухарлямовым, который описывал подъемы АД после нарастания явлений бронхообструкции и наблюдал снижение цифр АД без применения гипотензивных препаратов на фоне купирования бронхоспазма и уменьшения явлений гипоксемии. Также в пользу «пульмоногенных» механизмов АГ у больных ХОБЛ свидетельствует развитие артериальной гипертонии через несколько лет после манифестации ХОБЛ [5].
Для терапии АГ у пациентов с ХОБЛ препаратами выбора, безусловно, являются антагонисты кальция, так как они являются не только вазо-, но и бронходилататорами [2,7]. Особенно они эффективны при обострении легочного процесса, когда степень гипоксемии особенно выражена [1]. Сокращение гладкой мускулатуры бронхов, секреторная активность слизистых желез бронхиального дерева, высвобождение биологически активных веществ – все это кальцийзависимые процессы. АК могут благоприятно воздействовать на такие патологические звенья бронхиальной обструкции, как бронхоспазм, гиперсекрецию слизи и воспалительный отек слизистой оболочки бронхов [3, 6].
Основной целью настоящего исследования явилось изучение влияние дилтиазема ланнахер на эффективность терапии у пациентов хронической обструктивной болезнью легких.
Материал и методы исследования
Материалом для наших исследований послужили 46 больных ХОБЛ в стадии обострения, находившихся на стационарном лечении в пульмонологическом отделении ГБУЗ РМ «РКБ № 4» в 2010–2012 гг. Все пациенты были мужского пола, что очередной раз доказывает, что ХОБЛ является привилегией мужчин. Критериями отбора для исследования явилось наличие у пациента:
– хронических симптомов (кашель, мокрота, одышка);
– ОФВ1/ФЖЕЛ менее 70 % от должного;
– усиление одышки;
– увеличение количества мокроты и усиление «гнойности» мокроты;
– согласие больного на участие в исследовании.
Таким образом, все пациенты отвечали критериям среднетяжелого течения ХОБЛ (2 стадия) (GOLD, 2008).
В исследование не включались пациенты, имеющие тяжелое и крайне тяжелое течение ХОБЛ, принимающие ГКС peros, тяжелые сопутствующие заболевания, а также лица с острыми или обострениями других хронических заболеваний.
Пациенты были разделены на 2 группы.
Пациенты I группы (n = 34, группа контроля) получали лечение согласно рекомендациям международных согласительных документов (GOLD, 2008): ГКС (дексаметазон в дозе 8 мг внутривенно № 10),метилксантины (теопэк 0,3 г 2 раза в день), отхаркивающие средства (бромгексин 16 мг 3 раза в день peros), беродуал в дозе 2 мл (1 мг фенотерола и 500 мкг ипратропия бромида) через небулайзер PARIMASTER 4 раза в день. Для купирования симптомов заболевания по потребности применялись β2–агонист короткого действия Сальбутамол или комбинированный препарат «Беродуал». С антибактериальной целью все пациенты получали амикацин по 500 мг 3 раза в день внутримышечно 7 дней. Пациентам II группы (n = 12, группа исследования) дополнительно назначали дилтиазем ланнахер (производитель «Ланнахер Хайльмиттель ГмбХ» в дозе 180–360 мг/сут peros в течение 14 дней.
Информированное согласие пациента при проведении исследования было обязательным.
Результаты исследования и их обсуждение
В I группе наблюдались 34 пациента мужского пола, средний возраст пациентов 56 ± 3 года. Индекс курящего человека составил в этой группе 55 ± 9 пачек/лет. Профессиональные вредности в анамнезе (работа сварщиками, стекольщиками, кочегарами в течение 5–15 лет) имели 15 % наблюдавшихся пациентов. Средняя длительность заболевания в исследуемой группе составила 10 ± 4 года. II группу составили 12 мужчин (средний возраст 65 ± 5 лет). Индекс курильщика в этой группе составил 42 ± 9 пачек/лет. Указание на профессиональные вредности в анамнезе имели 17 % больных. Средняя длительность заболевания в этой группе была 12 ± 3 года.
В день поступления в стационар пациенты I группы с ХОБЛ оценивали одышку в 4,89 ± 0,28 балла. После проведения ТШХ все пациенты отмечали усиление одышки на 19 % (р < 0,05). Через 14 дней лечения пациенты I группы отмечали уменьшение выраженности одышки на 14 % (р > 0,05) по сравнению с исходными данными, а после ТШХ одышка усиливалась на 13 % (р > 0,05). Постнагрузочный показатель уровня одышки по Боргу после лечения был на 18 % ниже, чем аналогичный показатель до лечения (р < 0,05). Пациенты II группы до лечения оценивали одышку в 4,4 ± 0,17 балла. После проведения ТШХ одышка достоверно усиливалась у больных II группы на 18 % (р < 0,05). К окончанию курса лечения пациенты II группы отмечали достоверное уменьшение выраженности одышки на 25 % (р < 0,05), а после ТШХ одышка усилилась недостоверно на 6 % (р > 0,05), но этот показатель был достоверно ниже постнагрузочного уровня одышки до лечения на 33 % (р < 0,05).
По данным спирометрии, у пациентов I группы на момент поступления ОФВ1 составлял 32 ± 3 %, ТТ–53 ± 4 %. К 14 дню терапии отмечалась положительная динамика ОФВ1 (36 ± 3 %) и ТТ (61 ± 5 %). У пациентов II группы при поступлении в стационар ОФВ1 составлял 30 ± 7 %, ТТ–53 ± 6 %. К 14 дню терапии отмечалась положительная динамика ОФВ1 (39 ± 7 %) и ТТ (62 ± 7 %).
Большую предсказательную точность, чем ОФВ1 и ТТ, имеет индекс BODE. На основании показателя данного индекса можно прогнозировать выживаемость пациентов с ХОБЛ. BODE индекс у пациентов I группы на фоне традиционной 14-дневной терапии уменьшился и составил 5,67 ± 0,53 балла (p > 0,05), вероятность 4-летней выживаемости увеличилась на 13 % (р > 0,05) (рис. 1).

Рис. 1. Динамика BODE индекса и 4-летней выживаемости у пациентов I группы
У пациентов II группы на фоне проводимой терапии наблюдали снижение BODE индекса с 7,8 ± 0,4 до 5,1 ± 0,7 баллов (р < 0,05) и увеличение 4-летней выживаемости на 39 % (р < 0,05) (рис. 2).
При сравнении расстояния, пройденного в течение 6 минут с должным показателем для каждой группы пациентов, выявили, что больные I группы прошли до лечения 43 ± 2 % от должной дистанции, а на фоне лечения – 49 ± 5 % (р > 0,05); пациенты II группы – до лечения прошли 43 ± 3 % от должной дистанции, а через 14 дней лечения – 57 ± 1 % (р < 0,05) (таблица).
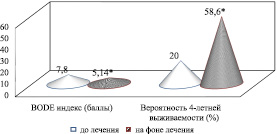
Рис. 2. Динамика BODE индекса и 40-летней выживаемости упациентов II группы. Примечание: – * значения, где p < 0,05 по отношению к показателям до лечения
Пройденная дистанция в ТШХ на фоне лечения
|
Показатель |
До лечения |
Через 14 дней |
До лечения |
Через 14 дней |
|
I группа |
II группа |
|||
|
Пройденное расстояние, % от должного |
43 ± 2 |
49 ± 5 |
43 ± 3 |
57 ± 1* |
Примечание. * – достоверность различий в сравнении с исходными при р < 0,05.
При проведении ХМ ЭКГ у пациентов I группы на момент поступления были выявлены следующие НРС: у 18 (53 %) пациентов НЖЭ, у 9 (26 %) – НЖЭ и ЖЭ, у 7 (21 %) – ЖЭ; наряду с вышеперечисленными НРС у 10 (29 %) наблюдались эпизоды (НЖТ). На фоне лечения наблюдалось снижение максимальной ЧСС с 137 ± 10 до 118 ± 6 (р > 0,05), увеличение минимальной ЧСС с 53 ± 5 до 63 ± 5 (р > 0,05), снижение средней ЧСС с 79 ± 5 до 77 ± 5 (р > 0,05). К 14 дню лечения у пациентов данной группы сохранялись все НРС, выявленные на момент поступления. Проводимая терапия достоверно не повлияла на их количество. Циркадный индекс на фоне терапии снизился на 4 % (р > 0,05), но оставался в пределах нормы.
Во II группе на момент поступления у 11 (92 %) больных наблюдались НРС по типу НЖЭ, у 1 (8 %) – ЖЭ. К 14 дню лечения отмечали снижение максимальной ЧСС на 24 % (р > 0,05), минимальной ЧСС на 6 % (р > 0,05) и средней ЧСС на 7 % (р > 0,05). На фоне дополнительной терапии дилтиаземом ланнахер (180–360 мг/сут) выявлено достоверное уменьшение количества НЖЭ на 92 %, ЖЭ – на 97 %. У 3-х пациентов (25 %) II группы к 14 дню терапии НРС по типу НЖЭ выявлены не были. Циркадный индекс до лечения был снижен и составлял 1,15 ± 0,03, а на фоне терапии отмечали уменьшение ЦИ на 9 % (р > 0,05).
По данным ЭхоКГ, у пациентов I группы через 14 дней лечения показатели внутрисердечной гемодинамики не изменились. У пациентов II группы КСР ЛЖ увеличился на 16 % (р > 0,05), КДР ЛЖ уменьшился на 0,5 % (р > 0,05), ФВ ЛЖ уменьшилась на 5 % (р > 0,05). Размеры правого желудочка и толщина ПСПЖ уменьшились на 2 % (р > 0,05). Выявлено достоверное уменьшение среднего давления в лёгочной артерии с 34 ± 3до 28 ± 2 мм рт. ст. (19 %).
При проведении пульсоксиметрии у пациентов наблюдали увеличение сатурации кислорода к 14 дню проводимой терапии: в I группе – с 89,8 ± 0,7 до 90,3 ± 0,6 % (р > 0,05), во II группе – с 91,9 ± 0,7 до 94,3 ± 0,5 % (р < 0,05) (рис. 3).
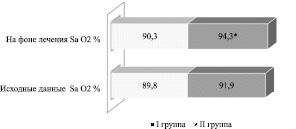
Рис. 3. Динамика сатурации кислорода у пациентов I и II групп. Примечание: – * значения, где p < 0,05 по отношению к показателям до лечения
Одним из важных параметров течения ХОБЛ является потребность в β2-агонистах короткого действия в дневное и ночное время. Пациенты обеих групп на фоне лечения отмечали достоверное уменьшение потребности в β2-агонистах короткого действия как средствах «скорой помощи» в дневное и ночное время. Пациенты I группы реже пользовались сальбутамолом ‒ днем на 24 % (р < 0,005), ночью – на 31 % (р < 0,05); пациенты II группы: на 28 % (р < 0,005) и 41 % (р < 0,05) соответственно.
Таким образом, включение дилтиазема ланнахер в комплексную терапию ХОБЛ повышает качество жизни и прогноз больных. 14-дневное лечение антагонистом кальция сопровождается достоверным повышением сатурации крови кислородом, уменьшением выраженности одышки по Боргу и увеличением пройденной дистанции в ТШХ, снижением потребности в β2-агонистах короткого действия в дневное и ночное время как средствах «скорой помощи».
Выводы
1. Дилтиазем ланнахер повышает толерантность к физической нагрузке, тем самым повышая качество жизни пациентов, и вероятность 4-летней выживаемости у пациентов с ХОБЛ.
2. Включение дилтиазема ланнахер в схему лечения пациентов с ХОБЛ уменьшает количество больных с наджелудочковыми и желудочковыми нарушениями ритма сердца, а также снижает среднее давление в лёгочной артерии.
Рецензенты:
Напалкова С.М., д.б.н., профессор, заведующая кафедрой общей и клинической фармакологии с курсом микробиологии Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Зорькина А.В., д.м.н., профессор, заведующая кафедройполиклинической терапии и функциональной диагностики с курсом эндокринологии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Работа поступила в редакцию 29.01.2013.



