В настоящее время, согласно международной классификации, функциональные заболевания желчных путей обозначаются термином «дисфункциональные расстройства билиарного тракта» (Римский консенсус, 2006 г.). Дисфункциональные расстройства билиарного тракта – это комплекс клинических симптомов, развившихся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктерного аппарата желчных путей.
В зависимости от ведущих клинических проявлений они классифицируются следующим образом:
• по локализации
а) дисфункция желчного пузыря;
б) дисфункция сфинктера Одди;
• по этиологии
а) первичные;
б) вторичные;
• по функциональному состоянию
а) гиперфункция;
б) гипофункция.
Возможны сочетанные расстройства желчного пузыря и сфинктерного аппарата.
Первичные дисфункциональные расстройства билиарного тракта у детей составляют не более 10–15 %. К ним относятся заболевания, в основе которых лежат нарушения желчевыделительной системы вследствие расстройства нейрогуморальных регуляторных механизмов, приводящих к нарушению оттока желчи и/или панкреатического секрета в двенадцатиперстную кишку при отсутствии органических препятствий. Они обусловлены врожденной гиперреактивностью и гиперсенситивностью желчного пузыря.
Вторичные дисфункции встречаются гораздо чаще (85–90 %) и могут наблюдаться при заболеваниях ЦНС, вегетативной нервной системы, желудка и 12-перстной кишки, поджелудочной железы, печени, воспалительных заболеваниях билиарного тракта (острые и хронические холециститы, холангиты), глистных инвазиях, обменных нарушениях, гормональных расстройствах. Они часто сочетаются с врожденными аномалиями желчного пузыря, протоков и сфинктерного аппарата (атрезия и гипоплазия желчных протоков, киста общего желчного протока, агенезия, гипоплазия, удвоение, фиксированные перегибы, перетяжки, дивертикулы желчного пузыря, стеноз сфинктера Одди вследствие врожденного фиброза) [5].
Дисфункция билиарного тракта – проблема, не только снижающая качество жизни пациента из-за наличия болевого симптома, но это и заболевание, способствующее нарушению работы органов, функционально связанных с желчевыделительной системой. Начинаясь нередко с нарушения пассажа желчи, они могут приводить к органической патологии желчевыводящей системы, печени, поджелудочной железы и кишечника.
У детей дискинезия желчевыводящих путей часто сочетается с различной гастроэнтерологической патологией – хроническим гастродуоденитом, дуодено-гастральным рефлюксом, реактивным панкреатитом, запорами.
Желчный пузырь находится под контролем многочисленных регулирующих влияний со стороны центральной и периферической нервной системы, гормонов и желудочно-кишечных пептидов, которые обеспечивают синхронизацию последовательных физиологических процессов желчевыделения. Так, симпатические влияния вегетативной нервной системы способствуют расслаблению желчного пузыря, а воздействие парасимпатического отдела – спастическим его сокращениям. Недостаточная выработка тиреоидина, окситоцина, кортикостероидных и половых гормонов может способствовать снижению мышечного тонуса желчного пузыря и расслаблению сфинктерного аппарата [10].
Ведущая роль в реализации скоординированного сокращения желчного пузыря и расслабления сфинктеров принадлежит гормональным факторам, так называемым гастроинтестинальным гормонам (холецистокинин-панкреазимину, секретину, глюкагону и др.), которые высвобождаются из клеток желудочно-кишечного тракта и поджелудочной железы [9].
Кроме гастроинтестинальных пептидов регуляцию функции билиарной системы обеспечивает внутриполостное давление в ней, состав желчи, средовые факторы и т.д.
Заболеваемость детей хроническими формами патологии желудочно-кишечного тракта в России выросла за последнее пятилетие почти на 40 % и занимает второе место в структуре патологии детского возраста.
В настоящее время известно, что общая заболеваемость на территориях с высоким уровнем техногенного загрязнения среды обитания в 1,5–5 раз выше, чем на относительно экологически благополучных территориях. Уровень болезней желудочно-кишечного тракта составляет от 300 до 600 ‰, что более чем в 3 раза превышает показатели на территориях относительного санитарно-экологического благополучия [1, 8]. Рост заболеваемости в условиях санитарно-гигиенического неблагополучия среды обитания является следствием повышения содержания в биосредах химических веществ техногенного происхождения и напряжения адаптационно-компенсаторных механизмов организма [3, 4].
Среди болезней органов пищеварения функциональные расстройства билиарного тракта по частоте следуют за хроническим гастродуоденитом и составляют около 80 % от всей патологии желчевыделительной системы в детском возрасте [6]. Вклад химических факторов окружающей среды в развитие дисфункциональных расстройств билиарного тракта составляет 14,1 %, при этом по мере нарастания уровня загрязнения внешней среды этот показатель может достигать 36 % [3, 4]. Перечень химических веществ, представляющих опасность развития неблагоприятных эффектов со стороны билиарной системы при комбинированном и многосредовом поступлении в организм детей, включает хром, никель, хлороформ [4].
Для развития экообусловленной патологии желчного пузыря значимым является содержание в атмосфере хрома – 0,0001 мг/м3, никеля – 0,00005 мг/дм3, хлороформа – на уровне 0,098 мг/м3. Наряду с аэрогенным желудочно-кишечный тракт является одним из основных путей поступления вредных для человеческого организма веществ. Концентрация в питьевой воде, превышающая соответствующую ей референтную дозу, поступающую в организм человека, для хрома выше 0,005 мг/(кг∙сут), никеля – выше 0,02 мг/(кг∙сут), хлороформа – выше 0,01 мг/(кг∙сут), может формировать опасность возникновения негативных ответов со стороны билиарной системы.
Соединения хрома, никеля и хлороформа при одновременном поступлении из атмосферного воздуха и с питьевой водой могут создавать комбинированную многосредовую хроническую экспозицию у населения.
В настоящее время выявлены новые звенья и механизмы формирования патологии органов гастродуоденальной системы у детей, проживающих в условиях воздействия металлов и хлороформа. Кумуляция в организме токсикантов промышленного происхождения, в том числе тяжелых металлов, блокирует систему Na+, К+-АТФазу эпителиоцитов и является сильным повреждающим фактором для эпителия желудка и тонкой кишки, вызывающим их деградацию и хронический воспалительный процесс.
Хронический гастрит с секреторной недостаточностью, хронический дуоденит с моторными нарушениями приводят к нарушению продукции гастроинтестинальных гормонов, прежде всего холецистокинина, что в свою очередь изменяет тонус желчного пузыря и сфинктеров билиарного тракта [7, 10].
Центральная нервная система защищена от действия многих токсикантов гематоэнцефалическим барьером. Аналогичный барьер окружает периферический отдел нервной системы (гематоневральный барьер). Вещества, не проникающие через гематоэнцефалический барьер, могут вызвать токсические эффекты на периферии, главным образом в области синаптических контактов нервных волокон с иннервируемыми клетками органов, вегетативных и чувствительных ганглиев. Патологические влияния металлов и хлороформа на вегетативную нервную систему приводят к ослаблению регуляции высших вегетативных центров, что в свою очередь сказывается на регуляции функции билиарного тракта периферической нервной системой.
В связи с тем, что частота встречаемости билиарной патологии в условиях воздействия химических факторов техногенного генеза существенно возрастает, необходимы новые диагностические подходы к ее выявлению. К современным неинвазивным методам изучения состояния желчевыводящих путей у детей относится ультразвуковое исследование, которое отличает безвредность, физиологичность, высокая специфичность и отсутствие противопоказаний [2, 5]. Ультразвуковая диагностика позволяет оценить положение, форму, размеры желчного пузыря, а также провести динамический мониторинг постпрандиальной реакции желчного пузыря.
Цель исследования: методом динамического ультразвукового исследования желчного пузыря выявить особенности дисфункциональных расстройств билиарного тракта у детей, проживающих в условиях воздействия хрома, никеля и хлороформа.
Материалы и методы исследования
Для оценки качества окружающей среды использованы данные Государственного доклада «О санитарно-эпидемиологической обстановке в Пермском крае в 2010 году».
В ходе исследования проведено комплексное обследование 175 детей от 4 до 15 лет (из них 53 % девочки, 47 % мальчики), 120 из них проживали на территориях с высоким уровнем загрязнения окружающей среды химическими веществами техногенного происхождения: хрома > 1,2 ПДК; никеля > 1,1 ПДК (в атмосферном воздухе); хлороформа > 1,2 ПДК (в питьевой воде) и составили группу наблюдения, а 55 детей – на территориях относительного санитарно-гигиенического благополучия, составили группу сравнения. Обе группы были репрезентативны по возрасту и полу.
Обследование включало в себя лабораторный (химико-аналитический) и инструментальный (ультразвуковой) методы.
Идентификация металлов (хром, никель) в сыворотке крови осуществлялась методом атомно-абсорбционной спектрофотометрии с использованием аппаратуры PERKIN-ELMER-3110 (США), регистрационный номер в Государственном реестре № 14427-95, с атомизацией в пламени.
Определение органических соединений (хлороформ) осуществлялось методом газожидкостной хроматографии в соответствии с «Методическими рекомендациями», утвержденными Министерством здравоохранения СССР 4.12.78 г. № 10-8/82 (Зайцева Н.В., 1992) и методом парофазного анализа с различными вариантами пробоподготовки. Используемая аппаратура: газовый хроматограф (модели 6890, 6890N, 6850, 7890A, регистрационный номер в Государственном реестре № 15118-07, страна-производитель США), аппаратно-программный комплекс «Хроматэк-Кристалл-5000» (регистрационный номер в Государственном реестре № ФСР 2009/04091, ТУ 9443-004-12908609-99).
Ультразвуковое исследование желчного пузыря с определением его функциональной способности проводилось на УЗ-сканере экспертного класса «ToshibaAplio XG» (Япония) с линейным датчиком до 7–14 МГц и конвексным датчиком 3–6 МГц. ФС № 2006/2522 , РОСС JP. ИМ 02. В 14629. ГОСТ Р 50460–92).
Исследование проводилось утром натощак, исключая употребление не только пищи, но также любой жидкости, лекарств и жевательной резинки. Оценивались расположение желчного пузыря, форма, размеры, толщина и эхогенность его стенки, характер содержимого, наличие внутрипросветных образований, состояние внутри- и внепеченочных желчных протоков. После приема желчегонного завтрака (молочный шоколад массой 15 г) проводился ежеминутный мониторинг за размерами желчного пузыря до момента начала его сокращения. Затем измерение размеров ЖП фиксировалось последовательно через 10, 20 минут после приема желчегонного завтрака, и далее каждые 5 минут до момента максимального сокращения и начала увеличения объема.
Далее проводился расчет и анализ следующих показателей:
Время максимального сокращения желчного пузыря, (t, минут);
Объем выделенной желчи (V2, мл), т.е. разница максимального и минимального объема желчного пузыря;
Объемный расход желчи (Q, мл/мин) – объем желчи, выделенный в течение времени сокращения (t):
Q = V2/t,
где V2 – объем выделенной желчи; t – время, в течении которого желчный пузырь сокращался; % сокращения желчного пузыря, равного отношению объема выделенной желчи V2, умноженного на 100 % к максимальному объему желчного пузыря V1:
% сокращения ЖП = V2∙100 %/V1.
Для расчета объем желчного пузыря (V, мл) использовалась формула
V = 0,523∙L∙D2,
где L – длина желчного пузыря, см; D – толщина желчного пузыря в самой широкой части, см
Нормокинетический тип состояния желчного пузыря характеризуется следующими ультразвуковыми данными: объемный расход желчи от 0,13 до 0,24 мл/мин, объем выделенной желчи составляет от 4 до 12 мл, время максимального сокращения от 20 до 30 минут, процент сокращения желчного пузыря от 40 до 60 %
Для гиперкинетического типа желчного пузыря, характерным является объемный расход желчи более 0,24 мл/мин, объем выделенной желчи составляет более 12 мл, время максимального сокращения ‒ менее 20 минут, процент сокращения желчного пузыря ‒ более 60 %
Основным ультразвуковым критерием гипокинетического типа состояния желчного пузыря является объемный расход желчи менее 0,13 мл/мин, объем выделенной желчи составляет менее 4 мл, время максимального сокращения более 30 минут, процент сокращения желчного пузыря менее 40 % [10].
Причинно-следственные связи содержания тяжелых металлов и хлороформа в крови с функциональными, морфологическимии лабораторными показателями описывали с использованием модели логистической регрессии [Четыркин, 1977]. Анализ информации проводили в пакете статистического анализа Statistica 6,0 и специально разработанных программных продуктов, сопряженных с приложениями MS-Offise. Математическая обработка осуществлялась с помощью параметрических методов вариационной статистики; для оценки достоверности полученных результатов использовали критерий Фишера (оценка адекватности моделей и относительных результатов статистических исследований) и критерий Стьюдента (сравнение групп по количественным признакам). Различия полученных результатов являлись статистически значимыми при р ≤ 0,05 [Гланц, 1998]
Результаты исследования и их обсуждение
Для доказательства влияния токсического действия компонентов контаминатной нагрузки на детей, проживающих в условиях воздействия токсикантов среды обитания, было проведено сравнение содержания хрома, никеля и хлороформа в крови детей, проживающих в промышленных районах Пермского края, с аналогичными показателями детей группы сравнения, проживающих в районах относительного санитарно-гигиенического благополучия. Концентрация металлов и хлорорганических соединений в крови детей группы сравнения соответствовали фоновым уровням территорий Пермского края. При сравнительной оценке у детей группы наблюдения концентрация уровня хрома и никеля была больше в 1,6 и 1,4 раза соответственно, чем у детей группы сравнения, а также в 1 группе отмечалось наличие хлороформа (табл. 1).
Таблица 1
Содержание металлов и органических соединений в крови детей группы наблюдения и группы сравнения, мг/дм3
|
Токсикант |
Группа наблюдения (М ± m) |
Группа сравнения (М ± m) |
р* |
Референсные значения, мг/л |
|
Хром |
0,0262 ± 0,0106 |
0,0165 ± 0,0014 |
≤ 0,05 |
0,007 ± 0,028 |
|
Никель |
0,229 ± 0,020 |
0,1604 ± 0,0127 |
≤ 0,05 |
0,03 |
|
Хлороформ |
0,0093 ± 0,0039 |
0,0000 ± 0,0000 |
≤ 0,05 |
– |
Примечание. *p ≤ 0,05 достоверность различий сравниваемых групп.
В результате динамического ультразвукового исследования органов брюшной полости с определением функционального состояния желчного пузыря были получены следующие данные (рисунок).
В группе наблюдения нормокинез (объемный расход желчи составлял 0,13–0,24 мл/мин) выявлен у 45 % детей, что достоверно (p ≤ 0,05) меньше, чем в группе сравнения – 62 %.
В группе наблюдения дисфункциональные расстройства билиарного тракта регистрировались в 55 % случаев. Это в 1,4 раза больше данного показателя группы сравнения. Проявления гипокинеза желчевыводящих путей (объемный расход желчи имел значение меньше 0,13 мл/мин) регистрировались почти в 2 раза чаще, чем в группе сравнения, но различия были недостоверны.
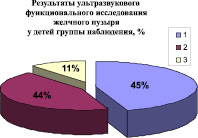
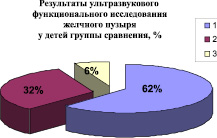
Сравнительная оценка структуры нарушений функции желчного пузыря у детей группы наблюдения и группы сравнения:1 ‒ нормокинез; 2 ‒ гиперкинез; 3 ‒ гипокинез
Проявления гиперкинеза (значение объемного расхода желчи более 0,24 мл/мин), также встречались у детей с токсикантной нагрузкой биосред несколько чаще (в 44 %) в сравнении с детьми, имеющими содержание хрома, никеля и хлороформа на уровне фоновых значений (32 %), но эти различия тоже были недостоверны.
Следовательно, у детей с повышенной контаминацией биосред хромом, никелем и хлороформом отмечалось достоверное увеличение дисфункциональных расстройств билиарного тракта (p ≤ 0,05), установленных по данным ультразвукового динамического исследования. Дисфункциональные расстройства по гипокинетическому типу в группе наблюдения регистрировались хотя и чаще, чем в группе сравнения, но различия были недостоверными.
В процессе исследования установлено, что ультразвуковые показатели у детей, имеющих различный тип билиарной дисфункции, достоверно отличаются по содержанию ряда токсикантов в биосредах. У детей с гипокинетическим типом нарушения функции билиарного тракта достоверно увеличено среднегрупповое содержание хрома в 1,5 раза, никеля в крови ‒ в 1,3 раза относительно детей, имеющих гиперкинетический тип билиарной дисфункции (табл. 2)
Таблица 2
Содержание токсикантов в крови у детей с дисфункцией желчного пузыря по гипо- и гипертоническому типу, мг/дм3
|
Токсикант |
Гипокинетический тип |
Гиперкинетический тип |
р* |
|
Хром |
0,0302 ± 0,008 |
0,0201 ± 0,009 |
≤ 0,05 |
|
Никель |
0,237 ± 0,017 |
0,182 ± 0,020 |
≤ 0,05 |
|
Хлороформ |
0,0106 ± 0,002 |
0,0092 ± 0,003 |
≥ 0,05 |
Примечание. *p ≤ 0,05 достоверность различий сравниваемых групп.
Анализ корреляционных взаимосвязей показал достоверное влияние содержания вышеуказанных токсикантов в крови всех детей, имеющих нарушение билиарной системы как по гипер- так и по гипокинетическому типу, на ультразвуковые показатели, характеризующие процессы образования желчи и моторики желчевыводящих путей (табл. 3, 4).
При гипокинетическом типе билиарной дисфункции выявлена обратная зависимость между % сокращения желчного пузыря и токсикантной нагрузкой хромом, никелем и хлороформом; объемом выделенной желчи и наличием хрома; объемным расходом желчи и нагрузкой никелем и хлороформом; прямая зависимость между временем максимального сокращения желчного пузыря и содержанием никеля.
При гиперкинетическом типе билиарной дисфункции выявлена обратная зависимость между временем максимального сокращения желчного пузыря и токсикантной нагрузкой хромом и хлороформом; прямая между объемом выделенной желчи и содержанием никеля; объемным расходом желчи и наличием хрома.
Таблица 3
Изменения ультразвуковых показателей, характеризующих гипокинетическое функциональное состояние желчевыводящих путей в зависимости от уровня токсикантов в крови
|
Токсикант |
Ультразвуковые критерии функционального состояния билиарного тракта |
Коэффициент корреляции, r |
p* |
|
Хром |
% сокращения желчного пузыря |
–0,464 |
≤ 0,05 |
|
Объем выделенной желчи |
–0,759 |
≤ 0,05 |
|
|
Никель |
Объемный расход желчи |
–0,728 |
≤ 0,05 |
|
Время максимального сокращения желчного пузыря |
0,740 |
≤ 0,05 |
|
|
% сокращения желчного пузыря |
–0,812 |
≤ 0,05 |
|
|
Хлороформ |
Объемный расход желчи |
–0,742 |
≤ 0,05 |
|
% сокращения желчного пузыря |
–0,537 |
≤ 0,05 |
Примечание.* – p – показатель достоверности коэффициента корреляции.
Таблица 4
Изменения ультразвуковых показателей, характеризующих гиперкинетическое функциональное состояние желчевыводящих путей в зависимости от уровня токсикантов в крови
|
Токсикант |
Ультразвуковые критерии функционального состояния билиарного тракта |
Коэффициент корреляции, r |
p* |
|
Хром |
Объемный расход желчи |
0,727 |
≤ 0,05 |
|
Время максимального сокращения желчного пузыря |
–0,577 |
≤ 0,05 |
|
|
Никель |
Объем выделенной желчи |
0,907 |
≤ 0,05 |
|
Хлороформ |
Время максимального сокращения желчного пузыря |
–0,328 |
≤ 0,05 |
Примечание. * – p – показатель достоверности коэффициента корреляции.
В итоге установлено влияние ряда токсикантов на ультразвуковые показатели, характеризующие функциональное состояние билиарной системы. Определено, что среднегрупповое значение хрома, никеля достоверно выше у детей с дисфункцией желчного пузыря по гипокинетическому типу. Анализ корреляционных взаимосвязей также показал влияние этих металлов и органических соединений на ультразвуковые параметры, характеризующие работу билиарного тракта, у детей с гипо- и гиперкинетическими типом расстройств функции желчного пузыря.
Выводы
1. У детей, проживающих в условиях внешнесредового воздействия соединений хрома и никеля, содержание этих компонентов в крови превышает в 1,3–1,6 раза концентрацию вышеуказанных металлов в крови детей группы сравнения. Анализ уровня содержания органических соединений в крови детей, проживающих в экологически неблагоприятных условиях, выявил наличие хлороформа в отличие от детей группы сравнения
2. При анализе динамического ультразвукового исследования функции желчного пузыря установлено, что дисфункциональные расстройства билиарного трактадостоверно чаще встречались у детей, в биосредах у которых определялись токсиканты промышленного происхождения. Нарушения функции как по гипокинетическому, так и по гиперкинетическому типу в группе наблюдения регистрировались хотя и чаще, но различия с группой сравнения были недостоверными.
3. У детей группы наблюдения с гипокинетическим типом нарушения функции билиарного тракта достоверно увеличено среднегрупповое содержание в крови хрома и никеля относительно детей этой же группы, имеющих гиперкинетический тип билиарной дисфункции.
4. Установлены причинно-следственные связи между ультразвуковыми показателями, характеризующими функцию билиарного тракта (процент сокращения желчного пузыря, объем выделенной желчи, объемный расход желчи, время максимального сокращения желчного пузыря) и содержанием хрома, никеля и хлороформа в крови. В группе детей с гипофункцией билиарного тракта выявлена обратная зависимость между процентом сокращения желчного пузыря и наличием хрома, никеля, хлороформа; объемным расходом желчи и наличием никеля и хлороформа; объемом выделенной желчи и наличием хрома. Прямая зависимость установлена между временем максимального сокращения желчного пузыря и наличием никеля.
При гиперкинетическом типе билиарной дисфункции выявлена обратная зависимость между временем максимального сокращения желчного пузыря и токсикантной нагрузкой хромом и хлороформом; прямая зависимость между объемом выделенной желчи и содержанием никеля; объемным расходом желчи и наличием хрома.
5. Детям с контаминантной нагрузкой биосредметаллами (никель, хром) и органическими соединениями (хлороформ), рекомендуется проведение ультразвукового исследования функции желчного пузыря с использованием желчегонного завтрака с определением не только объемного расхода желчи, но и объема выделенной желчи, времени максимального сокращения желчного пузыря, процента максимального сокращения желчного пузыря для определения типа функционального нарушения с последующей индивидуальной коррекцией выявленных изменений.
Рецензенты:
Долгих О.В., д.м.н., профессор кафедры «Экология человека и безопасность жизнедеятельности» Пермского государственного национального исследовательского университета, г. Пермь;
Землянова М.А., д.м.н., профессор кафедры «Экология человека и безопасность жизнедеятельности» Пермского государственного национального исследовательского университета, г. Пермь.
Работа поступила в редакцию 29.01.2013.



