Гистоны – щелочные белки, участвующие в структурной организации генетического аппарата клетки. Соединяясь попарно, гистоны отдельных фракций – Н2А, Н2В, Н3.2 и Н4 – формируют октамерный кор, на который «наматывается» молекула ДНК (146 нуклеотидных пар), образуя нуклеосому [4, 6]. Линкерный гистон Н1 соединяет места входа и выхода молекулы ДНК на нуклеосоме. Он имеет молекулярную массу, равную 21500 Да, и представляет собой полипептид, содержащий глобулярный домен (около 90 аминокислот) с длинным неструктурированным С-терминальным и коротким N-терминальным хвостом. Глобулярный домен взаимодействует с ДНК [11] .
Гистон Н1 рассматривается как репрессор транскрипции, поскольку он предотвращает доступ транскрипционных факторов и хроматин-ремоделирующих комплексов к ДНК [11, 12]. По мере удаления гистона H1 происходит прогрессивная деконденсация хроматина, что, возможно, облегчает взаимодействие РНК-полимеразы с матричной ДНК. Связывание гистона Н1 с хроматином модулируется особым белком, участвующим в построении нуклеосом – NAP-1 (nucleosome assembly protein 1), то есть NAP-1 является шапероном линкерного гистона [7, 10].
Первичная структура гистонов предопределяет конформационную подвижность этих молекул, благодаря которой при образовании генетических структур молекулы гистонов подвергаются самосборке [8, 13]. Совершенно очевидно, что способность гистонов формировать нуклеосомы и подвергаться регуляторным влияниям напрямую зависит от их способности к самоорганизации и характера тех конечных структур, которые образуются при межмолекулярных взаимодействиях.
До настоящего времени для изменения функции гистонов in vivo и in vitro применялись различные химические воздействия. В литературе имеются сведения о модифицирующем влиянии различных видов электромагнитного излучения (ЭМИ) на работу генетического аппарата клетки [1, 9]. Однако ни в одном исследовании не показана реализация данного эффекта через непосредственное изменение макромолекулярной организации гистонных комплексов.
Цель исследования: изучить модифицирующее влияние низкоинтенсивного электромагнитного излучения с частотой 1 ГГц на структурообразовательные свойства гистона Н1.
Материал и методы исследования
В работе использовался рекомбинантный гистон человека H1, полученный из лаборатории New England Biolabs (США). Гистон в концентрации 1 мг/мл находился в среде, содержащей 20 мМ натрия фосфата, 300 мМ натрия хлорида, 1 мМ ЭДТА (рН 7,0 при 25 ○С).
Для изучения процесса структурообразования гистона Н1 использовался метод клиновидной дегидратации [2], основанный на исследовании структурного следа (фации), формирующегося при высыхании капли препарата в стандартных условиях. 1 мкл исследуемого гистона (контрольная проба) помещался на сухое, чистое, обезжиренное предметное стекло. Обычно наносились 6–8 капель для сравнительного анализа. Далее предметное стекло с препаратом в строго горизонтальном положении сохранялось при комнатной температуре (20 °С) в течение 10 мин. Опытные препараты (10 мкл) непосредственно перед высыханием подвергались электромагнитному воздействию с помощью аппарата «Акватон-2» (производитель ‒ фирма «Телемак», Саратов, Россия), генерирующего излучение с частотой 1 ГГц при выходной мощности – 0,1 мкВт/см2. Раструб излучателя помещался на расстоянии 10 см от облучаемого объекта.
После высыхания препараты подвергались микроскопическому исследованию. Применялась световая микроскопия (Zeiss, Germany) с фоторегистрацией структурного следа и сохранением информации в файле компьютера. Имидж-анализ фаций включал их качественную характеристику, а также расчёт количественных показателей с последующей статистической обработкой.
При обработке фаций использовалась специальная компьютерная программа, позволяющая рассчитывать следующие параметры: S1 – площадь периферического ободка, нормированная на общую площадь фации; S2 – площадь промежуточной зоны, нормированная на общую площадь фации; S3 – площадь центральной зоны, нормированная на общую площадь фации; S1/S2 – смещение центра промежуточной зоны относительно центра ободка фации; S2/S3 – смещение центра центральной зоны относительно центра ободка фации. В центральной и промежуточной зонах фации рассчитывались: N – количество гребешков в типичном фрагменте фации; average size (AS) – средний размер гребешков в типичном фрагменте фации; Entr. – неоднородность поверхности фации в типичном фрагменте; D corr. – корреляционная размерность типичного фрагмента. Количественные параметры обрабатывались статистически с использованием t-критерия Стьюдента с помощью статистического пакета программ Prizm-4.
Результаты исследований и их обсуждение
При высыхании гистона Н1 в контрольных пробах (без облучения) характерно появление структур, имеющих тонкий малоструктурированный ободок с мелкопористыми и древовидными элементами в его внутренней части. Прилегающая к ободку промежуточная зона образована крупными булавовидными кристаллами, расположенными по несколько на общем основании (рис. 1,б). Промежуточная зона имеет чёткую зубчатую границу, отделяющую её от центральной зоны. В центральной зоне фации выявляются одиночные крупные и мелкие кристаллы, а также стержневидные структуры, ориентированные в направлении центра фации (рис. 1,а). Фоном центральной зоны являются мелкие древовидные образования (рис. 1,б).
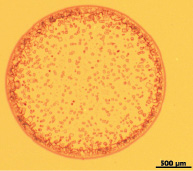
Облучение раствора гистона Н1 низкоинтенсивным электромагнитным излучением с частотой 1 ГГц заметно изменяло структуру фаций (рис. 2,а, б).
В этих фациях также можно было идентифицировать ободковую, промежуточную и центральную зоны. Однородный ободок на всём протяжении имел мелкопористую структуру. Характерных элементов в этой зоне выявлено не было. Промежуточную область фации заполняли густо и беспорядочно расположенные крупные прямоугольные кристаллы, между которыми в небольшом количестве встречались кристаллы ромбовидной и треугольной формы разной величины. Центральная зона характеризовалась наличием множества кристаллов небольшого размера правильной прямоугольной или квадратной формы, находящихся на различных расстояниях друг от друга.
Результаты количественного анализа фаций представлены в таблице.
Как видно из таблицы, фации контрольных и облучённых образцов гистона Н1 отличались по большинству параметров. Облучение раствора гистона низкоинтенсивным ЭМИ с частотой 1 ГГц приводило к уменьшению площади ободковой зоны фации в 13 раз (p < 0,02). Достоверно изменялся показатель, характеризующий смещение центра промежуточной зоны относительно центра ободка фации (р < 0,05). Отмечалось увеличение количества гребешковых объектов в центральной зоне облучённой фации на 50 % (p < 0,05), сопровождающееся уменьшением их среднего размера в 4 раза (p < 0,02). Воздействие низкоинтенсивного ЭМИ значительно уменьшало степень структурной неоднородности (p < 0,001) и структурированности (корреляционной размерности) типичного фрагмента центральной зоны фации (p < 0,001).
а) 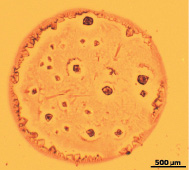 б)
б) 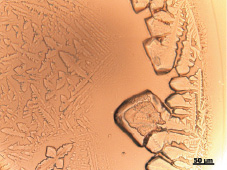
Рис. 1. а ‒ общий вид фации, получаемой при дегидратационной самоорганизации гистона Н1 в контроле (х4);б ‒ периферическая зона фации, получаемой при дегидратационной самоорганизации гистона Н1 в контроле (х25)
 б)
б) 
Рис. 2. а ‒ общий вид фации, получаемой при дегидратационной самоорганизации гистона Н1 после воздействия ЭМИ УВЧ (1 ГГц) (х4);б ‒ периферическая зона фации, получаемой при дегидратационной самоорганизации гистона Н1 после воздействия ЭМИ УВЧ (1 ГГц) (х25)
Промежуточная зона фации после облучения также подвергалась значительной модификации. Наиболее существенные различия затрагивали количество и размер гребешковых объектов, расположенных в данной области. Количество объектов уменьшалось в 3 раза (p < 0,001), а их размер возрастал на 32 % (p < 0,02). Данные изменения происходили на фоне уменьшения степени общей структурной неоднородности этой зоны в 23 раза (p < 0,001).
Результаты статистической обработки количественных показателей имидж-анализа фаций, полученных при клиновидной дегидратации раствора гистона Н1 в контроле и после воздействия ЭМИ УВЧ (1 ГГц)
|
Показатели |
Контроль |
УВЧ |
|
S1 |
n = 8 0,1279 ± 0,007 |
n = 8 0,099 ± 0,006 p < 0,02 |
|
S2 |
n = 8 0,1797 ± 0,009 |
n = 8 0,206 ± 0,017 p > 0,1 |
|
S3 |
n = 8 0,6866 ± 0,013 |
n = 8 0,7009 ± 0,0228 p > 0,05 |
|
S1/S2 |
n = 8 0,0058 ± 0,0005 |
n = 8 0,0025 ± 0,0005 p < 0,05 |
|
S2/S3 |
n = 8 0,0062 ± 0,0006 |
n = 8 0,0078 ± 0,0014 p > 0,2 |
|
Центральная зона |
||
|
N |
n = 6 65,7 ± 5,95 |
n = 6 130,5 ± 6,75 p < 0,05 |
|
Average size |
n = 6 117,6 ± 4, 43 |
n = 6 29,2 ± 3, 63 p < 0,02 |
|
Entr. |
n = 6 1,402 ± 0,223 |
n = 6 0,08 ± 0,02 p < 0,001 |
|
D corr. |
n = 6 1,830 ± 0,012 |
n = 6 1,608 ± 0,0387 p < 0,001 |
|
Промежуточная зона |
||
|
N |
n = 6 143 ± 4,18 |
n = 6 48,5 ± 3,08 p < 0,001 |
|
Average size |
n = 6 47,7 ± 5,64 |
n = 6 148,7 ± 4,71 p < 0,02 |
|
Entr. |
n = 6 1,354 ± 0,187 |
n = 6 0,058 ± 0,003 p < 0,001 |
|
D corr. |
n = 6 1,828 ± 0,027 |
n = 6 1,755 ± 0,053 p > 0,2 |
Примечание. р – достоверность различий с контролем.
Полученные результаты свидетельствуют о том, что низкоинтенсивное ЭМИ с частотой 1 ГГц оказывает существенное модифицирующее влияние на структурообразовательные свойства гистона Н1. Анализируя полученные результаты, следует принять во внимание, что используемый в наших исследованиях гистон Н1 находится в сложной солевой среде. Частота 1 ГГц соответствует естественной частоте колебаний водных кластеров [15] и, предположительно, влияние ЭМИ на структурообразование гистона опосредуется через изменение состояния водно-солевого окружения. В этих условиях изменяются гидратационные свойства водных молекул. Концевые участки гистонов (хвосты) могут подвергаться химической модификации – фосфорилированию, ацетилированию, метилированию, убиквитинированию и т.п., что приводит к изменению активности определенных локусов ДНК [3, 5, 14]. Так реализуются генетические эффекты многих транскрипционных факторов, гормонов, метаболитов-индукторов и других регуляторов генной активности. Последнее предопределяет возможность вовлечения генетического аппарата клетки в реализацию эффектов данного вида излучения на биологические объекты.
Рецензенты:
Бородулин В.Б., д.м.н., профессор, заведующий кафедрой биохимии ГБОУ ВПО «Саратовский ГМУ» Минздрава России, г. Саратов;
Ульянов С.С., д.ф.-м.н., профессор кафедры оптики и биофотоники ФГБОУ ВПО «Саратовский государственный университет им. Н.Г. Чернышевского», г. Саратов.
Работа поступила в редакцию 29.01.2013.



