В настоящее время искусственное кровообращение (ИК) является одной из наиболее часто применяемых методик в кардиохирургии, поскольку обеспечивает неподвижность операционного поля и дает возможность использования микрохирургической техники. Между тем длительная циркуляция крови в аппарате ИК сопровождается травмой ее форменных элементов и развитием внутрисосудистого гемолиза, чрезмерная выраженность которого чревата формированием почечной дисфункции, легочной гипертензии, гиперкоагуляции и полиорганной недостаточности в послеоперационном периоде [2, 14].
В процессе экстракорпоральной перфузии клетки красной крови подвергаются влиянию ряда агрессивных факторов ИК (механическому повреждению, гипероксии, температурному градиенту и др.). Среди последних ведущей признана механическая травма эритроцитов, испытывающих как мощную сдвиговую деформацию в турбулентном потоке крови вблизи ветвления магистралей, фиксации канюль и соединения модулей, так и умеренные сдвиговые нагрузки при ламинарном движении крови в магистралях и оксигенаторе [2, 9, 14]. В этих условиях способность эритроцитов обратимо изменять свою форму при сохранении клеточного объема (деформируемость) может во многом определять их гемолитическую стойкость, которая в свою очередь зависит от структуры липидной фазы мембраны эритроцитов и функционального состояния их цитоскелета [8]. Несмотря на общепринятую концепцию основополагающего вклада перфузиологического обеспечения в интенсивность интраоперационного гемолиза [2, 14], индивидуальные особенности структурно-функционального статуса эритроцитов у кардиохирургических больных могут быть значимым фактором, модулирующим выраженность постперфузионной гемоглобинемии.
Цель исследования: определить особенности структуры липидной фазы мембраны эритроцитов и ее роль в изменении деформируемости клеток у больных ишемической болезнью сердца, оперированных с применением идентичного перфузионного оборудования и проявляющих различную степень выраженности постперфузионного гемолиза.
Материал и методы исследования
В исследование вошло 45 больных (39 мужчин и 6 женщин) в возрасте от 50 до 66 лет, страдающих ишемической болезнью сердца (ИБС) с многососудистым поражением и перенесших операцию коронарного шунтирования с использованием ИК. Реваскуляризация миокарда проводилась в условиях нормотермии (36,07 ± 0,18 °С) и кристаллоидной кардиоплегии (Кустодиол, Германия). Экстракорпоральная перфузия осуществлялась на аппаратах ИК производства «Stokert» (Германия), оснащенных роликовыми насосами, с применением одноразовых мембранных оксигенаторов «Quadrox» (Швеция). Критериями исключения из исследования считали проведение у пациентов продленного после операции ИК, выполнение сочетанных операций, отказ от исследования.
В соответствии с обозначенной целью исследования проводили в двух группах пациентов, сформированных в зависимости от концентрации свободного гемоглобина в плазме крови после операции: с умеренным гемолизом (гемоглобинемия менее 40 мг/дл, 26 мужчин и 4 женщины) и с выраженным гемолизом (гемоглобинемия свыше 40 мг/дл, 13 мужчин и 2 женщины). Концентрация свободного гемоглобина в плазме крови 40 мг/дл была выбрана в качестве критерия распределения больных на группы, учитывая, что при гемоглобинемии свыше этого уровня наблюдаются клинические проявления внутрисосудистого гемолиза (прежде всего, желтуха) [3]. Больные двух групп сравнения были сопоставимыми по возрасту (в среднем 58,14 ± 1,29) и полу (87 % мужчин и 13 % женщин), функциональному классу стенокардии (III-IV) и продолжительности ИБС (4,81 ± 0,73 лет), но отличались по длительности ИК: при умеренном гемолизе 108,27 ± 7,51 мин, при выраженном 139,80 ± 13,17 мин (р < 0,05). В контрольную группу вошли 12 практически здоровых доноров, сопоставимых по полу и возрасту с группами больных ИБС, не страдающие патологией кардиоваскулярной системы, а также заболеваниями других систем органов в стадии обострения.
Материалом исследования служила гепаринизированная (50 ед./мл) венозная кровь. Из цельной крови готовили тонкие мазки, которые суправитально окрашивали 1,2 % раствором бриллиантового крезилового синего для подсчета количества ретикулоцитов [4]. Исследование уровня свободного гемоглобина в плазме крови проводили с помощью бензидинового метода [7]. Деформируемость эритроцитов определяли методом измерения начальной скорости фильтрации 2 % взвеси эритроцитов в ресуспендирующей среде (раствор Рингера + глюкоза 1 мг/мл + альбумин 5 мг/мл + HEPES, рН = 7,4) через ацетатцеллюлозную мембрану типа МФАС–П с диаметром пор 2,4–4,5 мкм (ЗАО НТЦ «Владипор», г. Владимир) и диаметром диска 14 мм, регистрируя время образования 200 мкл фильтрата и рассчитывая индекс ригидности эритроцитов [5]. Мембраны эритроцитов выделяли путем гипоосмотического лизиса [11], липидный экстракт получали по методу J. Folch и соавт. [12]. Определяли общее содержание фосфолипидов (ФЛ) по содержанию липидного фосфора [4] и уровень общего холестерола в выпаренных экстрактах ферментативным методом с помощью коммерческого набора Новохол А («Вектор-Бэст», г. Новосибирск). Фосфолипидный спектр мембраны эритроцитов изучали с помощью тонкослойной хроматографии, разделяя фракции ФЛ в системе хлороформ : метанол : вода (32:12,5:2) на пластинках «Silufol UV254». Идентификацию фракций осуществляли с использованием стандартов «Sigma». Все исследования проводили двукратно: непосредственно до операции и через 1 ч после завершения ИК.
Статистическую обработку данных осуществляли с помощью пакета программ «Statistica 8.0» и «Excel 2007». Для каждой выборки вычисляли 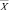 – среднее арифметическое и m – ошибку среднего. Для проверки гипотезы о нормальном законе распределения использовался тест Шапиро–Уилка. Проверку гипотезы о равенстве средневыборочных величин проводили с использованием t-критерия Стьюдента для зависимых и независимых выборок и непараметрических критериев Манна−Уитни (для независимых выборок) и Вилкоксона (для зависимых выборок). Различия считали достоверными при уровне значимости р < 0,05.
– среднее арифметическое и m – ошибку среднего. Для проверки гипотезы о нормальном законе распределения использовался тест Шапиро–Уилка. Проверку гипотезы о равенстве средневыборочных величин проводили с использованием t-критерия Стьюдента для зависимых и независимых выборок и непараметрических критериев Манна−Уитни (для независимых выборок) и Вилкоксона (для зависимых выборок). Различия считали достоверными при уровне значимости р < 0,05.
Результаты исследования и их обсуждение
В результате проведенных исследований было показано, что концентрация свободного гемоглобина в плазме крови и содержание ретикулоцитов в крови у больных ИБС обеих групп сравнения превышали контрольные значения не только после операции, но и до ее проведения (табл. 1). Последнее, видимо, отражает дисфункцию эритроцитов на фоне атеросклероза, ведущую к их ускоренной гибели и компенсаторной активации эритропоэза [6]. При этом установленные изменения в наибольшей степени выявлялись у пациентов с выраженным постперфузионнным гемолизом, чем в альтернативной группе больных. После операции у пациентов обеих групп сравнения уровни гемоглобинемии и ретикулоцитов в крови еще более возрастали по отношению к исходным значениям (см. табл. 1). Примечательно, что многократное увеличение первого показателя у больных с выраженной гемоглобинемией сочеталось лишь с некоторым повышением численности ретикулоцитов в крови, в то время как в альтернативной группе пациентов данные параметры изменялись в равной степени. Поскольку поступление ретикулоцитов в кровь всего через несколько часов после начала операции связано с наличием в костном мозге некоторого резерва этих клеток, дозревающих после энуклеации оксифильных нормобластов [1], то недостаточность данной реакции у больных с выраженной гемоглобинемией свидетельствует о дооперационном истощении костномозгового резерва молодых форм эритроцитов.
Таблица 1
Содержание ретикулоцитов в крови и свободного гемоглобина в плазме крови, а также деформируемость эритроцитов, количество холестерола и фосфолипидов в их мембране у больных ишемической болезнью сердца до и после операции с искусственным кровообращением ( )
)
|
Показатели |
Здоровые доноры (n = 12) |
Больные с умеренным постперфузионным гемолизом (n = 30) |
Больные с выраженным постперфузионным гемолизом (n = 15) |
||
|
До операции |
После операции |
До операции |
После операции |
||
|
Концентрация свободного гемоглобина, мг/дл |
6,35 ± 0,81 |
10,71 ± 0,82 рк < 0,05 |
22,15 ± 1,30 рк < 0,01 р1 < 0,01 |
12,57 ± 1,09 рк < 0,01 |
56,02 ± 5,16 рк < 0,001 р1 < 0,001 р2 < 0,01 |
|
Содержание ретикулоцитов в крови, ‰ |
6,22 ± 0,79 |
10,75 ± 0,67 рк < 0,05 |
18,11 ± 0,94 рк < 0,05 р1 < 0,05 |
12,35 ± 0,83 рк < 0,05 р2 < 0,05 |
16,64 ± 1,39 рк < 0,05 р1 < 0,05 |
|
Индекс ригидности эритроцитов, усл.ед. |
76,68 ± 10,31 |
83,68 ± 13,90 |
72,96 ± 9,68 |
144,02 ± 16,57 рк < 0,05 р2 < 0,05 |
124,25 ± 16,08 рк < 0,05 р2 < 0,05 |
|
Общее содержание холестерола, мг/мг белка |
0,49 ± 0,02 |
0,66 ± 0,02 рк < 0,001 |
0,61 ± 0,03 рк < 0,01 |
0,58 ± 0,03 рк < 0,05 р2 < 0,05 |
0,60 ± 0,03 рк < 0,05 |
|
Общее содержание фосфолипидов, мг/мг белка |
0,52 ± 0,01 |
0,47 ± 0,02 рк < 0,05 |
0,49 ± 0,01 рк < 0,05 |
0,46 ± 0,02 рк < 0,05 |
0,43 ± 0,03 рк < 0,05 |
|
Соотношение холестерол/фосфолипиды |
0,95 ± 0,04 |
1,39 ± 0,03 рк < 0,001 |
1,25 ± 0,03 рк < 0,001 р1 < 0,05 |
1,24 ± 0,05 рк < 0,01 р2 < 0,05 |
1,40 ± 0,06 рк < 0,001 р1 < 0,05 р2 < 0,05 |
Примечание. Здесь и в табл. 2: pк – уровень статистической значимости различий по сравнению с показателями у здоровых доноров, p1 – по сравнению с показателями у кардиохирургических больных до операции, p2 – по сравнению с показателями у больных с умеренным гемолизом.
Следует отметить, что длительность ИК хотя и является важным фактором, определяющим степень интраоперационной гемоглобинемии [2, 14], массивный лизис эритроцитов у больных с выраженным гемолизом нельзя объяснить только большей продолжительностью экстракорпоральной перфузии: последняя лишь на 30 % превышала таковую у пациентов с умеренной гемоглобинемией, в то время как уровень постперфузионной гемоглобинемии отличался в 2,5 раза. Возможно, до операции у больных ИБС с выраженным гемолизом имеет место качественный дефект эритроцитов, опосредующий снижение их гемолитической стойкости в условиях экстракорпорального кровообращения. Известно, что внутрисосудистое разрушение клеток крови во время ИК обусловлено турбулентным потоком крови и экстремальной по величине сдвиговой деформацией, действием струйных сил, сил гидродинамического удара, поверхностного натяжения, влиянием высокого гидростатического давления в насосах аппарата ИК и отрицательного давления в коронарном отсосе, которые проявляются в разной степени на различных участках экстракорпорального контура [14]. При этом поведение эритроцитов в потоке крови определяется их механической резистентностью и деформируемостью [8].
Как было показано в предыдущих исследованиях, механическая резистентность эритроцитов у больных с выраженным гемолизом соответствует норме и, следовательно, не может быть причиной повышенного разрушения клеток во время ИК [9]. Между тем деформируемость клеток красной крови у пациентов с выраженной гемоглобинемией оказалось пониженной: индекс ригидности эритроцитов (величина обратная деформируемости) превышал таковой у здоровых доноров и больных с умеренным гемолизом (см. табл. 1). Очевидно, недостаточная способность эритроцитов изменять свою форму при умеренных скоростях потока крови, близких к физиологическим, которая in vivo реализуется преимущественно в сосудах микроциркуляторного русла [8], а in vitro – в оксигенаторе и фильтрах, обусловливает деструкцию клеток красной крови во время ИК. Причиной низкой деформируемости эритроцитов могут быть структурные аномалии цитоскелета или бислоя липидов эритроцитарной мембраны, в частности, высокое соотношение ХС/ФЛ [8].
Содержание ХС и соотношение ХС/ФЛ в мембране эритроцитов у больных ИБС обеих групп исследования оказалось повышенным как до, так и после операции (см. табл. 1), что вполне характерно для заболеваний, сопряженных с атеросклерозом [6]. Однако у больных с выраженным гемолизом глубина обнаруженных девиаций была меньшей, чем в альтернативной группе пациентов. Это, вероятно, объясняется более молодой популяцией циркулирующих эритроцитов у данной категории больных, у которых в дооперационном периоде был зарегистрирован ретикулоцитоз (см. табл. 1). Данное явление лежит и в основе нормального соотношения различных фракций ФЛ в эритроцитарной мембране до операции в изучаемой когорте пациентов (табл. 2), что само по себе удивительно при наличии клинически верифицированного атеросклероза коронарных артерий. Между тем, у больных с умеренной гемоглобинемией отмечалось высокое относительное содержание лизофосфатидилхолина (ЛФХ) при низком уровне фосфатидилинозитола (ФИ) в дооперационном периоде, что сочеталось с отчетливой тенденцией к увеличению доли ФС на фоне незначительного дефицита фосфатидилхолина (ФХ) и фосфатидилэтаноламина (ФЭА) (см. табл. 2). Подобные изменения удельного содержания различных фракций ФЛ в эритроцитарной мембране свидетельствуют о типовой реакции клеток на повреждение при патологиях различного генеза [6].
Таблица 2
Относительное содержание отдельных фракций фосфолипидов в мембране эритроцитов у больных ишемической болезнью сердца до и после операции с искусственным кровообращением ( )
)
|
Показатели |
Здоровые доноры (n = 12) |
Больные с умеренным постперфузионным гемолизом (n = 30) |
Больные с выраженным постперфузионным гемолизом (n = 15) |
||
|
До операции |
После операции |
До операции |
После операции |
||
|
Лизофосфатидил-холин (ЛФХ), % |
2,92 ± 0,15 |
6,10 ± 0,68 рк < 0,05 |
4,64 ± 0,41 pк < 0,05 |
2,72 ± 0,41 p2 < 0,05 |
4,55 ± 0,69 p1 < 0,05 |
|
Фосфатидил-инозитол (ФИ), % |
10,55 ± 0,64 |
7,92 ± 0,30 рк < 0,05 |
8,46 ± 0,58 |
9,47 ± 0,96 |
7,83 ± 0,56 рк < 0,05 |
|
Сфингомиелин (СМ), % |
15,2 ± 0,26 |
14,17 ± 0,99 |
13,01 ± 0,58 |
14,29 ± 1,31 |
14,62 ± 0,74 |
|
Фосфатидилхолин (ФХ), % |
26,75 ± 1,07 |
24,55 ± 1,25 |
25,36 ± 1,02 |
26,33 ± 1,46 |
20,66 ± 0,59 pк < 0,05 p1 < 0,05 p2 < 0,05 |
|
Фосфатидилсерин (ФС), % |
6,37 ± 0,68 |
9,24 ± 0,86 |
7,20 ± 1,13 |
5,69 ± 1,30 |
5,43 ± 1,13 |
|
Фосфатидил-этаноламин (ФЭА), % |
23,61 ± 0,53 |
21,40 ± 1,61 |
21,77 ± 0,60 |
24,23 ± 0,91 |
24,92 ± 1,71 |
|
Фосфатидная кислота (ФК), % |
14,59 ± 1,01 |
15,48 ± 1,74 |
19,56 ± 1,60 pк < 0,05 p1 < 0,05 |
16,14 ± 1,73 |
19,43 ± 1,00 pк < 0,05 p1 < 0,05 |
Несмотря на то, что общее содержание ФЛ в мембране эритроцитов у больных ИБС было пониженным вне зависимости от выраженности постперфузионного гемолиза и этапа исследования (см. табл. 1), фосфолипидный спектр мембраны после операции существенно изменялся (см. табл. 2): при умеренной гемоглобинемии нормализовалось содержание ФИ, аналогичная тенденция отмечалась для ЛФХ, но возрастала доля фосфатидной кислоты; при выраженном гемолизе уровень ФИ и ФХ снижались на фоне увеличения доли ЛФХ и фосфатидной кислоты (ФК).
Учитывая неспособность эритроцитов к синтезу липидов и пути метаболизма мембранных ФЛ в клетке, можно предположить, что развитие умеренной гемоглобинемии ассоциировано с активацией фосфолипаз С и D, продуктом деятельности которых является ФК [6, 10, 13]. Формирование выраженной гемоглобинемии помимо аналогичной реакции, сопровождается активацией фосфолипазы А2, осуществляющей деградацию ФЛ с образованием лизофракций [6, 10]. Поскольку фосфолипаза А2 преимущественно гидролизует ФХ, а фосфолипаза D обладает исключительной специфичностью к этому ФЛ [10, 13], то сочетанная активация данных ферментов опосредует послеоперационное снижение уровня ФХ в эритроцитарной мембране у больных с выраженным гемолизом. Кроме того, потенцирующее действие в деградации ФХ оказывает свободнорадикальная модификация его молекул, которые богаты ненасыщенными двойными связями и выступают в роли главного субстрата в процессах липопероксидации [6, 13]. Гипероксия, неизбежно возникающая при ИК, приводит к активации ПОЛ, которая способствует пероксидации ФЛ в мембране эритроцитов и, как показано ранее, характерна только для выраженной гемоглобинемии [9, 14]. ФЛ, имеющие в составе гидропероксиды жирных кислот, особенно активно гидролизуются фосфолипазой А2 [6, 10].
Уменьшение доли ФИ после ИК у пациентов с выраженным гемолизом, очевидно, связано с активацией фосфолипазы С, гидролизующей ФИ с образованием инозитолтрифосфата и диацилглицерола, метаболизируемого далее до ФК [10]. У больных с умеренным гемолизом снижение ФИ после ИК не отмечается в силу либо меньшей активности фермента, либо более интенсивного поступления в кровоток молодых форм эритроцитов (ретикулоцитов, табл. 1), содержащих большое его количество.
Сопоставляя незначительные нарушения в структуре мембраны эритроцитов у больных с выраженным гемолизом (небольшое увеличение ХС/ФЛ-коэффициента и нормальное соотношение отдельных фракций ФЛ) с почти двукратным увеличением индекса ригидности клеток, приходится констатировать, что дефекты липидной фазы эритроцитарной мембраны не обусловливают низкую деформируемость клеток красной крови у данной категории пациентов. Вероятно, основную роль в нарушении механизмов обратимой трансформации клетки играет несостоятельность цитоскелета. Белки цитоскелета, как и остальные протеины эритроцитов, синтезируются только в ходе эритропоэза, активация которого сопровождается сокращением генерационного времени эритрокариоцитов, необходимого для наработки всех компонентов клетки [1]. Очевидно, высокая напряженность эритропоэза до операции у больных с выраженным гемолизом (ретикулоцитоз при сокращении костномозгового резерва ретикулоцитов) определяет дефицит белков цитоскелета и низкую деформируемость эритроцитов.
Выводы
1. Вне зависимости от выраженности постперфузионного гемолиза и этапа периоперационного периода структура мембраны эритроцитов у больных ИБС характеризуется дефицитом общих ФЛ, а также высоким содержанием ХС и повышенным соотношением ХС/ФЛ, наиболее выраженными у больных с умеренной гемоглобинемией (до операции), у которых после ИК ХС/ФЛ-коэффициент снижается, а при выраженном гемолизе – возрастет.
2. Развитию умеренного гемолиза предшествуют значительные изменения фосфолипидного спектра мембраны эритроцитов до операции с избыточным содержанием ЛФХ и дефицитом ФИ, уровень которого после ИК нормализуется при аналогичной тенденции ЛФХ. Формирование выраженной гемоглобинемии ассоциировано с нормальным соотношением фракций ФЛ в эритроцитарной мембране до операции (вследствие высокого содержания молодых форм эритроцитов), что после ИК сменяется увеличением доли ЛФХ, дефицитом ФИ и ФХ в цитолемме. Содержание ФК в мембране эритроцитов после операции возрастает независимо от выраженности гемолиза.
3. Больным с выраженной гемоглобинемией свойственна низкая деформируемость эритроцитов (в отличие от нормального показателя пациентов с умеренным гемолизом), которая не связана с нарушением структуры липидной фазы мембраны эритроцитов, но ассоциирована с высокой напряженностью эритропоэза, которая может сопровождаться дефицитом белков цитоскелета.
Работа выполнена при финансовой поддержке РФФИ в рамках проекта «Механизмы нарушений гемолитической стойкости эритроцитов к факторам экстракорпоральной перфузии» (соглашение № 12-04-31655/12 от 16.10.2012).
Рецензенты:
Петрова И.В., д.б.н., профессор кафедры биофизики и функциональной диагностики, ГБОУ ВПО СибГМУ Минздрава России, г. Томск;
Дмитриева А.И., д.м.н., заведующая диагностическим отделением ОГБУЗ «Томский областной онкологический диспансер», г. Томск.
Работа поступила в редакцию 18.01.2013.



