В связи со значительным количеством пациентов со злокачественными новообразованиями, выявляемых на поздних стадиях заболевания [9], особую актуальность приобретают вопросы паллиативного лечения и внедрения в клиническую практику методов эффективной коррекции синдрома эндогенной интоксикации. Смещение прооксидантно-оксидантного равновесия является одним из важнейших компонентов синдрома эндогенной интоксикации, который прогрессирует по мере роста злокачественной опухоли, усиливая явления «опухолевого токсикоза».
Одним из основных компонентов паллиативного противоопухолевого лечения является химиотерапия, реализация эффектов которой сопровождается дополнительной активацией процессов перекисного окисления липидов (ПОЛ) [10], что вносит дополнительный вклад в прогрессирование эндотоксикоза. Многочисленные отечественные и зарубежные исследования показывают, что включение антиоксидантных веществ в состав комплексной терапии злокачественных новообразований в значительной степени ограничивает развитие эндогенной интоксикации в организме больного. Однако до настоящего времени остается открытым вопрос уменьшения нарушений в органах и системах организма, возникающих в результате противоопухолевой химиотерапии, без снижения ее эффективности [11]. Противоречивые сведения о применении антиоксидантов в терапии опухолей послужили предпосылкой нашего исследования, в котором мы изучили возможность применения на фоне роста опухоли этилметилгидроксипиридина сукцината – препарата, обладающего широким спектром фармакологического действия, в основе которого лежит его выраженный мембранопротекторный эффект.
Цель исследования – исследовать особенности влияния этилметилгидроксипиридина сукцината и его комбинаций с рядом компонентов базовой химиотерапии на поздних сроках роста холангиоцеллюлярной карциномы РС-1 на выраженность эндогенной интоксикации и некоторые показатели опухолевой прогрессии.
Материал и методы исследования
Работа выполнена на кафедре поликлинической терапии и функциональной диагностики в лаборатории экспериментальной фармакологии ФГБОУ ВПО «МГУ им. Н.П. Огарёва». Все исследования выполнены в соответствии с требованиями Хельсинской декларации, правилами GCP, одобрены локальным этическим комитетом ФГБОУ ВПО «МГУ им. Н.П. Огарёва» (протоколы № 21 от 24.10.2007, № 54 от 02.09.2011).
В работе исследованы следующие препараты: циклофосфан фл.д/инф. 0,2 (ОАО «Биохимик»); 5-фторурацил (ООО «ЛЭНС-Фарм»); рубомицин, фл.д/инф. 0,02 (даунорубицин-ЛЭНС, ООО «ЛЭНС-Фарм»); этилметилгидроксипиридина сукцинат 5 % р-р д/инъекц. (мексидол®, ООО «Фармасофт»).
Для моделирования опухолевого роста использована холангиоцеллюлярная карцинома крыс РС-1 (ХЦК) (опухолевый банк НИИ Экспериментальной диагностики и терапии опухолей ГУ РОНЦ им. Н.Н. Блохина РАМН). Перевивка ХЦК производилась на 28-е сутки роста опухоли белым крысам-самцам по достижении массы 80–90 г под кожу передней брюшной стенки 7∙106 опухолевых клеток в 0,5 мл тиогликолевой среды. Эксперименты были проведены на 164 белых нелинейных крысах-самцах. Животные содержались в стандартных условиях вивария с постоянным доступом к питьевой воде и брикетированному корму. Животных всех опытных серий забивали путем декапитации под эфирным наркозом на 35-е сутки после перевивки опухоли.
В эксперименте выраженность эндотоксикоза оценивали по содержанию молекул средней массы в плазме крови – D254 и D280 (Габриэлян Н.И., 1981); по величине индекса токсичности (ИТ = ОКА/ЭКА – 1), характеризующего накопление токсических продуктов в плазме и резерву связывания альбумина (РСА = ЭКА/ОКА), отражающего свободную от токсинов часть молекулы альбумина, измерения общей (ОКА) и эффективной (ЭКА) концентраций альбумина производили на флюориметре «Зонд-3» [2]; по критериям интоксикации (КИ), отражающим дисбаланс между накоплением и связыванием токсинов в плазме крови:
КИ1 = (D254/ЭКА)∙1000;
КИ2 = (D280/ЭКА)∙1000;
по индексу лейкоцитарной интоксикации (ИЛИ), рассчитываемому по формуле, предложенной Кальф-Калифом Я.Я. в 1941 г. Гематологические методы исследования включали определение содержания гемоглобина в крови, СОЭ, количества лейкоцитов, тромбоцитов. Для подсчета лейкоцитарной формулы мазки крови окрашивали по Романовскому−Гимзе, клеточный состав просчитывали с использованием бинокулярного микроскопа.
Кроме того, в плазме крови, эритроцитах, гомогенатах печени, почек, тканях сердца, легких и кишечника, а также ткани опухоли определяли содержание малонового диальдегида по методу С.Г. Конюховой [3] при спонтанном (МДА) и индуцированном железом окислении (FeМДА). Оценивалась активность ферментов антиокислительной защиты – каталазы по методу М.А. Королюк с соавт. [4], активность супероксиддисмутазы [8]. Антиокислительная активность (АОА) рассчитывалась как FeМДА – МДА [1]. Рассчитывали резерв липидов для перекисного окисления по формуле [РЛПО = (FeМДА – МДА)/МДА] (Кузьменко Д.И., Лаптев Б.И., 1999). Для оценки изменений в метаболическом звене гомеостаза определяли уровень креатинина по цветной реакции Яффе, мочевины по диацетилмоноксимному методу, активность аланиновой (АлТ) и аспарагиновой (АсТ) трансаминаз методом Райтмана−Френкеля (1980), содержание глюкозы – глюкооксидазным методом по окислению О-толуидина (Меньшиков В.В., 1987), содержание общего белка и альбуминов.
По завершении эксперимента оценивали массу животных-опухоленосителей, массу опухоли и печени, индекс массы опухоли (ИМО) и печени (ИМП), рассчитанных как отношение массы этих тканей к массе животного и выраженных в процентах. Противоопухолевый эффект оценивали по индексу торможения роста опухоли
ИТРО = (Mк – Мо)/Мк∙100,
где Мк и Мо – средняя масса опухоли соответственно в контрольной и опытных группах.
Для гистологического исследования срезы окрашивались гематоксилином и эозином (Артишевкий А.А. с соавт., 1999). Гистологические препараты просматривали с использованием светового бинокулярного микроскопа при увеличении ×300, проводился подсчет количества кровеносных сосудов в 30 полях зрения (Карамышева А.Ф., 2000).
Результаты исследований обрабатывали методами вариационной статистики с использованием программ Microsoft Office Excel, Primer of Biostatistics for Windows. Вычисляли среднюю арифметическую выборочную (М), ошибку средней арифметической (m) и стандартное отклонение. Значимость отличий средних величин выборок при нормальном распределении оценивали с помощью параметрического t-критерия Стьюдента, а при распределении признака, отличного от нормального, и при малых выборках – непараметрический критерий Манна–Уитни (Mann–Whitney U-test). При сравнении долей, выраженных в процентах, применялся критерий согласия χ2 Пирсона. Различия средних величин признавались значимыми при уровне значимости р < 0,05. Полученные данные представлены в виде M ± m, р.
Результаты исследования и их обсуждение
Миелопротекторный эффект производных 3-оксипиридина наглядно продемонстрирован при гемопоэзсупрессирующих влияниях: курсовом введении цитостатиков [5] или лучевом воздействии [7]. Это предопределило выбор этилметилгидроксипиридина сукцината (мексидола®) для коррекции метаболических нарушений, развивающихся в организме на поздних стадиях роста опухоли, когда необходимо паллиативное лечение. С этой целью в эксперименте была использована медленнорастущая модель опухоли (холангиоцеллюлярная карцинома), а изучаемые препараты вводились с 20-х суток после перевивки, то есть в период четкой визуализации первичного опухолевого узла и достижения им размеров не менее 1 см3.
Важным моментом явилось сохранение антиоксидантного эффекта 3-оксипиридина сукцината, несмотря на позднее начало введения, т.е. в условиях опухолевой прогрессии. Применение мексидола в дозе 50 мг/кг привело к повышению активности каталазы в эритроцитах на 105 %, в ткани печени – на 68 %, сердца – на 74 %, кишечника – на 20 %. Уменьшилось содержание МДА в плазме крови, эритроцитах, в ткани печени, почек, сердца. В ткани печени и почек отмечался рост активности СОД. Уровень АОА увеличился во всех исследуемых органах: максимально в эритроцитах – в 5,4 раза. Важно обратить внимание, что использование мексидола приводило к противоположной динамике показателей ПОЛ в ткани опухоли – наблюдалось угнетение активности каталазы на 34 %, СОД – в 3,7 раза, снижение АОА – на 43 % на фоне роста концентрации МДА на 78 % под влиянием мексидола в дозе 25 мг/кг (рис. 1, 2).
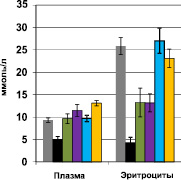
Рис. 1. Влияние мексидола на антиокислительную активность в крови животных в условиях роста ХЦК РС-1 (с указанием среднеквадратичного отклонения)
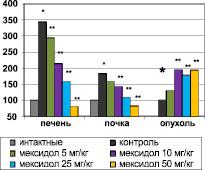
Рис. 2. Влияние мексидола на уровень МДА в органах животных в условиях роста ХЦК РС-1, % к уровню интактных животных (* – достоверность отличия с данными интактной группы, р < 0,05; ** – достоверность отличия с данными контрольной группы, р < 0,05)
Использование мексидола в дозе 25 мг/кг приводило к увеличению содержания глюкозы в крови, наблюдалось увеличение ОКА на 26 % и ЭКА на 112 %, повышение РСА на 73 %. При использовании мексидола в дозировке 50 мг/кг определялось увеличение концентрации глюкозы в крови на 29 %, ИТ уменьшался на 50 %, ИЛИ – на 80 %, происходило уменьшение содержания в плазме крови опытных животных МСМ и значительное снижение критериев интоксикации. В результате применения мексидола в дозе 25 и 50 мг/кг увеличивалось содержание лейкоцитов на 80 и на 68 % соответственно. Содержание гемоглобина возрастало на 26 и 58 %, отмечалось выраженное ограничение роста СОЭ.
Таким образом, под влиянием мексидола на фоне роста холангиоцеллюлярной карциномы РС-1 в эксперименте происходило выраженное уменьшение маркеров эндогенной интоксикации и нормализация биохимических показателей крови.
Наиболее важным вопросом на стадии опухолевой прогрессии, в условиях, когда упущено время для радикального хирургического лечения, а химиотерапия оказывается основным элементом паллиативного воздействия, является оценка эффективности и побочных эффектов цитостатической терапии. Поэтому следующим этапом исследования явилась оценка целесообразности комбинированного использования мексидола и базовых лекарственных препаратов. Следует отметить, что мексидол в изученных дозах не оказал достоверного влияния на величину LD50 циклофосфана (ЦФ), 5-фторурацила (5-ФУ) и рубомицина при однократном введении, хотя и наблюдалась некоторая тенденция к снижению токсичности цитостатиков и увеличению средних величин показателя [6].
Применение комбинаций мексидола и базовых химиотерапевтических препаратов на поздних сроках роста ХЦК РС-1 позволяло ограничить активацию процессов ПОЛ в организме опухоленосителей. Так, на фоне комбинации ЦФ и мексидола (25 мг/кг) наблюдалось снижение уровня МДА в плазме на 27 % и повышение АОА на 118 %, в эритроцитах – повышение активности каталазы на 87 % и АОА – на 44 % по сравнению с данными на фоне монотерапии цитостатиком. В тканях внутренних органов применение ЦФ с мексидолом 25 мг/кг сопровождалось активацией каталазы и СОД, снижением МДА. В ткани печени возрастала активность каталазы на 49 %, АОА – на 62 %, снижалось содержание МДА на 22 %. При использовании в комбинации с ЦФ максимальной из изученных доз мексидола (50 мг/кг) во всех изученных средах, кроме ткани опухоли, наблюдалось снижение МДА на 23–45 %, активация каталазы на 29–135 %. Отмечалось снижение активности СОД в ткани печени на 37 % и рост в ткани почек на 93 % по сравнению с данными группы животных, получавших монотерапию циклофосфаном. Несомненно, позитивным оказалось то, что при этом в ткани опухоли использование комбинации ЦФ с мексидолом (25 и 50 мг/кг) повысило уровень МДА на 67 % и снизило активность СОД на 26 % по сравнению с данными группы, получавшей монотерапию ЦФ. Комбинация ЦФ и мексидола в дозе 25 мг/кг приводила к нормализации содержания АлТ. При увеличении в комбинации дозы мексидола до 50 мг/кг регистрировалось повышение ОКА на 25 % и снижение МСМ D254 на 16 % по сравнению с группой, получавшей только циклофосфан. Кроме того, наблюдался рост числа лейкоцитов на 127 % по сравнению с группой монотерапии циклофосфаном.
Применение комбинации мексидола (25 мг/кг) и 5-ФУ позволяло повысить активность ферментов антиокислительной защиты в ткани печени: каталазы − на 93 %, СОД – на 16 %, к данным монотерапии 5-ФУ. В ткани печени снижалось содержание МДА на 43 %, АОА возрастала на 31 % при одновременном росте МДА в ткани опухоли на 35 % по сравнению с данными монотерапии. При этом содержание МСМ D280 уменьшилось на 26 %, наблюдалось повышение активности АлТ на 34 % к уровню животных, получавших 5-ФУ. С увеличением дозы мексидола до 50 мг/кг в комбинации с 5-ФУ отмечалось усиление эффектов. Содержание МСМ D280 снижалось на 33 %, D254 – на 18 %. Наблюдалось снижение критериев интоксикации: КИ1 – на 56 % и КИ2 – на 65 % по сравнению с уровнем группы «5-ФУ». В значительной степени улучшались и показатели белкового обмена: ОКА увеличилась на 36 %, ЭКА – на 76 % к уровню животных, получавших только 5-ФУ При совместном применении 5-ФУ с мексидолом в дозе 50 мг/кг активность АлТ возросла на 44 %, содержание креатинина уменьшалась на 26 % к группе животных, получавших 5-ФУ в режиме монотерапии. На фоне комбинированной терапии 5-ФУ и мексидолом (25 и 50 мг/кг) не наблюдалось развития лейкопении и анемии.
На фоне комбинированного применения рубомицина и мексидола в дозе 25–50 мг/кг по сравнению с группой, получавшей только цитостатик, наблюдалась нормализация содержания мочевины и креатинина, количества общего белка, содержания альбуминов, снижение активности АлТ, рост уровня глюкозы. Применение мексидола 50 мг/кг на фоне введения рубомицина снижало выраженность эндогенной интоксикации – выявлено повышение РСА на 52 %, снижение ИТ на 51 %, ИЛИ − на 70 %. При введении мексидола в дозах 25 и 50 мг/кг в плазме отмечалось угнетение процессов ПОЛ, что выражалось в повышении активности каталазы, снижении содержания МДА, увеличении РЛПО, АОА по сравнению с группой животных, получавших только рубомицин. Аналогичные изменения выявлены в гомогенатах печени, почек, сердца.
Повышение противоопухолевых эффектов базовых цитостатических препаратов в отношении первичного опухолевого узла наблюдалось даже на поздних сроках роста ХЦК РС-1. При совместном применении 5-ФУ и мексидола в дозе 25 мг/кг ИТРО составил 26 %. При введении мексидола 50 мг/кг на фоне терапии 5-ФУ ИТРО увеличивался до 59 %, что достоверно выше чем в группе, получавшей 5-ФУ в режиме монотерапии. Комбинированное применение рубомицина и мексидола способствовало более значительному уменьшению массы опухоли, снижению ИМО, повышению ИТРО, чем при монотерапии рубомицином. При введении мексидола в дозах 25 и 50 мг/кг на фоне применения рубомицина митотическая активность уменьшилась на 16 и 35 % соответственно в сравнении с серией животных, получавших только химиопрепарат. При этом с увеличением дозы мексидола в клетках опухоли нарастали явления гидропической и гиалиново-капельной дистрофии, кариорексиса и кариолизиса.
Таким образом, дополнительное применение этилметилгидроксипиридина сукцината на фоне введения изученных базовых химиопрепаратов не только оказывает значительное корригирующее влияние на метаболические показатели и клеточный состав периферической крови, но и позволяет оптимизировать противоопухолевое действие цитостатиков.
Рецензенты:
Блинов Д.С., д.м.н., профессор, заведующий кафедрой общественного здоровья и здравоохранения Медицинского института, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск;
Чаиркин И.Н., д.м.н., профессор, заведующий кафедрой нормальной анатомии с курсами судебной медицины, оперативной хирургии и топографической анатомии Медицинского института, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Работа поступила в редакцию 15.01.2013.



