Хорошо известно, что основу всех метаболических процессов составляют ферменты. При этом основы ферментативной кинетики разработаны сегодня преимущественно для очищенных препаратов энзимов. Такой классический подход не позволяет в полной мере оценить каталитические свойства ферментов в реальных условиях их нахождения в клетке. Поэтому одним из важных направлений современной энзимологии является изучение механизмов регуляции ферментативных реакций в условиях гетерогенной системы клетки, где ферменты входят в состав сложных мультиэнзимных комплексов.
Накопленный экспериментальный материал практически мало что дает для понимания молекулярных механизмов регуляции активности ферментов в надмолекулярных структурах субклеточных органелл [5]. Все это указывает на то, что изучение кинетических свойств ферментов в сложноорганизованной гетерогенной системе требует применения новых методических подходов [1]. В первую очередь это определение интегративных кинетических показателей, позволяющих оценить каталитические свойства конкретного фермента, входящего в состав мультиферментного комплекса (гликолиз, цикл трикарбоновых кислот и т.д.).
Целью данной работы явилась разработка нового методического подхода к определению кинетических параметров ферментов в сложноорганизованной системе клетки.
Материал и методы исследования
Для расчета кинетических показателей использовали данные изменения оптической плотности при длине волны 340 нм. В качестве примера вычисления кинетических параметров по предлагаемому методу исследовали активность лактатдегидрогеназы (ЛДГ) в гомогенате печени интактных животных. Эксперименты проведены на белых нелинейных крысах массой 180–250 г. Активность фермента определяли по Г.А. Кочетову [3] в прямой реакции (ЛДГпр) с использованием в качестве субстрата молочной кислоты и в обратной реакции (ЛДГобр) с использованием в качестве субстрата пировиноградной кислоты. Статистический анализ результатов исследований выполнен с использованием программы Statistica 6.
Результаты исследования и их обсуждение
Кинетическое уравнение можно записать двумя разными способами: либо в виде зависимости концентрации субстрата от времени, либо в виде зависимости скорости реакции от концентрации субстратов. Так сложилось, что в энзимологии чаще используют второй вариант, в химии, наоборот, − первый. Химики отдают предпочтение интегральным уравнениям скорости, имеющим преимущество в том, что в них входят величины, непосредственно измеряемые экспериментально. Каким бы классическим методом ни определяли или ни рассчитывали значение константы Михаэлиса (Км) и максимальную скорость реакции (Vmax), существует фундаментальная ошибка, вытекающая из самого характера этих методов. Чем меньше концентрация субстрата, тем труднее определить начальную скорость ферментативной реакции. Помимо этого нежелательным последствием широкого применения классического кинетического подхода является то, что биохимики практически избегают применять интегральные уравнения скорости даже в тех случаях, когда это вполне оправданно.
На начальном этапе исследования кинетических свойств фермента (очищенный препарат), когда основная задача сводится к тому, чтобы установить, какому уравнению подчиняются кинетические данные, измерения начальных скоростей вполне оправданны. Однако по завершении этого этапа необходимо переходить к изучению реакции во времени, поскольку в полной кинетической кривой содержится гораздо больше информации, чем просто в значении скорости, полученном экстраполяцией к нулевому моменту времени. Точные значения кинетических параметров можно получить из относительно небольшого количества экспериментов. Важно, что анализ полных кинетических кривых позволяет избежать субъективных ошибок, неизбежных при определении начальных скоростей из нелинейных графиков [2].
Поэтому для гетерогенной ферментативной системы целесообразнее использовать насыщающие концентрации субстрата, тем более что применение различных концентраций субстрата вызывает в сложных системах клетки разнообразные конформационные изменения, что отражается на значительной вариабельности кинетических свойств конкретного фермента в составе мультиферментного комплекса. Для определения кинетических констант ферментативной реакции целесообразно использовать полную кривую накопления продукта (зависимость концентрации продукта от времени – от начала до полного расходования субстрата).
Нам представляется возможным использовать данную закономерность для определения интегративных кинетических показателей конкретных ферментов, входящих в состав сложноорганизованных надмолекулярных структур клетки (гетерогенная надмолекулярная система).
Используя кривую расходования субстрата (или накопления продукта), можно рассчитать время полупревращения ферментативной реакции, кинетический показатель, который также можно определить как интегративный показатель сродства фермента к субстратам в гетерогенной надмолекулярной системе (рисунок).
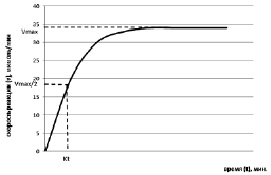
Полная кинетическая кривая зависимости V от t
V = VmaxЧ(t/(Kt + t)),
где V – скорость накопления определенной концентрации продукта реакции за конкретный промежуток времени (мкмоль /мин); Vmax – максимальная скорость реакции фермента в гетерогенной системе (максимально возможное накопление продукта реакции при полном расходовании субстрата) (мкмоль /мин); t – время, соответствующее накоплению конкретной концентрации продукта реакции (мин); Kt – интегративный показатель сродства фермента к субстратам в гетерогенной системе (время полупревращения субстрата ферментативной реакции) (мин).
Из первичных экспериментальных данных полной кинетической кривой зависимости продукта реакции от времени (V от t), используя математический метод, можно рассчитать следующие кинетические параметры: Kt, Vmax [6], а также коэффициент каталитической эффективности ферментативной реакции Ka (Ka = Vmax/Kt).
Учитывая, что с течением времени кинетическая характеристика фермента в надмолекулярной структуре может изменяться, целесообразно выбрать определенный диапазон времени на кинетической кривой, при котором имеет место преимущественно пропорциональное изменение скорости реакции от времени, а концентрации исходных субстратов остаются насыщающими. Данный промежуток времени равен 60 секундам.
Несомненно, что в гетерогенных системах кинетика ферментативной реакции носит сложный характер, связанный с конформационными и кооперативными взаимодействиями ферментов в надмолекулярных структурах, а также их различной компартметализацией [4]. Поэтому возникает необходимость определения новых коэффициентов Kf и Kn, где Kf – коэффициент конформационных изменений фермента в гетерогенной надмолекулярной системе (Kf = (V2/V1) и т.д.), а Kn – коэффициент кооперативности ферментативной реакции в гетерогенной системе (Kn = (Kf/t2/t1). Помимо данных показателей можно рассчитать коэффициент структурных изменений фермента в гетерогенной системе Kd (Kd = (Kn/Kf)) и Ksf – коэффициент структурно-функциональных изменений фермента в гетерогенной системе (Ksf = (Kd/Ka)). Данные коэффициенты раскрывают взаимосвязь структурно-функциональных изменений конкретного фермента в сложной гетерогенной надмолекулярной системе клетки с кинетической точки зрения, что очень важно для понимания регуляции метаболических процессов как в условиях физиологической нормы, так и патологии. Важно отметить, что все интегративные кинетические коэффициенты рассчитываются с использованием экспериментально полученных данных из полной кинетической кривой.
В качестве примера представлены кинетические параметры лактатдегидрогеназной реакции (прямой и обратной) в гомогенате печени крыс (таблица).
Интегративные кинетические показатели лактатдегидрогеназной реакции в гомогенате печени интактных животных (n = 10)
|
Кинетические показатели |
ЛДГпр |
ЛДГобр |
|
Kt (мин) |
2,21 ± 0,12 |
0,16 ± 0,01 |
|
Vmax (мкмоль /мин) |
14,14 ± 0,75 |
5,73 ± 0,30 |
|
Ka |
6,39 ± 0,34 |
35,81 ± 1,84 |
|
Kn |
0,84 ± 0,04 |
0,57 ± 0,03 |
|
Kd |
1,69 ± 0,09 |
1,14 ± 0,06 |
|
Ksf |
0,26 |
0,033 |
Видно, что интегративные кинетические параметры лактатдегидрогеназы (в прямой и обратной реакциях) отличаются друг от друга. Сродство фермента к субстратам реакции (Kt) у ЛДГобр существенно выше, чем Kt для ЛДГпр, что отражается в увеличении коэффициента каталитической эффективности для обратной ферментативной реакции в 5,6 раза по сравнению с прямой. Обращает на себя внимание то, что в гетерогенной системе гомогената печени лактатдегидрогеназная реакция проявляет отрицательную кооперативность, которая для очищенного препарата фермента практически не характерна. Полученные данные подтверждают, что каталитическая эффективность ЛДГобр в гомогенате печени интактных крыс выше, чем ЛДГпр.
Из полученных данных следует, что метаболически в надмолекулярной гетерогенной системе гомогената печени процесс образования молочной кислоты преобладает, над процессом ее использования.
Таким образом, предлагаемый новый методологический подход, который носит универсальный характер, позволяет проводить интегративную кинетическую оценку различных ферментативных реакций в гетерогенной надмолекулярной системе клетки. Важное преимущество данного анализа заключается в том, что с его помощью можно корректно сравнивать между собой кинетические свойства ферментов различных классов, что открывает перспективу для комплексного исследования энзимов в сложноорганизованных структурах клетки.
Уместно отметить, что энзимолог XXI века будет изучать молекулярные аспекты сложных биологических явлений не с позиций описания очередного нового фермента, а с целью понимания сущности реакций, в которых конкретный фермент участвует, и с возможностью воздействия на него в нужном направлении. Кинетические исследования могут приблизить то время, когда можно будет говорить об управляемой, регуляторной энзимологии метаболизма клеток, что так важно для практической медицины.
Рецензенты:
Корягин А.С., д.б.н., профессор кафедры физиологии и биохимии человека и животных, ГОУ ВПО «ННГУ им. Н.И. Лобачевского», г. Нижний Новгород;
Веселов А.П., д.б.н., профессор, заведующий кафедрой биохимии и физиологии растений, декан биологического факультета, ГОУ ВПО «ННГУ им. Н.И. Лобачевского», г. Нижний Новгород.
Работа поступила в редакцию 09.11.2012.



