Послеоперационная вентральная грыжа (ВГ) является самым распространенным послеоперационным осложнением абдоминальной хирургии, достигая 20 %-го уровня после срединной лапаротомии. Рядом рандомизированных исследований показано, что после пластики около 50 % послеоперационных грыж рецидивируют. В связи с этим пациенты вынуждены переносить очередное оперативное вмешательство, что сопровождается дополнительными рисками [Hoer J., Lawong G., Klinge U., 2002].
Известно, что основой послеоперационного рубца является соединительная ткань, структурным компонентом которой являются коллагеновые волокна. Их основная функция заключается в поддержке специфической структуры органов и тканей в процессе развития организма. Способность коллагена упорядочивать и стабилизировать клеточные ансамбли, с которыми он контактирует, определяется его строгой упорядоченностью и стабильностью [1, 2].
Процессы деградации коллагеновых волокон главным образом регулируются за счет функционирования матриксных металлопротеиназ (ММП), обладающих высочайшим спектром биологических функций. Они играют ключевую роль в разрушении большинства компонентов внеклеточной матрицы. [5, 7]. Известно около 25 разновидностей металлопротеиназ.
Основное свойство матриксных металлопротеиназ – это способность специфически гидролизовывать основные белки экстраклеточного матрикса. В своем большинстве ММП секретируется клетками в виде неактивных ферментов, их активация приводит к протеолитическому разложению окружающих клетку белков [3, 6, 8]. Некоторые ММП обладают свойствами активизировать друг друга. Для ингибиции протеолиза существуют специфические ингибиторы металлопротеиназ [3].
Выделяют три большие группы матриксных металлопротеиназ: коллагеназы, желатиназы и стромелизины. Коллагеназы гидролизируют интерстициальные коллагены I, II и III типов, которые являются основными компонентом экстрацеллюлярного матрикса. Желатиназы гидролизируют коллаген IV типа, который является основным компонентом базальных мембран, стромелизины гидролизуют протеогликаны и целый ряд адгезивных белков.
Рассмотрим две металлопротеиназы, которые подверглись нашему исследованию.
MMP-3, также называемая стромелизином-1, катализирует деградацию многих компонентов соединительной ткани, включая протеогликаны, линк-белок, коллаген типов II, IV, IX и XI, ламинин и фибронектин. MMP-3 может также влиять на деградацию экстрацеллюлярного матрикса через активацию проколлагеназы-1. MMP-3 секретируется как профермент массой 57 кДа и активируется in vivo путем ограниченного протеолиза тканевыми и плазматическими эндопептидазами. Активность MMP-3 инигибируется TIMP (тканевой ингибитор металлопротеиназ), который взаимодействует с активной MMP-3 в стехиометрическом соотношении 1:1. Полагают, что равновесие между MMP-3 и TIMP – определяющий фактор в разрушении межклеточного матрикса. Активность MMP-3 также может ингибироваться α2-макроглобулином. Считают, что MMP-3 играет важную роль в естественных процессах тканевого ремоделирования и патологических процессах (остеоартритах и ревматоидных артритах).
Ряд исследователей считает стромализин 1 естественным коканцерогенным фактором [6].
MMP-9 (желатиназа B) является зимогеном массой 92 kDa. MMP-9 включают в себя денатурированный коллаген I типа (желатин), нативные коллагены типов IV, V, VII, X и XI, фибриноген, витронектин, IL-1 и энтактин, который соединяет ламинин и коллаген IV типа. Основная функция MMP-9 – это участие в процессах воспаления, ремоделирования ткани и репарации, мобилизации матрикс-связанных факторов роста, процессинга цитокинов, также она играет ведущую роль в ангиогенезе, растворяя стромальные элементы и тем самым прокладывая путь для растущих капилляров [4]. Известно, что ее экспрессия коррелирует с десмоплазией [4].
Цель исследования – изучить ассоциации между соотношением типов коллагена в апоневрозе больных с ВГ и полиморфизмами генов ММП 3 и 9 типов.
Материалы и методы исследования
В работе использованы данные обследования и лечения больных с неосложненными вентральными грыжами, находившихся в клинике хирургических болезней № 1 ГБОУ ВПО КГМУ Минздравсоцразвития России на базе БМУ «КОКБ» с 2010 по 2012 гг.
В выборку для гистологического исследования апоневрозов было включено 95 пациентов, которые были разделены на две группы: № 1 и 2. Мужчин было 30 (31,6 %), женщин – 65 (68,4 %).
В 1 группу вошло 46 пациентов, из них 37 (80,4 %) − больные с послеоперационными вентральными грыжами, из которых 7 (18,9 %) − с малыми размерами, средними – 19 (51,4 %), большими – 7 (18,9 %), гигантскими – 4 (10,8 %). Оставшиеся 9 (19,6 %) были с пупочными грыжами, среди которых 4 (44,4 %) пациента были со средними размерами, а 5 (55,6 %) – малыми. Мужчин – 11 (23,9 %), средний возраст которых составил 54 ± 9,9 года. Женщин – 35 (76,1 %), возраст – 56,8 ± 11,2 лет.
Группу № 2 составили 49 пациентов, не являющихся грыженосителями и не имеющих других клинических проявлений слабости соединительнотканного аппарата. Из них мужчин было 19 (38,8 %), средний возраст которых составил 62,8 ± 13,3 года. Женщин – 30 (61,2 %), средний возраст – 54,5 ± 13,8.
Для молекулярно-генетического анализа была сформирована выборка, составившая 282 пациента, представителей русской национальности, уроженцев Курской области, находившихся на стационарном лечении в отделении общей хирургии Курской областной клинической больницы. Забор материала проводился на месте.
Выборка была подразделена на две группы: № 3 и 4. Группу № 3 составили 128 человек с абдоминальными грыжами. Из них 103 женщины и 25 мужчин. Средний возраст больных составил 54,4 ± 10,9 года. Преобладающей возрастной группой были люди от 51 до 60 лет (45 человек). Вторыми по величине были возрастные группы 41–50 лет и 61–70 лет, по 18,2 и 23,7 % соответственно. 9 и 7,3 % составили больные в возрастах 31–40 лет и более 71 года соответственно.
Группа № 4 состояла из 154 человек. В нее вошли пациенты без грыжевой болезни, без тяжелых соматических патологий – таких, как онкологические заболевания, сахарный диабет, тяжелые формы ишемической болезни сердца (в том числе инфаркты миокарда), артериальной гипертензии и др., находившиеся на стационарном лечении в отделении общей хирургии. Из них 125 женщин и 29 мужчин. Средний возраст их составил 51,2 ± 12,6 года. Преобладающей возрастной группой, так же, как и в группе № 3, были лица 51–60 лет (49 человек).
В план обследования больных с ВГ было включено гистологическое исследование препаратов кожи и апоневроза, полученных интраоперационно, направленное на изучение качественного состава коллагеновых волокон соединительной ткани. У пациентов без ВГ забор материала проводился аналогичным образом. При лапаратомных оперативных вмешательствах выполнялось взятие апоневроза.
Технология выполнения биопсии кожи и апоневроза для гистологического исследования, приготовление и анализ препаратов
Биопсию апоневроза выполняли следующим образом: после рассечения кожи, подкожно-жировой клетчатки выделяли область грыжевого мешка. После его иссечения от края апоневроза брали фрагмент размерами 4,0×4,0 мм. Полученные препараты помещали в приготовленный заранее стеклянный контейнер с 10 % раствором формалина, полностью покрывающим препарат, и закрывали герметичной резиновой пробкой. После 24-часовой экспозиции в растворе формалина биоптат заключали в парафиновый блок по схеме Меркулова. Полученный препарат нарезали на микротоме (сечение 5 µm), фиксировали на предметном стекле и окрашивали красителем SiriusRed (Сириус – красный). После чего препарат исследовали в обычном и поляризованном свете с использованием поляризационного микроскопа AltamiPolar 2, при увеличении ×100, ×250 и ×400, ×630, а также водной иммерсии. Применялась вставка в окуляр, ограничивающая поле зрения. Фотосъемка микропрепаратов осуществлялась с использованием цифровой окулярной камеры Altami 3 Mpx, выполнялась съемка 10 «полей зрения» при различном увеличении.
Оценка соотношения типов коллагена (ТК) основывалась на отличиях в цветовой гамме, характерной для каждого типа и переходных форм: I тип коллагена – красный, III тип коллагена – зеленый. Определение соотношения коллагена I и III типов осуществлялось с использованием программного комплекса AltamiStudio 3.0 и ImageJ 1,47a на основании изучения цветовой гистограммы выбранного участка в каждом «поле зрения». Выделение цветовых диапазонов проводилось на основе гистограммы каждого из цветов. Абсолютные значения красного и зеленого цветов спектра, получаемые посредством визуально-программных комплексов для каждого поля зрения, переводились в относительные с учетом стандартного отклонения. В последующем рассчитывалась величина соотношения ТК.
Молекулярно-генетические методы
Для анализа полиморфизма – 1562 C/TMMP9C-1562T была произведена амплификация фрагментов промоторной области данного гена с использованием следующих праймеров: прямой – 5’ GCCTGGCACATAGTAGGCCC 3’, обратный праймер – 5’ CTTCCTAGCCAGCCGGCATC 3’. Условия ПЦР были следующие: 2 минуты денатурации при температуре 95 °C, далее 35 циклов 95 °C − 30 с, 58 °C − 30 с, 72 °C − 30 с, заверщающий шаг 72 °C в течении 10 минут. Продукты ПЦР-реакции были визулизированы в трансиллюминаторе под ультрафиолетовым светом после электрофореза на 1,5 % агарозном геле с добавлением бромистого этидия. Для ПДРФ анализа была использована растриктаза SphI. Рестрикция производилась при 37 °C в течение 10 часов. Для разделения продуктов рестрикции производился электрофорез на 3 % агарозном геле в течение 40 минут. Аллель С имела 1 фрагмент длиной 460 п.н., аллель T имела 2 фрагмента длиной 258 + 202 п.н., гетерозиготные особи имели комбинацию из всех 3 фрагментов – 460, 258, 202 п.н.
Для анализа полиморфизма MMP3-1171 5A- > 6A была произведена амплификация фрагментов промоторной области данного гена с использованием следующих праймеров: прямой – 5’-GGTTCTCCATTCCTTTGATGGGGAAGA-3’, обратный праймер – 5’-CTTCCTGGAATTCACTATGCCACCACT-3’. Условия ПЦР были следующие: 5 минут денатурации при температуре 94 °C, далее 35 циклов 94 °C − 45 с, 66 °C − 45 с, 72 °C − 45 с, заверщающий шаг 72 °C в течение 15 минут. Продукты ПЦР-реакции были визулизированы в трансиллюминаторе под ультрафиолетовым светом после электрофореза на 3 % агарозном геле с добавлением бромистого этидия. Для ПДРФ-анализа была использована растриктаза Tth111I. Рестрикция производилась при 60 °C в течение 10 часов. Для разделения продуктов рестрикции производился электрофорез на 1,5 % агарозном геле в течение 40 минут. Аллель 5A имела 1 фрагмент длиной 129 п.н., аллель 6А имела 2 фрагмента длиной 97 + 32 п.н., гетерозиготные особи имели комбинацию из всех 3 фрагментов – 129, 97 и 32 п.н.
Амплификация производилась методикой ПЦР-ПДРФ. Амплификацию проводили на многоканальном термоциклере «Терцик» (НПО «ДНК-Технология», Москва). С целью оптимизации ПЦР для каждой пары праймеров рассчитывали оптимальный температурно-временной режим отжига и подбирали соответствующую концентрацию MgCl2.
Статистические методы
Для оценки соответствия распределений генотипов и для сравнения частот аллелей и генотипов в выборках больных и здоровых людей использовали критерий Хи-квадрат Пирсона с поправкой Йетса на непрерывность. Ожидаемую гетерозиготность рассчитывали по Nei, также расчитывали относительное отклонение ожидаемой гетерозиготности от наблюдаемой.
Для сравнения частот аллелей и генотипов между группами больных и здоровых людей также использовали критерий Хи-квадрат с поправкой Йетса на непрерывность [Пузырев, Фрейдин и др., 2009]. Об ассоциации аллелей или генотипов с предрасположенностью к послеоперационному грыжеобразованию судили по величине отношения шансов (OR).
Во всех случаях уровень статистической значимости принимали за 95 % (р < 0,05).
Обработку результатов исследования проводили с помощью встроенных функций ЭВМ приложения MicrosoftExel-2010, Statistica 6.0.
Результаты исследования и их обсуждение
В ходе проведенного гистологического исследования с использованием поляризационной микроскопии получены результаты по процентному соотношению содержания коллагенов I и III типов в образцах апоневроза у больных с ВГ и у больных без них. В табл. 1 приведены значения процентного содержания обоих коллагенов.
В группе пациентов с вентральными грыжами содержание коллагена I типа составило 52,35 ± 2,97 %, III типа – 47,65 ± 2,97 %.
Таблица 1
Характеристика коллагена I и III типа в апоневрозе у больных 1 и 2 групп
|
Коллаген I типа |
Коллаген III типа |
Соотношение коллагена I и III типа |
|
|
1 группа (больные с ВГ) N = 46 |
52,35 ± 2,97* |
47,65 ± 2,97* |
1,11 ± 0,15 |
|
2 группа (больные без ВГ) N = 49 |
69,11 ± 2,68* |
30,89 ± 2,68* |
2,27 ± 0,3 |
Примечание. «*» – различия достоверны, р < 0,05.
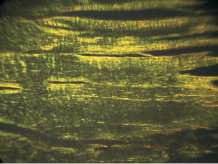
Рис. 1. Микроскопическая картина участка апоневроза у больного с ВГ. Поляризационная микроскопия. Окраска SiriusRed. Объектив ×400
Соотношение типов коллагена в апоневрозе у больных с ВГ составляет 1,11 ± 0,15, что значительно ниже уровней коллагена у пациентов без вентральных грыж.
При поляризационной микроскопии гистологического препарата апоневроза у больных 2 группы было выявлено, что содержание коллагена I типа составило 69,11 ± 2,68 %, а III типа 30,89 ± 2,68 %. Коэффициент соотношения типов коллагена I/III 2,27 ± 0,3, что значительно больше в сравнении с группой № 1.
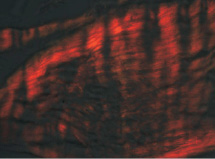
Рис. 2. Микроскопическая картина участка апоневроза у больного без ВГ. Поляризационная микроскопия. Окраска SiriusRed. Объектив ×400
На рис. 3 представлена диаграмма, отражающая отношение коллагенов I и III типов.
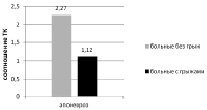
Рис. 3. Соотношение коллагена I и III типа в апоневрозе у больных без ВГ и с ВГ
У больных с вентральными грыжами отмечается достоверное снижение соотношения типов коллагена в препарате апоневроза в сравнении с больными без грыж. Так, соотношение коллагена в апоневрозе у больных без грыж составил 2,27, а у больных с грыжами – 1,12.
Для адекватного и достоверного проведения молекулярно-генетического исследования полученные частоты генотипов подверглись анализу на популяционное равновесие Харди−Вайнберга. Анализ проводился раздельно во 3-й и 4-й группах. Результаты данного анализа представлены в табл. 2 и 3.
Таблица 2
Распределение частот генотипов и значения гетерозиготности по полиморфным вариантам генов в группе № 4
|
Ген |
Полиморфизм и его локализация в гене |
Генотип |
Распределение генотипов |
Уровень гетерозиготности |
χ2, (p) |
||
|
Ho |
He |
||||||
|
MMP3 |
1171 5A/6A |
–1171 5A5A |
80 |
51,9 % |
0,390 |
0,402 |
0,32 (p > 0,05) |
|
–1171 5A6A |
60 |
39,0 % |
|||||
|
–1171 6A6A |
14 |
9,1 % |
|||||
|
MMP9 |
1562 C/T |
–1562 CC |
99 |
76 % |
0,215 |
0,227 |
0,36 (p > 0,05) |
|
–1562 CT |
28 |
21 % |
|||||
|
–1562 TT |
3 |
3 % |
|||||
Примечания:
Ho – наблюдаемая;
He – ожидаемая гетерозиготность;
χ2 Пирсона и достигнутый уровень значимости для теста на РХВ (df = 1).
Таблица 3
Распределение частот генотипов и значения гетерозиготности по полиморфным вариантам генов в группе № 3
|
Ген |
Полиморфизм и его локализация в гене |
Генотип |
Распределение генотипов |
Уровень гетерозиготности |
χ2, (p) |
||
|
Ho |
He |
||||||
|
MMP3 |
1171 5A/6A |
–1171 5A5A |
46 |
35,9 % |
0,469 |
0,484 |
0,1 (p > 0,05) |
|
–1171 5A6A |
60 |
46,9 % |
|||||
|
–1171 6A6A |
22 |
17,2 % |
|||||
|
MMP9 |
1562 C/T |
–1562 CC |
95 |
79,8 % |
0,168 |
0,195 |
2,17 (p > 0,05) |
|
–1562 CT |
20 |
16,8 % |
|||||
|
–1562 TT |
3 |
13,4 % |
|||||
Примечания:
Hо – наблюдаемая;
He – ожидаемая гетерозиготность;
χ2 Пирсона и достигнутый уровень значимости для теста на РХВ (df = 1).
В обеих группах по обоим полиморфизмам двух генов распределение частот генотипов соответствовало критерию Харди−Вайнберга.
Далее был проведен сравнительный анализ частот аллелей и частот генотипов в обеих выборках и их сравнительный анализ между собой. Получены отношения шансов (OR).
Из табл. 4 следует, что частоты аллелей по полиморфизму MMP3-1171 5A- > 6A между группами № 3 и 4 имели статистически достоверные различия, отношение шансов составило 8,5 при CI 1,2–2,43. По полиморфизму MMP9C-1562T статистически достоверных различий между частотами диких и мутантных аллелей выявлено не было.
Таблица 4
Сравнительная характеристика частот аллелей полиморфизмов генов MMP 3 и MMP9 в группах № 3 и 4
|
Ген |
Полиморфизм |
Аллели |
Частоты аллелей |
Критерий различий χ2, (p) |
OR (CI 95 %) |
|||
|
n |
Группа № 3 |
n |
Группа № 4 |
|||||
|
MMP3 |
–1171 5A- > 6A |
–1171 5А |
128 |
0,609 |
154 |
0,727 |
8,5 (0,001)* |
1,71 (1,20–2,43) |
|
–1171 6А |
0,391 |
0,273 |
||||||
|
MMP9 |
C-1562T |
–1562 C |
119 |
0,890 |
130 |
0.869 |
0,32 (0,57) |
0,83 (0,48–1,42) |
|
–1562 T |
0,110 |
0,131 |
||||||
В табл. 5 представлены результаты сравнительного анализа частот генотипов по обоим полиморфизмам в обеих выборках. Из нее следует, что в полиморфизме MMP3-1171 5A- > 6A были найдены статистически достоверные различия. При этом максимальное отношение шансов было по вариантным генотипам, OR = 2,08 (CI 1,01–4,25). По диким генотипам отношение шансов составило 0,52 (CI 0,32–0,84).
По полиморфизму MMP9 1562 C/T статистически достоверных различий по частотам генотипов выявлено не было. Отношение шансов для диких генотипов составило 1,12, для гетерозиготных особей − 0,76. Для диких генотипов отношение шансов достигало 2,04.
Таблица 5
Сравнительная характеристика частот генотипов полиморфизмов генов MMP 3 и MMP9 в группах № 3 и 4
|
Ген |
Полиморфизм |
Генотипы |
Частоты генотипов |
Критерий различий χ2, (p) |
OR (95 % CI) |
|||
|
n |
Группа № 3 (%) |
n |
Группа № 4 (%) |
|||||
|
MMP3 |
–1171 5A- > 6A |
–1171 5A5A |
128 |
35,9 |
154 |
51,9 |
7,25 (0,01)* |
0,52 (0,32-0,84) |
|
–1171 5A6A |
46,9 |
39,0 |
7,29 (0,18) |
1,38 (0,86-2,22) |
||||
|
–1171 6A6A |
17,2 |
9,1 |
4,11 (0,04)* |
2,08 (1,01-4,25) |
||||
|
MMP9 |
C-1562T |
–1562 CC |
113 |
79,8 |
130 |
55,8 |
0,69 (0,41) |
0,77 (0,7-2,38) |
|
–1562 CT |
16,8 |
35,1 |
0,83 (0,36) |
0,74 (0,39-1,41) |
||||
|
–1562 TT |
13,4 |
9,1 |
0,01 (0,9) |
1,1 (0,22-5,58) |
||||
В результате проведенного исследования были получены достоверные различия по содержанию коллагена I и III типов в апоневрозе у больных с вентральными грыжами и у больных без грыжевой болезни. В группе больных с вентральными грыжами содержание коллагенов обоих типов было примерно одинаковым. У лиц группы № 2 преобладал коллаген I типа, при этом соотношение типов коллагенов было более 2, а в группе с грыжами соотношение незначительно превышало 1.
По полиморфизмам матриксных металлопротеиназ были выявлены статистически достоверные различия между больными с вентральными грыжами (группа № 3) и пациентами без вентральных грыж (группа № 4) по полиморфизму –1171 5A- > 6A гена MMP3, что может свидетельствовать о достоверной вовлеченности данного полиморфизма в развитие послеоперационных грыж у человека.
В структуре полиморфизма MMP9 C-1562T достоверных различий между группой больных с послеоперационными вентральными грыжами и у пациентов без ВГ не установлено.
В связи с тем, что матриксная металлопротеиназа 3 в норме участвует в разрушении ряда коллагенов, мы предполагаем, что мутация в этом гене может вызывать неадекватное разрушение коллагенов (или избыточное, или недостаточное). Учитывая полученные результаты гистологического исследования, где мы видим достоверное снижение соотношение коллагенов 1 и III типов, что может быть обусловлено либо снижением количества коллагена I типа, либо повышением количества коллагена III типа. Вероятно, мутантный аллель 6А полиморфизма –1171 5A- > 6A гена ММР3 оказывает избыточное влияние на разрушение I типа коллагена, или же снижена его деградирующая способность к коллагенам III типа, что приводит к увеличению количества последних в апоневрозах у больных с вентральными грыжами, что в свою очередь приводит к снижению прочности апоневроза и является риском развития вентральной грыжи.
Наличие мутантного генотипа-1171 6А6А гена матриксной металлопротеиназы 3 является одним из факторов патогенеза вентральных грыж и может служит прогностическим признаком развития исследуемой патологии.
Рецензенты:
Полоников А.В., д.м.н., профессор кафедры биологии, медицинской генетики и экологии Курского государственного медицинского университета Минздрава России, г. Курск;
Солодилова М.А., д.м.н., профессор кафедры биологии, медицинской генетики и экологии Курского государственного медицинского университета Минздрава России, г. Курск.
Работа поступила в редакцию 18.01.2013.



