Лектины – класс белков, способных быстро, избирательно и обратимо связываться с сахарами [6]. Когда-то считалось, что лектины присутствуют лишь у растений, но оказалось, что они распространены в природе повсеместно [8, 9]. Лектины обнаруживаются на клеточной поверхности, где они предназначены для взаимодействия с углеводами соседних клеток [6, 10, 11]. Лектины могут быть классифицированы на основе их углеводной специфичности. Большинство тканей позвоночных животных содержат растворимыe лактоза-связывающиe или галактоза-связывающие лектины [1, 4, 5, 7, 11].
Несмотря на обширный (состоящий из нескольких сот наименований) список лектинов, включающий не только природные, но и рекомбинантные лектины [12], поиск новых углеводсвязывающих белков не прекращается. Это обусловлено рядом причин, среди которых важнейшие − это поиск доступных источников, легко очищаемых лектинов и поиск новых специфичностей, т.к. известно [6, 12], что лектины различают не только разные моносахариды, но и разные олигосахариды, что делает их незаменимыми реагентами в химии белков.
Целью нашего исследования стал поиск, идентификация и характеристика лектина из экстракта бодяги речной (семейство Spongillidae).
Материалы и методы исследования
В работе использовано 1000 г высушенной и измельченной массы бодяги речной, собранной в июле-августе 2008 г. в дельтовых районах Астраханской области. Химикаты и реагенты, используемые в работе, были аналитической степени чистоты. Экстракт Spongilla готовили на 0,3 М растворе хлорида натрия. Конечная концентрация сухого вещества в экстракте составила 2,4 %. Содержание общего белка в надосадочной жидкости составило 2,96 г на 100,0 г сухого вещества.
Агглютинационный тест был проведен с помощью трипсинизированных (500 μg/мл) кроличьих эритроцитов (2 % суспензии в PBS) [3, 5]. Двухкратные серийные разведения 50 μl раствора лектина на 0,3 Μ NaCl были инкубированы с 50 μl эритроцитарной суспензии в микротирационной планшете в течение 30 мин при комнатной температуре (25 °C) и были оценены под микроскопом. Сила лектина была определена как агглютинационная единица (HAU) (haemagglutination unit), принятая как последнее разведение, которое давало агглютинацию. Удельная активность лектина была выражена в HAU на мг белка. Количественную характеристику углеводной специфичности лектинов дает минимальная концентрация углевода, угнетающая активность лектина на 50 %. Для определения минимальной угнетающей концентрации углевода готовили серию его последовательных двухкратных разведений, начиная с 0,3 М. В каждую лунку вносили по 0,05 мл раствора экстракта бодяги и через 30 мин к смеси добавляли 0,05 мл 2 % суспензии эритроцитов, оставляли на 30 мин и затем определяли гемагглютинацию. По мере снижения концентрации углевода в определенной лунке ряда наблюдается появление гемагглютинации. Отмечают последнюю лунку, в которой еще отсутствует агглютинация, и определяют содержание в ней углевода, исходя из расчета, что в первой она равна 0,1 М.
Результаты исследования и их обсуждение
Исследование углеводной специфичности лектина начинали с определения сахара, связываемого лектином. В лунках, где отсутствует агглютинация эритроцитов, находится углевод, который взаимодействует с лектином. Всего в работе использовали растворы 11 сахаров (D-галактоза, D-глюкоза, D-манноза, D-глюкозамин, Метил-альфа-D-галактоприанозид, N-Ацетил-галактозамин, L-фукоза, Альфа-D-фукоза, D-галактопиранозил-D-глюкоза, все – Sigma). Агглютинационный тест показал, что ингибирование агглютинации эритроцитов наблюдалось в присутствии растворов галактозы и лактозы (D-галактопиранозил-D-глюкоза), а также раствора Метил-альфа-D-галактопиранозида и в значительно меньшей степени ацетилгалактозамина и L-фукозы. Присутствие других сахаров не отражалось на способности экстракта бодяги аггглютинировать эритроциты кролика. В табл. 1 приведены данные теста гемагглютинации.
Для определения концентрации углевода, подавляющего активность лектина на 50 %, титрование проводили при постоянной концентрации углевода и прогрессивно снижающейся концентрации экстракта бодяги. По графикам, отражающим зависимость титра лектина от содержания углевода, определяли концентрацию углевода, угнетающего активность лектина на 50 %. Такое исследование было проведено для 3 сахаров, показавших наибольшую агглютинационную способность (галактозы, лактозы и Метил-альфа-D-галактопиранозида). Полученные константы равновесия приведены в табл. 2.
Таблица 1
Гемагглютинационный тест
|
№ п/п |
Сахар |
Ингибирующая концентрация (mM) |
|
1 |
D-галактоза |
0,05 |
|
2 |
D-глюкоза |
≥ 100 |
|
3 |
D-манноза |
100 |
|
4 |
D-глюкозамин |
100 |
|
5 |
Метил-альфа-D-галактопиранозид |
1,9 |
|
6 |
N-Ацетил-галактозамин |
12,5 |
|
7 |
L-фукоза |
50 |
|
8 |
Альфа-D-фукоза |
≥ 100 |
|
9 |
D-галактопиранозил-D-глюкоза (лактоза) |
0,0012 |
|
10 |
N-Ацетил-глюкозамин |
≥ 100 |
|
11 |
Миоинозит |
≥ 100 |
Таблица 2
Константы связывания (равновесия) лектина из бодяги речной
|
№ п/п |
Сахар |
Константа равновесия |
|
1 |
D-галактоза |
1,8∙10–2 |
|
2 |
D-галактопиранозил-D-глюкоза |
3,24∙10–4 |
|
3 |
Метил-альфа-D-галактопиранозид |
6,1∙10–1 |
Из этих данных следует, что лектин бодяги относится к галактозоспецифическим лектинам. Причем его олигосахаридная специфичность направлена на D-галактопиранозил-D-глюкозу (лактозу). Судя по константам равновесия, специфичность лектина бодяги речной по отношению к лактозе почти в 200 раз выше, чем по отношению к D-галактозе.
Очистка и характеристика лектина бодяги. На первой стадии экстракт бодяги фракционировали осаждением сульфатом аммония. Показано, что при 40 % насыщения сульфата аммония в осадке оказывается чуть более 80 % агглютинационной активности (табл. 3). Первичный экстракт бодяги смешивали с насыщенным раствором сульфата аммония в соотношении 6:4. Белковый раствор экспонировали 8–10 часов при температуре 40С и затем центрифугировали при 15000 g в течение 40 минут. Осадок, содержащий исследуемые белки, растворяли в минимальном объеме 0,05 М трис-солянокислого буфера с рН 7,4.
На следующей стадии полученный осадок наносили на колонку Toyoperl HW-75 (115∙3,5 см). Скорость потока была скорректирована до 12 мл/ч с использованием перистальтического насоса P-l (Фармация) и фракции по 3 мл каждая, были собраны на коллекторе фракций FRAC-100 (Pharmacia). После теста на агглютинационную активность активные фракции были объединены и лиофилизированы.
Далее полученный сухой порошок растворяли в 30 мМ трис-буфере pH 7,5, содержащем 0,1 М NaCl и раствор белка, перистальтическим насосом наносили на колонку с TSK-GEL DEAE-Toyopearl 650, предварительно уравновешенную тем же буфером. После нанесения пробы колонку промывали 3-кратным объемом этого же буфера. При указанных условиях лектин бодяги не связывается с анионообменником и выходит в стартовом объеме, что подтверждается агглютинационным тестом (см. табл. 3). После диализа против трис-HCl буфера рН = 6,7 полученную фракцию наносят на колонку, содержащую СМ-Toyopearl 650, уравновешенный тем же буфером. Элюцию лектина проводят ступенчатым градиентом хлористого натрия. Фракции собирают под контролем проточного детектора при длине волны 280 нм. Наибольшая агглютинационная активность проявляется во фракции, содержащей 0,25 М хлористого натрия, но также заметная активность (в среднем 2675,0 HAU/мг белка) наблюдалась во фракции, содержащей 0,3 М хлористого натрия. Для окончательной очистки фракцию 0,25 М диализовали, концентрировали и подвергали обращеннофазной хроматографии на Силосорбе С-12 в линейном градиенте ацетонитрила (рисунок). Пик L, выходящий на 10,9 минуты, содержал основную массу агглютинационной активности. Конечный выход продукта составил 19,6 % при степени очистки 308 (см. табл. 3).
Таблица 3
Очистка лектина бодяги речной
|
№ п/п |
Манипуляция |
Общий белок (мг) |
HAU |
HAU/мг белка |
Степень очистки |
Выход в % |
|
1 |
Исходный экстракт |
9763,0 |
8933100,0 |
904,8 |
100 |
|
|
2 |
Осадок 40 % насыщения сульфатом аммония |
4397,2 |
7242200,0 |
1947,6 |
2,15 |
81,1 |
|
3 |
Гель-фильтрация Toyoperl HW-75 |
1624,0 |
6110200,0 |
3762,5 |
4,2 |
68,4 |
|
4 |
Ионообменная хроматография TSK-GEL DEAE-Toyopearl 650 |
967,5 |
5306300,0 |
11350,2 |
12,6 |
59,4 |
|
Ионообменная хроматография СМ-Toyopearl 650 |
30,8 |
2150750,0 |
69934,2 |
77,3 |
24,0 |
|
|
5 |
Обращеннофазная хроматография |
6,3 |
1750560,0 |
278684,3 |
308,0 |
19,6 |
Температурная инактивация лектина бодяги изучалась путем инкубации образцов при различных температурах в течении 10 мин. Показано, что агглютинационная активность препарата лектина бодяги практически не изменялась при температурах до 60 °С. При температуре в 60 °С агглютинационная активность снижалась на 50 %, а при 75 °С − на 90 %.
РН-зависимость лектина бодяги изучалась с использованием буферов, начиная от pH 1–10. В качестве буферов были использованы: 0∙1Ν HCl pH 1; 50 мм глицин-HCl pH 2 и 3; 50 мм Na-ацетат-уксусная кислота pH 4 и 5; 50 мм малеиновой кислоты-NaOH для pH 6; 50 мм Трис-HCl pH 7 и 8; и 50 мм глицин-NaOH для pH 9 и 10. Препарат лектина в объеме 50 μl инкубировали с 50 μl буфера в течение 1 ч при комнатной температуре. Показано, что наиболее активен лектин при pH между pH 4,5 и 6,5. Лектин потерял 50 % агглютинационной активности между pH 7,5–8,0 и около 90 % деятельности при pH 8,5. Лектин был полностью неактивен при рН 3,0 и 9,0.
Таким образом, выделен и охарактеризован галактозоспецифический лектин бодяги речной, обладающий оптимумом рН от 4,5 до 6,5 и устойчивый к температурной денатурации до 60 °С.
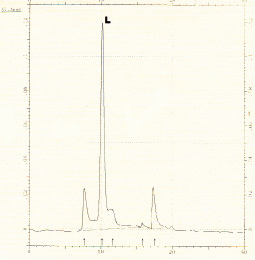
Высокоэффективная жидкостная хроматография фракции экстракта бодяги.L – пик, содержащий лактозоспецифический лектин бодяги
Рецензенты:
Никулина Д.М., д.м.н., профессор, заведующая кафедрой биологической химии с курсом лабораторной диагностики, ГБОУ ВПО «Астраханская государственная медицинская академия», г. Астрахань;
Молдавская А.А., д.м.н., профессор кафедры анатомии человека, ГБОУ ВПО «Астраханская государственная медицинская академия», г. Астрахань.
Работа поступила в редакцию 11.01.2013.



