Белая жировая ткань играет главную роль в поддержании энергетического гомеостаза организма при голодании и физической нагрузке за счет липолиза запасенных триглицеридов. В результате липолиза происходит расщепление триглицеридов и высвобождение жирных кислот и глицерола. Эволюционно этот процесс обеспечивает выживание в условиях длительного отсутствия пищи. Жировая ткань является важным метаболическим органом, который играет решающую роль в инсулиновой чувствительности и энергетическом гомеостазе всего организма [10]. Жировые клетки секретируют несколько типов адипокинов, которые регулируют физиологические процессы во всем организме (включая метаболизм глюкозы, аппетит, воспалительные ответы, ангиогенез, давление и репродуктивную функцию). При ожирении наблюдаются нарушения в экспрессии адипокинов и утилизации глюкозы и липидов, поступающих из пищи, что способствует развитию гипергликемии, гиперлипидемии, инсулиновой резистентности и хроническому воспалению [12]. Таким образом, дисфункция белой жировой ткани при ожирении является важным фактором в патогенезе диабета 2-го типа (D2Т) и других метаболических болезней. Два противоположных процесса, липогенез и липолиз, участвуют в энергетическом гомеостазе. В результате липогенеза клетка запасает триглицериды. Длинноцепочечные неэтерифицированные жирные кислоты (предшественники триглицеридов) образуются:
1) в результате гидролиза липопротеинов плазмы;
2) за счет синтеза de novo в адипоцитах;
3) за счет реутилизации образовавшихся свободных жирных кислот в результате липолиза [1; 3; 15].
Другим предшественником триглицеридов является глицерол 3-фосфат. Глицерол 3-фосфат образуется в основном из глюкозы, которая поступает в адипоциты с помощью инсулин-стимулированного транспортера (GLUT4). Симпатическая нервная система и нейротрансмиттер норадреналин (НА) играют важную роль в регуляции липолиза в белой жировой ткани [11]. В данной работе исследована интенсивность липогенеза и чувствительность к норадреналину культивируемых адипоцитов белой жировой ткани, выделенных у животных с ожирением и диабетом 2-го типа.
Материалы и методы исследования
Для индукции ожирения у грызунов использовали диету с высоким содержанием жира (20 г жира на 100 г корма, 7,74 кДж/г). Контрольных животных содержали на стандартной лабораторной диете (10 г жира на 100 г корма, 3,29 кДж/г). Для быстрого развития диабета 2-го типа (D2Т), характеризующегося инсулиновой резистентностью, животным вводили внутрибрюшинно стрептозотацин для подавления β-клеток поджелудочной железы (STZ, 50−100 мг/кг). Животных использовали в эксперименте спустя 2–3 недели после введения STZ. Состояние животных характеризовалось снижением концентрации инсулина на 20–30 % в сравнении с контролем, и 2–3-кратным повышением концентрации глюкозы, жирных кислот и триглицеридов, а также увеличением TNFα и CRP на 30–40 %. В экспериментах использовали первичную культуру белых адипоцитов мыши на 9 день культивирования (9 DIV), полученную из мезенхимальной фракции стволовых клеток эпидидимального жирового депо в соответствии с общепринятой методикой [13]. Для изучения накопления жировых включений белыми адипоцитами производили окраску клеток с помощью зонда Oil Red (Fluka). После промывки клеточной культуры белых адипоцитов фосфатным буфером (PBS) производили фиксацию клеток 10 % раствором формальдегида в течение 1 часа. Далее клетки трижды отмывали PBS, добавляли Oil Red и в течение 1 часа инкубировали при 37 °С. После чего зонд отмывали и культура клеток высушивалась в течение 15–20 минут. Измерение динамики цитозольного кальция ([Ca2+]i) проводили с помощью системы анализа изображений «Cell observer» (Carl Zeiss, Германия), на базе моторизованного микроскопа Axiovert 200M с высокоскоростной черно-белой CCD-камерой AxioCam HSm. Источником света служила ртутная лампа НВО 100. Возбуждение флуоресценции Fura-2 проводили при двух длинах волн (340 и 387 нм) с использованием запирающих светофильтров BP 340/30 и BP 387/15.
Результаты исследования и их обсуждение
Липогенез. К предшественникам триглицеридов, запасаемых в жировых депо адипоцитов, относятся длинноцепочечные неэстерифицированные (свободные) жирные кислоты и глицерол-3-фосфат. Внутриклеточный глицерол-3-фосфат образуется в основном из глюкозы, транспортируемой в адипоциты переносчиком GLUT-4, активность которого инициируется инсулином. На рис. 1 (верхний ряд) представлены культуры адипоцитов (3 DIV, 5 DIV, 9 DIV), выделенные у мышей с D2Т. Адипоциты на 9 день культивирования являются дифференцированными клетками. Окрашивание жировых пулов адипоцитов красителем (Oil red) показало, что в культуре, полученной из животных с диабетом 2-го типа, не происходит формирование триглицеридных пулов при использовании глюкозы в качестве субстрата (рис. 1, верхний ряд). Длинноцепочечная кислота (16:0) пальмитоил-карнитин относится к предшественникам триглицеридов, транспортируемых в клетку мембранным переносчиком. На рис. 1 (нижний ряд) показано, что культивирование адипоцитов в присутствии 10 мМ глюкозы и 100 нМ пальмитоил-карнитина инициировало образование и накопление жировых капель в клетках.
Изменение [Ca2+]i под действием норадреналина. Симпатическая нервная система и нейротрансмиттер норадреналин (НА) играют важную роль в процессе липолиза в белой жировой ткани [11]. Воздействие НА на функции жировой клетки является комплексным и активирует не только различные подтипы адренорецепторов, но и различные системы трансдукции сигнала. Считается, что НА стимулирует липолиз через активацию β-адренорецепторов, сопряженных со стимуляцией аденилатциклазы, синтезом сАМР, активацией протеинкиназы А, ключевых липаз ATGL (жировая триглицеридлипаза) и HSL (гормонально чувствительная липаза), и фосфорилированием перилипина (белка, расположенного на поверхности жировых депо и защищающего триглицериды от липолиза). Однако стимуляция липолиза норадреналином сохраняется и у мышей с нокаутом β1/β2/β3-адренорецепторов [11] и, возможно, реализуется с участием α-адренорецепторов, активация которых может сопровождаться изменением концентрации Са2+. Изменение [Ca2+]i под действием норадреналина в адипоцитах (9DIV) показано на рис. 2. На рис. 2 представлены Са2+-ответы адипоцитов, выделенных из разных животных: в норме (1), тучных (2) и с диабетом 2-го типа (3). Амплитуда Са2 + -ответа на норадреналин у тучных животных ниже в (4–12) раз по сравнению с контрольными животными, а у мышей с D2T Са2+-ответ практически отсутствует даже для очень высоких концентраций НА (рис. 2,а).
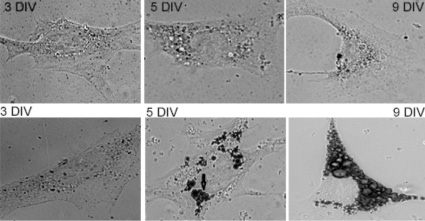
Рис. 1. Жировые пулы культивируемых адипоцитов мышей с D2T в разные сроки культивирования (3DIV, 5DIV, 9DIV). Окраска Oil red. Верхний ряд – культивирование клеток с 10 мМ глюкозы. Нижний ряд – культивирование клеток с 10 мМ глюкозы и 100 нМ пальмитоил-карнитина
Известно, что пальмитоил-карнитин и пальмитоил-КоА инициируют мобилизацию Са2+ из саркоплазматического ретикулума в скелетных мышцах [4]. Чтобы показать действие пальмитоил-карнитина на Са2+-ответ адипоцитов при аппликации НА, адипоциты здоровых и больных животных, начиная с 3-го дня, культивировали в присутствии 100 нМ пальмитоил-карнитина. Как следует из рис. 3, присутствие пальмитоил-карнитина в среде культивирования привело к восстановлению Са2+-ответа на НА в адипоцитах (9DIV), полученных из тучных животных и животных с Д2Т.
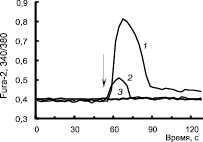
Рис. 2. Изменение [Ca2 + ]i под действием 100мкМ норадреналина в адипоцитах, выделенных у мышей в норме (1), с ожирением (2) и Д2Т (3)
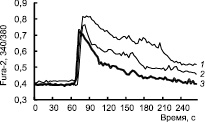
Рис. 3. Изменение [Ca2 + ]i под действием 100мкМ норадреналина в адипоцитах, выделенных у мышей в норме (1), с ожирением (2) и Д2Т (3) при добавлении в среду культивирования 100 нМ пальмитоил-карнитина
Таким образом, полученные данные свидетельствуют в пользу того, что в условиях D2T наряду с инсулиновой резистентностью, приводящей к ухудшению транспорта глюкозы в клетки и подавлению синтеза жирных кислот de novo, наблюдается и резистентность к норадреналину, которая снимается при добавлении в среду культивирования пальмитоил-карнитина. Одной из важных физиологических функций адипоцитов белого жира является способность запасать энергию в виде триглицеридов, необходимую другим тканям при голодании и физической нагрузке [7]. В настоящей работе показано, что преадипоциты, выделенные у мышей с D2T, не способны в условиях культивирования в присутствии глюкозы формировать депо триглицеридов и генерировать Са2+-ответ на НА. Эффекты, по-видимому, связаны с нарушениями в транспорте глюкозы. Транспорт глюкозы в адипоцитах обеспечивается транспортером GLUT4, транслокация которого на плазматическую мембрану инициируется инсулином. При D2T имеет место резистентность к инсулину, которая вызывает нарушения в сигнальном пути IR → IRS → PI3K → PI(4,5)P3 → PKB, связанные с недостаточными фосфорилированием первых четырех компонентов и активацией PKB и оказывающие негативное влияние на транслокацию транспортера GLUT4. Для ряда клеток известно, что транслокация GLUT4 и транспорт глюкозы увеличиваются при активации АМР-киназы [9; 16; 6]. Одним из активаторов АМР-киназы, энергетического сенсора, поддерживающего баланс AMP:ATP соотношения, является пальмитат [2; 5; 14]. Также показано, что такие производные длинноцепочечных жирных кислот, как пальмитоил-карнитин и пальмитоил-КоА, в микромолярных концентрациях стимулируют связывание ‘Н-рианодина и вызывают мобилизацию Са2+ из саркоплазматического ретикулума скелетных мышц млекопитающих. Увеличение [Ca2+]i и AMP (при уменьшении клеточного АТР) приводит к синергичной активации АМР-киназы [4; 8].
Эндоплазматический ретикулум не только играет центральную роль в липидном и белковом биосинтезе, синтезирует почти все секретируемые белки и продуцирует трансмембранные белки и липиды для большинства клеточных органелл, но и играет важную роль в регуляции [Ca2+]i. Как следует из результатов, полученных в данной работе, активация адипоцитов (9DIV), выделенных у животных с диабетом 2-го типа, норадреналином недостаточна для генерации Ca2+ транзитного ответа. Добавление в среду культивирования пальмитоил-карнитина восстанавливало способность адипоцитов генерировать Са2+-ответ на норадреналин и важную физиологическую функцию запасания триглицеридов.
Заключение
В данной работе показано, что наряду с инсулиновой резистентностью в клетках белого жира в условиях ожирения и диабета 2-го типа наблюдается резистентность к адренергической стимуляции. Кальциевый ответ адипоцитов, полученных из тучных животных и мышей с индуцированным диабетом 2-го типа на аппликацию различных концентраций норадреналина, значительно снижен или отсутствует.
Работа выполнена при финансовой поддержке Программы № 7 Президиума РАН (проект № 01201258223); Министерства образования и науки Российской Федерации (ГК 16.512.11.2092, № 01201179771); ФНМ – проект № 01201256033; РФФИ – № 10-04-01306.
Рецензенты:
Новоселов В.И., д.б.н., профессор лаборатории механизмов рецепции, Институт биофизики клетки РАН (ИБК РАН), г. Пущино;
Асланиди К.Б., д.ф.-м.н., лаборатория регуляции внутриклеточных процессов, Институт теоретической и экспериментальной биофизики РАН (ИТЭБ РАН), г. Пущино.
Работа поступила в редакцию 10.01.2013.



