В последнее время возрастает интерес к исследованию метаболической активности и других ранее неизвестных свойств некоторых биологически активных веществ и гормонов, в частности, хорионического гонадотропина человека (ХГч). Оказалось, что данный гормон способен подавлять развитие некоторых опухолей за счет торможения их пролиферативной активности, стимуляции апоптоза и ингибирования ключевых транскрипционных факторов, что проявляется значимым лечебным эффектом в эксперименте [4, 6, 7]. Применение ХГч для лечения опухолей более эффективно в комбинации с уже известными и апробированными способами лечения, такими как лучевая и химиотерапия. Однако такие разработки малочисленны и представлены в основном исследованиями, выполненными на чувствительных к ХГч клетках, таких как клетки рака молочной железы MCF-7 [6, 7]. Эти клетки имеют на своей мембране рецептор к ХГч, через который и осуществляется биологическое действие гормона. Имеются данные, что ХГч способен действовать и на другие опухолевые клетки, не имеющие достоверного подтверждения наличия рецепторов к нему [1]. Следовательно, исследование совместного влияния ХГч и химиотерапевтических препаратов (цитостатиков) на развитие опухоли, выяснение молекулярных механизмов, лежащих в основе оказываемых эффектов такой терапии, является актуальным.
Материалы и методы исследования
Работа выполнена на культуре клеток эмбриональной рабдомиосаркомы человека (RD). Клетки выращивали в среде ЕМЕМ («Биолот», Россия) с добавлением 5 % фетальной сыворотки и антибиотиков («Биолот», Россия) в пластиковых культуральных флаконах («Orange Scientific», Бельгия). Криоконсервацию и хранение линии проводили в среде жидкого азота на базе криобанка лаборатории криоконсервирования костного мозга и тканей ФГБУН КНИИГиПК ФМБА России. Концентрация клеток для криоконсервации составляла не менее 1∙106 в мл защитной среды (90 % фетальной телячьей сыворотки и 10 % диметилсульфоксида). Полученную клеточную суспензию разливали в криопробирки по 1 мл и подвергали замораживанию в парах жидкого азота (–120...–145 °С). В течение 4 ч клетки находились в парах жидкого азота, после чего переносились в жидкую фазу азота (–196 °С). Для вывода из криоанабиоза клетки размораживали на водяной бане при температуре 37 ± 1 °С, отмывали от консерванта и рассевали по культуральным флаконам.
Влияние ХГч на линию RD изучали при помощи МТТ-теста, апоптозного теста и определения митотической индекса (МИ) клеток. МИ определяли при микроскопическом исследовании культур, выращенных на покровных стеклах в течение 48 часов. По окончанию срока культивирования препараты фиксировали в жидкости Карнуа, окрашивали гематоксилином Вейгарта и заключали в глицерин-желатину. В полученных препаратах подсчитывали количество митозов с последующим расчетом МИ (отношение делящихся клеток к общему числу клеток, в ‰).
МТТ-тест ставили в формате 96-луночных планшетов [3]. Данный тест основан на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид (МТТ) в кристаллический формазан. Детекция результата осуществляется путем измерения оптической плотности лизата в лунках, а результаты прямо коррелируют с числом живых метаболически активных клеток. Лизис клеток осуществляли диметилсульфоксидом, оптическую плотность лизатов измеряли при помощи планшетного фотометра «Organon Tecnica Reader» при длине волны λ = 492 нм. ХГч тестировали в дозах 1,2 и 4 МЕ/мл.В качестве контрольного цитостатического агента использовали эмбихин в концентрациях 2 и 4 мкг/мл. Серии эксперимента распределились следующим образом:
1) контроль, интактные клетки;
2) ХГч 1 МЕ/мл;
3) ХГч 2 МЕ/мл;
4) ХГч 4 МЕ/мл;
5) эмбихин 2 мкг/мл;
6) эмбихин 2 мкг/мл + ХГч 1 МЕ/мл;
7) эмбихин 2 мкг/мл + ХГч 2 МЕ/мл;
8) эмбихин 2 мкг/мл + ХГч 4 МЕ/мл;
9) эмбихин 4 мкг/мл;
10) эмбихин 4 мкг/мл + ХГч 1 МЕ/мл;
11) эмбихин 4 мкг/мл + ХГч 2 МЕ/мл;
12) эмбихин 4 мкг/мл + ХГч 4 МЕ/мл.
В такой схеме эксперимента эмбихин в дозе 4 мкг/мл создавал летальные повреждения клеток, а в дозе 2 мкг/мл – субтоксический эффект. Апоптоз оценивали в тесте с акридиновым оранжевым и бромистым этидием при помощи люминесцентной микроскопии [5]. Серии эксперимента в апоптозном тесте формировали так же, как и в МТТ-тесте. Статистическую обработку данных проводили с помощью программ MS Office Excel 2007 и Statistica 6.0. Достоверность различий оценивали по критерию Манна−Уитни.
Результаты исследования и их обсуждение
Поскольку клетки RD имеют эмбриональное происхождение, они могут иметь рецепторы к ХГч, но этот факт еще не доказан. Данная линия имеет высокие темпы пролиферации, клетки фибробластоподобные, контактное торможение отсутствует. Митотическая активность контрольной серии клеток высокая и составляет 37,22 ± 1,42 ‰, что согласуется с данными литературы [2]. В препаратах с внесением ХГч МИ клеточной культуры достоверно снижался (рис. 1). Так, ХГч в дозе 1, 2 и 4 МЕ/мл снизил МИ по сравнению с контрольной серией до 32,43 ± 1,39 ‰ (р = 0,026); 31,12 ± 1,16 ‰ (р = 0,006) и 30,18 ± 1,02 ‰ (р = 0,001) соответственно.
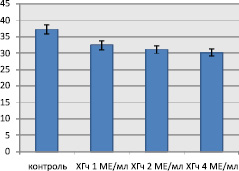
Рис. 1. Митотический индекс культуры при воздействии ХГч
Анализируя данные МТТ-теста для клеток RD, можно сделать вывод о том, что ХГч обладает угнетающим (р < 0,06 для групп ХГч 2 и 4 МЕ/мл) действием на жизнеспособность клеток во всех испытанных концентрациях (рис. 2).
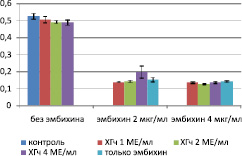
Рис. 2. Оптическая плотность лизата в лунках (МТТ-тест)
При повышении содержания ХГч оптическая плотность лизата в лунках достоверно снижается, при этом коэффициент корреляции между дозой гормона и оптической плотностью лизата составляет r = –0,89. При одновременном использовании с эмбихином гормон проявляет иное свойство. При комбинировании ХГч в дозе 4 МЕ/мл и эмбихина в дозе 2 мкг/мл происходит повышение оптической плотности лизата лунок, что говорит о повышении выживаемости клеток и снижении токсического эффекта эмбихина. При использовании эмбихина в дозе 4 мкг/мл ХГч не проявляет статистически значимого цитотоксического эффекта(р > 0,06).
По результатам апоптозного теста ХГч подавляет рост рабдомиосаркомы RD за счет стимуляции апоптоза (таблица).
Процентное содержание живых, апоптозных и некротических клеток RD в пробах
|
Серия эксперимента |
Живые клетки, % |
Апоптозные клетки, % |
Некротические клетки, % |
Сумма нежизнеспособных клеток, % |
|
Контроль |
90,54 ± 2,05 |
4,16 ± 1,68 |
5,3 ± 1,42 |
9,46 ± 2,05 |
|
ХГч 1 МЕ/мл |
91,44 ± 1,30 |
6,37 ± 1,39 |
2,19 ± 0,79 |
8,56 ± 1,30 |
|
ХГч 2 МЕ/мл |
89,89 ± 2,05 |
7,19 ± 1,58 |
2,92 ± 1,19 |
10,11 ± 2,05 |
|
ХГч 4 МЕ/мл |
92,61 ± 1,74 |
4,13 ± 1,07 |
3,26 ± 1,06 |
7,39 ± 1,74 |
|
ЭМ2 |
11,66 ± 3,25 |
85,3 ± 3,47 |
3,04 ± 1,53 |
88,34 ± 3,25 |
|
ЭМ2 + ХГч1 МЕ/мл |
3,74 ± 1,13 |
96,11 ± 1,10 |
0,15 ± 0,15 |
96,26 ± 1,13 |
|
ЭМ2 + ХГч2 МЕ/мл |
5,00 ± 2,01 |
95,00 ± 2,01 |
отсутствуют |
95,00 ± 2,01 |
|
ЭМ2 + ХГч4 МЕ/мл |
4,69 ± 0,73 |
95,31 ± 0,73 |
отсутствуют |
95,31 ± 0,73 |
|
ЭМ4 |
1,94 ± 0,98 |
98,06 ± 0,98 |
отсутствуют |
98,06 ± 0,98 |
|
ЭМ4 + ХГч1 МЕ/мл |
3,60 ± 1,4 |
96,40 ± 1,40 |
отсутствуют |
96,40 ± 1,40 |
|
ЭМ4 + ХГч2 МЕ/мл |
6,54 ± 1,13 |
93,46 ± 1,13 |
отсутствуют |
93,46 ± 1,13 |
|
ЭМ4 + ХГч4 МЕ/мл |
4,49 ± 0,97 |
95,10 ± 0,97 |
отсутствуют |
9,51 ± 0,97 |
Наибольшей проапоптотической активностью обладает ХГч в дозе 2 МЕ/мл (7,19 ± 1,58 % апоптозных клеток против 4,16 ± 1,68 % в контроле и 6,37 ± 1,39 % при использовании 1 МЕ/мл ХГч). При комбинировании с 2 мкг/мл эмбихина ХГч достоверно повышает содержание апоптозных клеток во всех пробах, при комбинировании с 4 мкг/мл эмбихина не оказывает статистически значимого цитотоксического эффекта (р > 0,06).
Таким образом, ХГч обладает угнетающим действием в отношении клеток саркомы RD за счет индукции апоптоза. Тем не менее увеличение содержания гормона до 4 МЕ/мл в среде культивирования не увеличивает, а снижает долю апоптозных клеток в пробе. Объяснение данному явлению можно дать с позиции оценки метаболизма клеточной культуры. Замедляя процессы метаболизма клеток, гормон препятствует их вступлению в апоптоз, поскольку апоптоз является энергозависимым процессом. По-видимому, действие ХГч на линию RD обусловлено различными мессенджерами G-белков, ответственными за различные процессы – клеточную гибель и коррекцию метаболизма. При этом в низких дозах (1 и 2 МЕ/мл) гормон стимулируют апоптоз, а в высоких (4 МЕ/мл) проявляет себя как ингибитор метаболизма клеток RD, за счет чего количество апоптозных клеток в пробе снижается.
Логично было бы предположить, что ХГч будет усиливать токсическое действие эмбихина, но результаты МТТ-теста свидетельствуют о повышении выживаемости клеток в группе «эмбихин 2 мкг/мл + ХГч 4 МЕ/мл». Оптическая плотность клеточного лизата при использовании ХГч в дозах 1 МЕ/мл (0,140 ± 0,003 у.е.) и 2 МЕ/мл (0,143 ± 0,005 у.е.) снижается по отношению к контрольной группе (0,152 ± 0,012 у.е.), а при использовании 4 МЕ/мл ХГч повышается до 0,197 ± 0,036 у.е. (р > 0,06).
Как известно, цитостатики алкилирующего ряда, к которым относится эмбихин, оказывают воздействие на генетический аппарат клетки. Их цитостатическое и противоопухолевое действие осуществляется за счет метилирования цепей ДНК, в результате чего клетка получает летальные повреждения и вступает в апоптоз. Наибольший эффект такие цитостатики имеют в отношении быстро пролиферирующих низкодифференцированных клеток, так как в процессе митотического деления геномная ДНК становится наиболее уязвимой для модификации – в состоянии дифференцировки клетки ДНК защищена комплексом гистоновых и негистоновых белков, суперспирализована, а репликация мРНК осуществляется только с небольшого количества функционально активных генов. Поэтому торможение метаболической активности клетки или «уход» пролиферирующих клеток в G0-фазу и дифференцировку будет сопровождаться снижением чувствительности клетки к действию цитостатиков, в том числе и алкилирующего ряда.
При повышении дозы эмбихина до 4 мкг/мл ни одна из использованных в работе доз гормона не оказывает статистически значимого эффекта. Вероятно, это связано с тем, что повышение содержания цитостатика в среде культивирования до 4 мкг/мл делает повреждения клеток более выраженными, чем при использовании 2 мкг/мл, что обусловливает невозможность проявления эффектов гормонального воздействия. Клетки RD просто не имеют метаболического потенциала для ответа на гормональное воздействие, и выраженность метаболических изменений клеток будет сравнительно низка для того, чтобы используемым методом оценить различия в экспериментальных сериях.
Выводы
Влияние ХГч на культуру рабдомиосаркомы RD проявляется за счет реализации двух разнонаправленных одновременно существующих механизмов: индукции апоптоза и торможения метаболизма. Наибольший проапоптотический эффект проявляется при содержании 2 МЕ/мл ХГч в культуральной среде. Повышение содержания ХГч в среде до 4 МЕ/мл не ведет к повышению цитотоксического эффекта гормона. При этом комбинирование гормональной (ХГч) и цитостатической (эмбихин) терапии в отношении клеток RD не всегда рационально, хотя по отдельности данные вещества значимо подавляют митотическую активность и метаболизм клеточной линии.
Рецензенты:
Волова Л.Т., д.м.н., профессор, директор Института экспериментальной медицины и биотехнологий ГБОУ ВПО СамГМУ Минздравсоцразвития России, г. Самара;
Маракулин И.В., д.м.н., старший научный сотрудник, ведущий научный сотрудник НИЦ ФБУ 33 ЦНИИИ Минобороны России, г. Киров.
Работа поступила в редакцию 30.11.2012.



