К настоящему времени в литературе накоплены данные, показывающие, что каннабиноиды могут проявлять как антиэпилептические [13, 14], так и нейропротекторные свойства [11]. Эндогенная каннабиноидная система (ЭКС), являясь важным регулятором синаптической активности, вовлечена во множество физиологических функций. ЭКС состоит из двух типов каннабиноидных G протеин-связанных рецепторов (CB1 и CB2), их эндогенных липидных лигандов (эндоканнабиноидов, ЭК) анандамида и 2-арахидонилглицерола (2-АГ), а также ферментов их синтеза, транспорта и деградации [см. обзор 5]. СВ1 рецепторы широко экспрессируются в мозге на терминалях аксонов как тормозных [10], так и возбуждающих нейронов [11]. ЭК синтезируются «по мере надобности» из мембранных предшественников в постсинаптической клетке и, ретроградно активируя пресинаптические СВ1 рецепторы, регулируют активность каналов и выделение нейротрансмиттеров [5]. Анандамид и 2-АГ удаляются из внеклеточного пространства с помощью специфического механизма обратного захвата в нейронах и астроцитах и гидролизуются в клетках посредством гидролазы амидов жирных кислот и моноацилглицерол-липазы соответственно.
Целью настоящей работы было исследование роли ЭКС в регуляции активности различных областей мозга при эпилептическом статусе (вызванном каиновой кислотой, КК), являющемся хорошо изученной моделью височной эпилепсии [1]. Для активации ЭКС применяли ингибитор обратного захвата эндоканнабиноидов, AM404, и ингибитор фермента деградации анандамида (FAAH), URB597.
Материалы и методы исследования
Эксперименты проведены в соответствии с международными нормами этического обращения с животными (Experientia. 1995. 51: 1–5). Опыты были поставлены на трех группах бодрствующих морских свинок. За неделю до начала опытов животным вживляли монополярные электроды в поле СА1 гиппокампа (АР = 6.6; L = 3; H = 5), медиальную септальную область (МСО, АР = 12,2; L = 2; H = 7,5, 15°), энторинальную кору (ЭНК, АР = 4.6; L = 5,5; H = 10,5) и базальное ядро амигдалы (БАМ, AP = 10,2; L = 5; Н = 12.2) для одновременной регистрации полевых потенциалов (ЭЭГ). Все микроинъекции фармакологических препаратов производили в левый боковой желудочек через вживленную канюлю (AP = 8,6; L = 2,5; H = 4,7). У всех животных в течение 3-х дней регистрировали спонтанную ЭЭГ в исследуемых структурах. Затем животным экспериментальных групп («АМ404», n = 6; «URB597», n = 5) однократно вводили ингибитор обратного захвата эндоканнабиноидов АМ404 (3 мкл, 120·10–9 моль) или ингибитор фермента деградации анандамида URB597 (2 мкл, 4,8·10–9 моль), а животным контрольной группы – такой же объем ДМСО («контроль») и регистрировали ЭЭГ после окончания инъекции. Через 3–4 дня животным всех групп вводился конвульсант каиновая кислота (0,4 мкг), за 5 мин до которой животным группы «АМ404» вводили АМ404 (3 мкл, 120·10–9 моль), животным группы «URB597» вводили URB597 (2 мкл, 4,8·10–9 моль), а животным группы «контроль» – такой же объем ДМСО. Через 1,5 часа инъекции АМ404 (2 мкл, 80·10–9 моль), URB597 (1 мкл, 2,4·10–9 моль) и ДМСО (соответствующего объема) повторяли. ЭЭГ регистрировали в течение четырех часов после введения каиновой кислоты. Тяжесть поведенческих судорог оценивали в баллах по модифицированной шкале Racine (от 0 до 6, где 0 соответствовал нормальному поведению, а 6 – крайней стадии судорог, смерти животного) [12]. Запись ЭЭГ и ее анализ производили с помощью программы Datapac2K2, США, 2005 (диапазон регистрируемых частот 0–300 Гц, частота оцифровки 1кГц). Для статистического анализа применяли линейную модель одновариантного анализа (one-way ANOVA) с последующим применением критерия Тьюки. Данные представлены как среднее ± SD; различия считали статистически достоверными при уровне значимости p < 0,05.
Результаты исследования
и их обсуждение
Спонтанная активность исследуемых структур мозга. Анализ ЭЭГ бодрствующих морских свинок выявил более широкий диапазон частот в гиппокампе (0–250 Гц), по сравнению с другими структурами (0–100 Гц в МСО, 0–150 Гц в ЭНК, 0–100 Гц в БАМ). В МСО была также выражена дельта-активность; тета-активность в наибольшей степени была свойственна гиппокампу. В амигдале иногда появлялся альфа-ритм, не характерный для остальных структур (рис. 1А). Разовое введение АМ404, URB597 и ДМСО не приводило к существенным изменениям спонтанной активности изучаемых структур. Поведение животных после разового введения данных соединений в используемых концентрациях и объемах также не менялось.
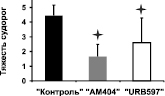
Модуляция эпилептического статуса. При введении каиновой кислоты у всех контрольных животных примерно через 5–10 минут развивался эпилептический статус. Во время ЭС у морских свинок наблюдалось замирание, непроизвольное жевание, сильная дрожь (на начальных этапах), кружение с падением (на поздних этапах). Все это сопровождалось сильными электрографическими судорогами в ЭЭГ, представляющими собой периодические высокочастотные высокоамплитудные осцилляции. ЭС длился четыре часа и более. У всех животных группы «контроль» судорожная активность достигала 4–5 баллов по шкале Racine, при этом электрографические судороги регистрировались во всех исследуемых структурах.
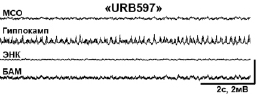
При совместном введении каиновой кислоты с ингибитором обратного захвата эндоканнабиноидов АМ404 (группа «АМ404») либо с ингибитором фермента деградации анандамида URB597 (группа «URB597») данный конвульсант не вызывал эпилептического статуса; при этом в поведении животных отмечалось лишь легкое беспокойство. Судорожная активность была на уровне 1–2 баллов по шкале Racine. Необходимо отметить, что в группе «URB597» у 40 % животных не регистрировались также электрографические судороги. В данном случае в ЭЭГ наблюдались острые волны (6–10 Гц), а также высокочастотная активность в диапазоне 100–200 Гц. В гиппокампе острые волны следовали с частотой 6 Гц; при этом обнаруживалось наложение на них высокочастотной активности на частоте 36 Гц (см. рис. 1).
Модуляция судорожных паттернов. Анализ паттернов судорожных эпизодов в ЭЭГ во время ЭС в контрольной и экспериментальных (в том случае, если электрографические судороги имели место) группах животных показал их сходство. Как длительность, так и частота судорожных эпизодов не различалась в контрольной и экспериментальных группах. Однако в том случае, когда каиновой кислоте предшествовало введение ингибиторов метаболизма ЭК (группы «АМ404» и «URB597»), судороги спонтанно заканчивались через 3 часа после введения КА, в то время как у животных контрольной группы их приходилось останавливать введением диазепама (10 мг/кг) (рис. 2).
Проведенное исследование впервые показало, что внутримозговое системное введение ингибитора обратного захвата эндоканнабиноидов АМ404, а также ингибитора фермента деградации анандамида URB597 ослабляло экспериментально вызванный эпилептический статус в различных структурах мозга.
Генерация эпилептиформной активности, представляющей собой синхронные залповые разряды большой популяции нейронов, обеспечивает повышенный вход Са2+ в клетку и активацию фосфолипазы С, создавая тем самым условия для синтеза ЭК. Так, обнаружено, что уровень ЭК сильно повышается в гиппокампе при экспериментальной эпилепсии [11, 13]. Уровень анандамида (но не 2-АГ) резко возрастал в гиппокампе мышей через 20 мин после введения проконвульсанта каиновой кислоты и возвращался к норме через час [11]. В другой работе в аналогичных условиях показано возрастание синтеза как анандамида, так и 2-AГ [15]. На пилокарпиновой модели эпилепсии также показано увеличение 2-АГ в гиппокампе уже через 15 минут после развития эпилептического статуса [13]. Эти результаты наводят на мысль об адаптивной роли ЭК: известно, что за счет регуляции нейротрансмиссии они контролируют эффективность синаптических нейронных входов [6].
(А) 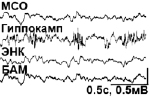
(Б) 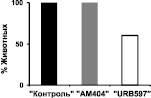
а б
(В) 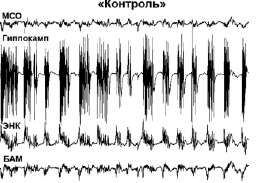
а б
Рис. 1. Полевые потенциалы, одновременно зарегистрированные в МСО, гиппокампе, ЭНК и ЦАМ. (А) Фоновая активность. (Б) Процент животных с электрографическими судорогами (а) и тяжесть поведенческих судорог (б) после введения каиновой кислоты. (В) Электрографические судороги во время ЭС в контрольной группе животных (а) и их отсутствие в группе «URB597»
а 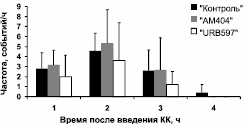 б
б 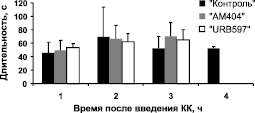
Рис. 2. Динамика частоты (а) и длительности (б) судорожных эпизодов в ЭЭГ
в течение четырех часов (ч) после введения каиновой кислоты
в контрольной и экспериментальных группах животных
Ранее было показано, что ингибитор мембранного транспорта АМ404 усиливает действие анандамида in vivo [4] и на срезах гиппокампа [6]. С другой стороны, показана селективность фермента деградации анандамида (FAAH) к гидролизу анандамида [3], широкая экспрессия данного фермента в мозге [5], почти полное отсутствие ингибирования моноацилглицерол-липазы ингибитором FAAH, URB597 [9]. Все это может говорить о том, что ослабление эпилептического статуса посредством как АМ404, так и URB597, является следствием повышения уровня анандамида, по меньшей мере, на уровне гиппокампа. В предыдущих работах in vivo было также показано, что повышение уровня ЭК в мозге (опосредованное ингибиторами обратного захвата ЭК, либо ферментами их деградации) имело противосудоржное действие после инъекции проконвульсанта каиновой кислоты [2, 8, 9, 11, 15]. На другой модели, при AMPA-вызванной эксайтотоксичности, повышение уровня ЭК (посредством совместного введения ингибитора обратного захвата и фермента гидролиза анандамида) значительно снижало судорожную активность, а также защищало от повреждений нейронов и нарушений поведения и аверсивной памяти [7].
Вещества, блокирующие инактивацию анандамида и 2-АГ, в экспериментах могут способствовать установлению их физиологической роли. В перспективе они также могут оказаться полезными при лечении ряда заболеваний.
Выводы
1. Ингибиторы обратного захвата эндоканнабиноидов и фермента деградации анандамида, АМ404 и URB597 (соответственно), повышающие уровень эндоканнабиноидов в мозге, существенно не изменяют ЭЭГ, а также не влияют на поведение животных.
2. Эпилептический статус, вызванный каиновой кислотой, существенно ослабляется ингибированием метаболизма эндоканнабиноидов АМ404 и URB597 посредством их внутримозгового введения.
3. Подавление метаболизма эндоканнабиноидов не изменяет частоту и длительность судорожных эпизодов в ЭЭГ во время эпилептического статуса, однако способствует более быстрому их прекращению.
Рецензенты:
Куликов А.В., д.б.н., зав. сектором экспериментальной трансплантологии ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино;
Павлик Л.Л., д.б.н., ведущий научный сотрудник лаборатории ультраструктуры нейрона ФГБУН «Институт биофизики клетки Российской академии наук»,
г. Пущино.
Работа поступила в редакцию 19.09.2012.



