В последнее время большое внимание уделяется изучению влияния ионов тяжелых металлов на устойчивость эритроцитов крови человека.
Основной мишенью токсического воздействия тяжелых металлов является биологическая мембрана [5].
Эритроцит – универсальная модель для изучения процессов, происходящих в клеточной мембране под действием самых различных агентов. Детальное исследование изменений морфофункциональных показателей эритроцитов под влиянием различных химических раздражителей, с которыми человек сталкивается в процессе естественных взаимоотношений с природой, позволяет полнее установить возможные последствия и определить наиболее эффективные пути их коррекции в условиях действия эколого-химических факторов окружающей среды. Токсическое действие различных соединений тяжелых металлов преимущественно обусловлено взаимодействием с белками организма, поэтому их называют белковыми ядами. Одним из таких металлов является кадмий [6].
А.А. Тугаревым предложен комплекс информативных критериев для оценки токсического влияния ионов кадмия на морфофункциональные показатели эритроцитов периферической крови человека и животных [6, 7].
Д.В. Большим изучено распределение металлов между различными фракциями крови при экспозиции Zn, Cd, Mn, Pb in vitro [1]. Автором подтверждены данные литературы о преимущественном первичном связывании металлов в крови с альбумином. По проникающей способности исследованные металлы распределились Cd > Mn > Pb > Zn.
Внешняя оболочка клеток крови богата функциональными группами, способными связывать ионы металлов [1].
Биологическая роль вторичного связывания металлов весьма разнопланова и зависит как от природы металла, так и его концентрации и времени экспозиции [7].
В работах С.М. Охрименко показано повышение степени гемолиза эритроцитов после введения животным солей CaCl и HgCl2 [4].
Ионы кобальта способны непосредственно инициировать перекисное окисление липидов (ПОЛ), вытеснять железо из гема и гемопротеинов, в то время как механизм действия ртути заключается в связывании SH-групп белковых и небелковых тиолов. Предварительно введенный триптофан частично ограничивает усиление спонтанного гемолиза эритроцитов, вызванное ввдением хлорида кобальта. Отсутствие такого эффекта в случае введения в организм хлорида ртути свидетельствует о наличии другого механизма, видимо, связанного с высоким сродством ионов ртути к тиогруппам мембранных белков [4].
М.О. Трусевичем изучено влияние тяжелых металлов (хлориды Со, Mn, Ni, Zn) в конечных концентрациях от 0,008 до 1 мМ. На основании полученных результатов авторами сделан вывод о том, что все тяжелые металлы в концентрации свыше 0,008 мМ оказывают токсическое воздействие на резистентность эритроцитарной мембраны, исключая значения концентрации 0,04 мМ. Для хлорида Zn отмечено снижение уровня гемолиза эритроцитов в концентрации 0,04 мМ [5].
Материалы и методы исследования
В настоящей работе изучено влияние тяжелых металлов (Pb2+, Co2+, Zn2+) на мембранную устойчивость эритроцитов крови здорового человека и различных больных (сахарный диабет, опухоль щитовидной железы, острая пневмония).
Для опытов использовали кровь, взятую из пальца. Набирали 20 мм3 крови в 2 мл физиологического раствора.
Эритрограмма строилась по методу кислотных эритрограмм, предложенных Гительзоном и Терсковым [2].
Для наблюдения за кинетикой гемолиза использовали фотоэлектрический колориметр КФК-2. За стандартную принята концентрация эритроцитов, оптическая плотность которой в данных условиях составляла 0,700.
Результаты исследования
и их обсуждение
В суспензию эритроцитов добавляли растворы тяжелых металлов (хлориды Pb, Co, Zn) в конечных концентрациях от 10–5 до 10–3 М. Полученные образцы инкубировали в течение 10–60 минут. Затем определялась оптическая плотность эритроцитов в зависимости от концентрации и времени воздействия ионов тяжелых металлов. Кроме того, изучена кинетика кислотного гемолиза эритроцитов в крови здорового человека и крови больных в зависимости от концентрации ионов тяжелых металлов. Известно, что в зависимости от возраста человека изменяется мембранная устойчивость эритроцитов крови. В связи с этим при взятии крови учитывали возраст.
Установлено, что использованные ионы тяжелых металлов оказывают влияние на мембранную устойчивость эритроцитов, которая выражается в изменении плотности последних. Так, например плотность суспензии эритроцитов, подвергнутых воздействию ионов Pb2+ в концентрации 10–3 М в течение 60 минут, уменьшается на 90 %, а при влиянии ионов Co2+ и Zn2+ соответственно на 70 и 60 % (время действия 60 минут, концентрация 10–3 М), тогда как плотность суспензии эритроцитов необработанных ионами не изменяется.
Таким образом, установлено, что плотность суспензии эритроцитов изменяется в зависимости от концентрации и длительности воздействия ионов тяжелых металлов – чем выше концентрация и время воздействия, тем больше уменьшение плотности эритроцитов.
Из эритрограммы, характеризующей кислотный гемолиз эритроцитов крови здорового человека, видно, что начало гемолиза на 2-й минуте, длительность гемолиза составляла 8 минут, максимум 6 минут. Скорость кислотного гемолиза крови изменяется при действии ионов тяжелых металлов. Так, если сравним эритрограммы образцов крови, которые подвергались влиянию ионов Pb2+ (концентрация 10–3 М, время воздействия 30 минут), то можно заметить, что гемолиз длится в среднем 4 минуты и максимум распределения эритроцитов 2 минуты; по сравнению с ионами Pb2+ и Co2+ ионы Zn2+ оказывают слабое воздействие, и кислотный гемолиз длится 6, 5 минут, максимум 4 минуты (рис. 1, 2).
В представленной работе также изучена кинетика кислотного гемолиза эритроцитов крови больных сахарным диабетом, опухолью щитовидной железы и острой пневмонией. Как видно из полученных данных, в крови больных пневмонией и опухоли щитовидной железы происходит накопление в группе пониженно-стойких, среднестойких эритроцитов и уменьшение количества повышенно-стойких эритроцитов. А у больных сахарным диабетом эритрограмма крови с правой стороны приподнята. Это указывает на увеличение уровня эритропоэза в крови [2].
Влияние использованных в работе ионов тяжелых металлов на эритроциты крови больных отличается (рис 3, 4, 5). Так, например, ионы Zn2+ оказывают сильное воздействие на эритроциты крови больного острой пневмонией и опухолью щитовидной железы по сравнению с эритроцитами крови здорового человека. Подтверждением наших данных явились результаты исследований, проведенных у больных со злокачественными опухолями различной локализации, где были выявлены выраженные нарушения белкового состава (снижение содержания высокомолекулярных полипептидов при одновременном увеличении доли низкомолекулярных белков), а также показано, что с низкомолекулярными белками в основном связываются ионы Zn2+ [3,1]. При влиянии ионов Pb2+ на эритроциты крови больных наблюдается смещение всей эритрограммы влево, следовательно, теряет стойкость вся масса эритроцитов.
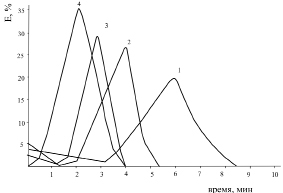
Рис. 1. Эритрограмма крови здорового человека после воздействия ионов Co2+:
1 – контроль; 2 – 10–5 M; 3 – 10–4 M; 4 – 10–3 M.
Время воздействия 30 мин P < 0,5
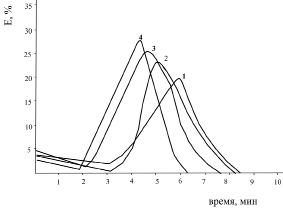
Рис. 2. Эритрограмма крови здорового человека после воздействия ионов Zn2+:
1 – контроль; 2 – 10–5 M; 3 – 10–4 M; 4 – 10–3 M.
Время воздействия 30 мин P < 0,5
Полученные данные позволяют считать, что изменение физико-химического состава эритроцитов, проявляющееся в непостоянстве их стойкости, является следствием повреждения мембраны эритроцитов при воздействии ионов тяжелых металлов. Влияние ионов тяжелых металлов (Pb2+, Co2+, Zn2+) зависит от концентрации, длительности их экспозиции и предшествующего состояния здоровья человека.
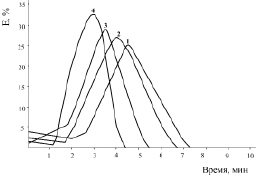
Рис. 3. Эритрограмма крови больных пневмонией после воздействия ионов тяжелых металлов:
1 – кровь больных пневмонией; 2 – Co2+ (10–5 M); 3 – Zn2+ (10–5 M); 4 – Pb2+( 10–5 M).
Время воздействия 30 мин P < 0,3
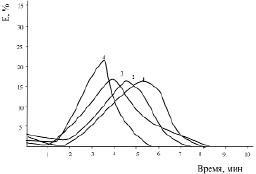
Рис. 4. Эритрограмма крови больных опухолью щитовидной железы
после воздействия ионов тяжелых металлов:
1 – кровь больных опухолью щитовидной железы; 2 – Co2+ (10–5 M); 3 – Zn2+ (10–5 M); 4 – Pb2+ (10–5 M). Время воздействия 30 мин P < 0,4
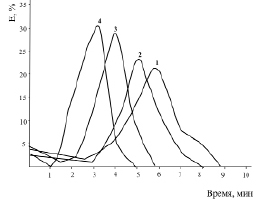
Рис. 5. Эритрограмма крови больных сахарным диабетом после воздействия ионов тяжелых металлов:
1 – кровь больных дибетом; 2 – Zn2+ (10–5 M); 3 – Co2+ (10–4 M); 4 – Pb2+( 10–3 M).
Время воздействия 30 мин P < 0,3
Рецензенты:
Халилов Р.И.Х., д.ф.-м.н., ведущий научный сотрудник лаборатории радиоэкологии Института радиационных проблем Национальной академии наук Азербайджана, г. Баку;
Гусейнов Т.М., д.б.н., руководитель лаборатории экологической биофизики Института физики Национальной академии наук Азербайджана, г. Баку.
Работа поступила в редакцию 17.09.2012.



