Элодея относится к однодольным, покрытосемянным, водным растениям сем. Водокрасовых (Hydrocharitaceae). В центральной России, включая Московскую область, широко представлен вид Elodea canadensis Michx. (Anacharis canadensis Planch.) в реках, озерах и прудах [1, 3]. Лист элодеи является классическим объектом для образовательных целей. На этом объекте школьники и студенты изучают строение живой растительной клетки, круговое движение цитоплазмы и хлоропластов, упаковку клеток в мезофилле листа и др. [4, 6]. В последние годы Элодея широко используется как биотест в экологическом мониторинге загрязнений водоемов в основном тяжелыми металлами и радионуклидами [2, 10]. Кроме этого, элодея входит в состав водных биоценозов гидрофитов и учитывается при описании флористического состава различных территорий.
В этой связи морфометрическая характеристика листовой пластинки элодеи в норме и при действии различных загрязнителей водной среды имеет значение для развития системы экологических биотестов и использования как морфологического параметра в систематике рода Элодеи.
В данной работе представлены результаты измерения основных морфометрических параметров клеток листовой пластинки Elodea canadensis Michx.
Материал и методы исследования
Морфометрический анатомический анализ листьев проводился под микроскопом МБС-10 с цифровой камерой Canon A-350. Поперечные срезы изготавливались вручную без фиксации и дополнительных окрасок. Микроморфология листовой пластинки изучалась под инвертированным микроскопом Olympus XI, имеющим на выходном оптическом порте цифровую камеру Olympus-330. Для регистрации движения цитоплазмы в клетках мезофилла использовалась установка, состоящая из микроскопа Olympus XI, 3-х матричного видекамкордера HD GY101 (фирма JVC, Япония) и проточной микрокамеры [7]. Кадры из фильмов захватывались при помощи платы и программы Pinnacle Studio v.9.
Для окончательной подготовки фотографий и микроморфометрического анализа использовались программы Photoshop 7.0, CorelDRAW v.11.633, PhotoM v.1.21(http://t_lambda.chat.ru) и ImageTool v.2.0. Статистический анализ данных проводился с использованием программы Statistica v.6.0
Результаты исследования и их обсуждение
1. Общее описание морфологии листовой пластинки Элодеи
В многочисленных статьях имеется морфологическое описание Elodea сanadensis. Общеизвестно, что Элодея имеет разветвленные стебли, которые могут быть закреплены на дне водоемов, но легко обрываются или обламываются, продолжая свое развитие в свободно плавающем состоянии. Листья Элодеи мелкие, сидячие, линейно-ланцетные с одной центральной жилкой, расположены на стеблях ложными мутовками, по 3-5 листьев в мутовке. Край листа содержит шиповидные зубцы, кончики которых направлены к вершине листовой пластинки. Самые молодые листья находятся на вершине веточек элодеи, содержат клетки, стенки которых тонкие и плотно контактируют друг с другом. Клетки заполнены цитоплазмой, содержат крупное ядро и хлоропласты. В более старых клетках сильно развита вакуоль, размеры хлоропластов увеличиваются [4, 6 и др.].
2. Размеры листовой пластинки
В табл. 1 представлены основные размеры листовой пластинки. Клетки мезофилла тянуться рядами вдоль центральной жилки, в «молодых» листьях таких рядов на верхней поверхности листа 15-20, у «зрелых» - 30-50. В центральной жилке количество продольных рядов клеток колеблется от 4 до 6. Клетки мезофилла и центральной жилки содержат большое число хлоропластов, которые совершают активное круговое движение вокруг центральной вакуоли. Край листа покрыт шиповидными зубцами, состоящими из одной - двух клеток.
Таблица 1
Морфометрические параметры листовой пластинки Элодеи
|
Длина листа, мм |
Ширина листа**, мм |
Площадь, мм2 |
|
|
«Зрелый» лист* |
16,3 ± 0,1 |
3,8 ± 0,04 |
51,7 ± 0,3 |
|
«Молодой» лист |
5,5 ± 0,1 |
1,6 ± 0,1 |
7,3 ± 0,1 |
Примечания:
* - «зрелый» лист - на расстоянии 3-4 см от верхушки побега; «молодой» лист из самой верхушки побега; ** - ширина в середине листовой пластинки; n = 10.
3. Морфометрическая характеристика клеток мезофилла
На рис. 1 представлена панорамная фотография половины верхней поверхности листовой пластинки Элодеи. Видно, что клетки верхнего слоя листовой пластинки расположены рядами, параллельно центральной жилки (таких рядов на рис. 1 - 37). Более крупные клетки лежат около центральной жилке и их площадь уменьшается ближе к краю листа. Результаты измерения площадей и линейных размеров клеток в разных зонах листовой пластинки приведены в табл. 2.
На рис. 2 представлена аналогичная панорама нижнего слоя, состоящего из рядов более мелких клеток (60 рядов). На фотографии видно, что под одной клеткой верхнего слоя клеток находится в среднем 2 слоя нижних клеток. В табл. 2 приведены результаты микрометрического анализа площади клеток нижнего слоя клеток в разных зонах листовой пластинки.
Таблица 2
Размеры клеток верхней и нижней поверхности листовой пластинки
Элодеи (рис. 1 и 2)
|
Клетки листовой пластинки |
Размеры клеток в плоскости листа |
||
|
Ширина, мкм, (n = 10) |
Длина, мкм, (n = 10) |
Площадь, мкм2, (n) |
|
|
Верхние клетки |
|||
|
ЦЖ* |
33,0 ± 2,3 |
143,5 ± 7,8 |
4660,8 ± 306,2 (10) |
|
Зона 1 |
59,0 ± 1,7 |
119,3 ± 8,5 |
6722,6 ± 571,6 (13) |
|
Зона 2 |
52,3 ± 1,5 |
114,3 ± 6,0 |
5411,5 ± 295,8 (20) |
|
Зона 3 |
49,9 ± 1,3 |
104,3 ± 5,7 |
4442,0 ± 198,0 (43) |
|
Зона 4 |
45,3 ± 1,0 |
90,1 ± 5,9 |
3584,2 ± 144,4 (45) |
|
Нижние клетки |
|||
|
ЦЖ |
30,6 ± 1,1 |
112,7 ± 8,4 |
2957,9 ± 148,0 (21) |
|
Зона 1 |
24,9 ± 1,1 |
90,9 ± 3,0 |
1987,4 ± 65,3 (55) |
|
Зона 2 |
21,6 ± 0,9 |
91,1 ± 3,7 |
1651,3 ± 72,0 (53) |
|
Зона 3 |
23,0 ± 0,7 |
73,6 ± 5,2 |
1596,1 ± 70,7 (50) |
|
Шиповидные клетки по краю листа |
|||
|
Зубцы |
2914,6 ± 133,4 (13) |
||
|
Базальные клетки |
1225,3 ± 190,0 (7) |
||
Примечание: * ЦЖ - центральная жилка.

Рис. 1. Панорамная фотография половинки листа Элодеи. Верхняя поверхность. Об.20х

Рис. 2. Панорамная фотография половинки листа Элодеи. Нижняя поверхность. Об.20х
4. Поперечный срез листовой пластинки
Мезофилл листа элодеи, как указано выше, состоит из двух слоев клеток, отличающихся размерами. На рис. 3 показана контурная карта поперечного среза листа. Размеры площадей клеток и линейные размеры клеток приведены табл. 3.
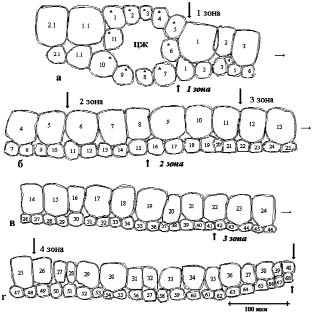
Рис. 3. Контурная карта поперечного среза листа Элодеи:
а - г, последовательные части панорамы поперечного среза листа
Таблица 3
Площади клеток верхнего, нижнего слоя клеток листовой пластинки и центральной жилки на поперечном срезе листа (номера клеток соответствуют рис. 3)
|
Номер клетки |
Зоны клеток |
Ширина, мкм |
Высота, мкм |
Площадь, мкм2 |
|
|
Верхний слой клеток |
|||||
|
1*-5*, 11* |
ЦЖ |
29,2 ± 2,5 (6) |
34,0 ± 2,3(6) |
927,8 ± 116,0 (6) |
|
|
1-5 |
1 зона |
49,3 ± 5,8 (5) |
60,3 ± 3,1(5) |
2629,1 ± 387,4 (5) |
|
|
6-11 |
2 зона |
49,4 ± 3,8 (6) |
58,0 ± 1,2(6) |
2607,5 ± 165,4 (6) |
|
|
12-25 |
3 зона |
40,5 ± 1,8 (14) |
55,0 ± 1,6(14) |
1970,3 ± 121,4 (14) |
|
|
26-40 |
4 зона |
29,1 ± 2,4 (15) |
36,5 ± 2,0(15) |
1040,4 ± 122,9 (15) |
|
|
Нижний слой клеток |
|||||
|
6*-10* |
ЦЖ |
35,0 ± 3,1 (5) |
37,4 ± 3,0(5) |
1166,9 ± 169,9 (5) |
|
|
1-16 ** |
1 зона |
25,0 ± 1,6 (8) |
27,9 ± 2,3(8) |
576,3 ± 49,0 (16) |
|
|
17-41 |
2 зона |
22,6 ± 1,2 (13) |
18,5 ± 1,0 (13) |
388,9 ± 28,0 (26) |
|
|
42-68 |
3 зона |
21,4 ± 0,8 (13) |
18,1 ± 0,9(13) |
337,5 ± 18,5 (26) |
|
Примечания: * - номера клеток центральной жилки; ** - ширина и высота клеток измерялись в нечетных клетках
Заключение
Клетки листовой пластинки в составе целого листа Элодеи представляют традиционный объект для изучения морфологии и физиологии растительных клеток in vivo. Особое отношение к клеткам листа Элодеи объясняются классическим круговым движением цитоплазмы клеток, скорость которого можно наблюдать и измерять по движению хлоропластов. Движение цитоплазмы является чрезвычайно чувствительным к различным физическим и химическим воздействиям и поэтому может использоваться как биотест в клеточной токсикологии. Кроме этого, лист Элодеи может с успехом использоваться для изучения динамики морфологических изменений растительных клеток при использовании химических фиксаторов, динамики взаимодействия клеток с прижизненными красителями и др. Все морфометрические характеристики, приведенные в данной работе, получены при анализе клеток с активным круговым движением цитоплазмы. Сегодня остается справедливым утверждение Дж. Бэйкера, высказанное им почти сорок лет назад: «...Имеется только один реальный возможный критерий, по которому можно определить: имеется ли изображение, которое мы видим в микроскопе хорошим отражением того, что существует в живой клетке? Этим критерием является сравнение с живой клеткой...» [5]. Живые клетки листьев Элодеи in situ входят в список цитологических объектов для изучения ряда фундаментальных проблем клеточной морфологии и физиологии [8, 9] и для решения практических задач экологического биомониторинга (см. например, [2]). Морфометрические характеристики клеток листовой пластинки Элодеи будут полезны для развития работ в указанных направлениях.
Дополнительные материалы к данной статье изложены в http://cam.psn.ru.
Работа выполнена на средства гранта РФФИ № 07-04-00510.
Список литературы
- Ворошилов В.Н., Скворцов А.К., Тихомиров В.Н. Определитель растений Московской области. - М.: Наука, 1966. - С. 61-62.
- Ипатова В.И., Дмитриева А.Г. Оценка токсичности тяжелых металлов с использованием высших водных растений // Экологические системы и приборы. - 2009. - №1. - С. 59-62.
- Цвелев Н.Н. Семейство водокрасовые (Hydrocharitaceae) // Жизнь растений; под ред. А.Л.Тахтаджян. - М.: Просвещение. 1982. - С. 17-24.
- Ченцов Ю.С. (ред.) Практикум по цитологии. - М.: Изд-во Московского государственного университета, 1988. - С. 25-29.
- Bakеr J.R. Cуtological Technique. - London: Mеthuen. 1966. - P. 19-155.
- Braune W., Leman A., Taubert H. Pflanzenantomisches praktikum. - Jena: VEB Gustav Fischer Verlag. - 1967. - P. 60, 67-68.
- Budantsev A.Yu. Microchambers for inverted micro-scopes // Biotechnic and Histochemistry. - 2007. - Vol. 82, №4-5. - P. 263-266.
- Mersey B., МсCully M.E. Monitoring of thе сoursе of fixation of plant сеlls// Journal of Microscopу. - 1978. - Vol. 114, Pt. 1. - Р. 49-76.
- O´Brien T.P., McCully M.E. The study of plant structure principles and selected methods. - Melbourne: Blackwell Sci.Publ., 1981. - Р. 4.19-4.36.
- Olette R., Couderchet M., Biagianti S., Eullaffroy P. Toxicity and removal of pesticides by selected aquatic plants // Chemosphere. - 2008. - Vol. 70, №8. - Р. 1414-1421.
Рецензенты:
Рощина В.В., д.б.н., ведущий научный сотрудник Учреждения РАН Института биофизики клетки, г. Пущино;
Мошков Д.А., д.б.н., профессор, зав. лабораторией Институт теоретической и экспериментальной биофизики РАН, г. Пущино.



