Введение
Способность экзогенного оксида азота (NO) активировать ионные токи установлена для различных возбудимых мембран. Показано, что NO вызывает активацию калиевой проводимости в круговой мышце пищевода опоссума [10], активирует кальций-активируемую калиевую проводимость гладкомышечных клеток кролика [8], активирует регулируемые циклическими нуклеотидами каналы обонятельных клеток саламандры [9], активирует входящий и нечувствительный к потенциалу ток с потенциалом реверсии близком к 0 мВ в каналах (регулируемых циклическими нуклеотидами) колбочек ящериц [12], активирует регулируемые циклическими нуклеотидами каналы слуховых волосковых клеток Кортиевого органа морских свинок [3].
В работе А.Л. Зефирова и др. [2] установлено, что экзогенный оксид азота увеличивает выходящий потенциал-зависимый калиевый ток и угнетает Са2+-активируемый калиевый ток мембраны нервного окончания. В последующем информация об активации NO потенциал-зависимого калиевого тока была подтверждена А.Л. Зефировым и др. [1] и А.В. Яковлевым [7]. В той части работы А.Л. Зефирова и др. [1], которая посвящена миелинизированным нервным волокнам, нами показано, что экзогенный оксид азота приводит к укорочению длительности потенциала действия (ПД) и уменьшению амплитуды следовой деполяризации (СД), что было отнесено за счёт увеличения потенциал-зависимых калиевых токов нодальной мембраны. При блокировании калиевых каналов 4-аминопиридином, приводящем к растягиванию ПД и появлению на его нисходящей фазе дополнительных спайков, NO не изменял длительность ПД и амплитуду СД. В цитируемой работе мы остановились на описании эффектов NO только на ПД и начальную часть СД.
Целью настоящей работы явились изучение эффектов NO на длительные следовые потенциалы миелинизированных нервных волокон при раздражении последних одиночными и ритмическими стимулами и интерпретация полученных результатов с позиции наличия в нодальной мембране быстрых и медленных калиевых каналов. Результаты настоящей работы представлены ранее в виде краткого сообщения [6].
Методика
Эксперименты (всего 27) проводили на одиночных миелинизированных нервных волокнах озёрной лягушки Rana ridibunda Pallas. Препаровку нервного волокна проводили таким образом, что изолировали лишь интернодальную часть волокна, а перехват Ранвье, от которого в последующем отводили ПД, оставляли интактным в нервном стволе. Схема расположения нервного волокна в экспериментальной камере приведена ранее [4]. Раздражение нервного волокна производили одиночными (длительностью 0.1 мс) и ритмическими (частотой 10, 50, 100 и 300 Гц) прямоугольными стимулами. Раствор Рингера, использованный в экспериментах, имел следующий состав (в ммоль/л): NaCl - 111; KCl - 2.5; CaCl2 - 1.95; NaHCO3 - 1.2. Эксперименты проводили при температуре 17-22о С. Статистическая обработка экспериментальных данных осуществлялась с использованием критерия Стьюдента. В качестве донора NO использовался нитропруссид натрия в концентрации 20 ммоль/л.
Результаты и их обсуждение
Одиночное раздражение нервного волокна приводит к возникновению ПД, амплитуда и длительность которого составили в среднем 78.01 ± 8.37 мВ и 1.53 ± 0.25 мс соответственно. Амплитуда и длительность СД, развивающейся после ПД и представляющей собой медленное возвращение мембранного потенциала к исходному значению, составили в среднем 2.31 ± 0.83 мВ и 198.88 ± 35.43 мс соответственно.
Добавление к раствору Рингера NO приводит к наблюдаемому во всех экспериментах сокращению (на 10-17%) длительности ПД, а также уменьшению амплитуды (с 2.31 ± 0.83 мВ до 1.15 ± 0.7 мВ) и длительности (с 198.88 ± 35.43 мс до 142.57 ± 26.72 мс) СД. Как известно [11], за фазу реполяризации ответственны быстрые калиевые каналы. В связи с этим укорочение длительности ПД под влиянием NO является свидетельством активации быстрых калиевых каналов.
В следующих сериях экспериментов нами изучена динамика изменений амплитудно-временных характеристик следовых потенциалов в присутствии NO и блокаторов калиевых каналов. Сначала изучено совместное действие NO и блокатора быстрых калиевых каналов 4-аминопиридина (рис. 1). Как оказалось, предварительная обработка нервных волокон NO не препятствует развитию типичных эффектов 4-аминопиридина на ПД и начальную часть СД. Как и в растворе Рингера без NO, в присутствии NO 4-аминопиридин вызывает расширение ПД и увеличение амплитуды СД. Вызываемые же 4-аминопиридином в обычном растворе Рингера поэтапные изменения длительности СД (первоначальное увеличение длительности, прекращение роста длительности и, наконец, уменьшение роста длительности с переходом в следовую гиперполяризацию) в присутствии NO развиваются более стремительно - за более короткое время. В присутствии NO 4-аминопиридин приводит к генерации следовой гиперполяризации (СГ), амплитуда и длительность которой существенно больше, чем амплитуда и длительность СГ, вызываемой 4-аминопиридином в отсутствие NO. На основании того, что вызываемая 4-аминопиридином СГ относится за счёт активации медленного калиевого тока [5], а NO значительно увеличивает эту СГ, можно заключить, что NO является активатором не только быстрых, но и медленных калиевых каналов.
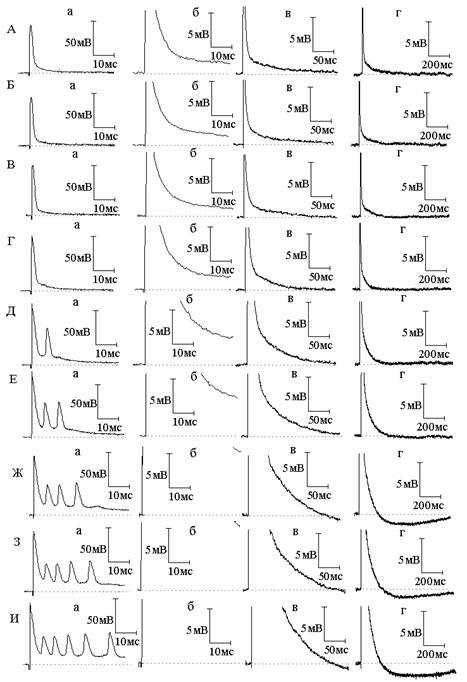
Рис. 1. Совместное действие экзогенного оксида азота (NO) и блокаторов калиевых каналов 4-аминопиридина (4-АП) и тетраэтиламмония на потенциал действия (ПД) и следовую деполяризацию (СД) миелинизированных нервных волокон амфибий. А - ПД (а) и СД (б - г) в нормальном растворе Рингера; Б и В - ПД и СД через 3 (Б) и 6 (В) минут действия NO; Г, Д, Е - то же спустя 6 (Г), 10 (Д), 14 (Е) минут после добавления к раствору Рингера с оксидом азота 4-АП. Ж, З, И - то же через 3 (Ж), 5 (З) и 8 (И) минут после добавления к раствору Рингера, содержащему NO и 4-АП, тетраэтиламмония
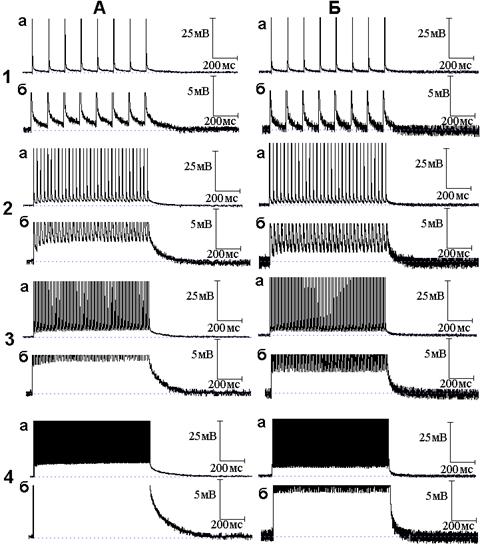
Рис. 2. Влияние экзогенного оксида азота (NO) на следовые потенциалы, регистрируемые при ритмической стимуляции нервного волокна. Опыт № 610 (начало). А - следовые потенциалы в нормальном растворе Рингера при ритмической стимуляции нервного волокна частотой 10 (1, а - б), 50 (2, а - б), 100 (3, а - б) и 300 (4, а - б) Гц при разном (а и б) усилении; Б - то же через 6 минут действия NO
Таким образом, в присутствии блокатора быстрых калиевых каналов 4-аминопиридина NO уже не может активировать быстрые каналы и воздействует на незаблокированные медленные каналы, приводя к усилению медленного калиевого тока и, как следствие, генерации большей по амплитуде и длительности СГ. Интересно, что блокатор быстрых и медленных калиевых каналов тетраэтиламмоний не препятствует дальнейшему росту амплитуды и длительности следовой гиперполяризации, вызываемой совместным действием 4-аминопиридина и NO. Анализу данного факта будет посвящена отдельная работа.
В процессе ритмического раздражения нервных волокон происходит постепенное увеличение амплитуды СД - происходит её суммация. При частотах раздражения 50, 100 и 300 Гц во время ритмического раздражения формируется деполяризационное плато (начало деполяризационного плато соответствует моменту прекращения прироста амплитуды СД в ритмическом ряду). В опыте, представленном на рис. 2, амплитуда деполяризационного плато при частотах раздражения 50, 100 и 300 Гц составила 2.73, 4.4, 8.59 мВ соответственно. Среднее значение амплитуды деполяризационного плато составило по данным 8 экспериментов 3.87 ± 1.17 мВ, 5.32 ± 0.98 мВ, 8.24 ± 1.13 мВ при частотах раздражения 50, 100 и 300 Гц соответственно. После прекращения ритмического раздражения развивается посттетаническая деполяризация (ПТД). Нередко после ПТД следует противоположный по своему знаку потенциал - посттетаническая гиперполяризация (ПТГ). В опыте, представленном на рис. 2, ПТГ в нормальном растворе Рингера не возникла (данный следовой потенциал, как правило, возникает при частоте раздражения 300 и реже - 100 Гц).
Добавление к нормальному раствору Рингера NO приводит как к уменьшению следовых потенциалов во время ритмического раздражения (уменьшается амплитуда деполяризационного плато), так и после прекращения ритмического раздражения (уменьшается амплитуда и длительность ПТД). В опыте, представленном на рис. 2 Б, значения амплитуды деполяризационного плато под влиянием NO составили 1.18, 2.59, 5.41 мВ при частотах стимуляции 50, 100 и 300 Гц соответственно. Амплитуда деполяризационного плато достоверно (Р < 0.01) уменьшилась при всех (50, 100 и 300 Гц) используемых частотах раздражения в среднем до 1.34 ± 0.49, 1.82 ± 0.60, 4.37 ± 1.79 мВ соответственно. В опыте на рис. 2 длительность ПТД под влиянием NO уменьшилась в 3.1, 4.3 и 7.3 раза при раздражении нервного волокна частотой 50, 100 и 300 Гц соответственно. Тенденция к большему сокращению длительности ПТД по мере увеличения частоты стимуляции наблюдалась во всех экспериментах.
В следующей серии опытов исследовано поведение следовых потенциалов при ритмическом раздражении в условиях совместного действия NO и блокаторов калиевых каналов. Исходя из того, что происходящие под влиянием 4-аминопиридина уменьшение длительности ПТД, появление ПТГ при низкочастотной стимуляции и её усиление при высокочастотной стимуляции были отнесены за счёт активации медленных калиевых каналов [5], а NO способен в присутствии 4-аминопиридина активировать медленные калиевые каналы, следует ожидать, что эффекты 4-аминопиридина на медленные калиевые каналы при ритмическом раздражении будут усиливаться NO. Действительно, амплитуда и длительность ПТГ, получаемой при совместном действии 4-аминопиридина и NO (рис. 3), значительно превосходят амплитуду и длительность ПТГ, вызываемой применением только одного 4-аминопиридина. На рис. 4 представлены осциллограммы продолжения опыта, представленного на рис. 2 и 3. Осциллограммы иллюстрируют временной ход следовых потенциалов при ритмическом раздражении нервных волокон после добавления к раствору Рингера, содержащему NO и 4-аминопиридин, тетраэтиламмония в концентрации 10 ммоль/л. Как можно заметить, тетраэтиламмоний, как и в случае следовых потенциалов при одиночном раздражении, не препятствует эффектам, развиваемым 4-аминопиридином.
Данные, полученные в настоящей работе, согласуются с представлениями о возможности активации ионных каналов под влиянием NO и дополняют перечень возбудимых мембран, ионные каналы которых чувствительны к NO. Настоящая работа является продолжением изучения вклада быстрых и медленных калиевых каналов в механизм электрической активности мембраны миелинизированных нервных волокон амфибий [4, 5]. Важным оказалось то, что, активируя быстрые калиевые каналы, NO может также активировать медленные калиевые каналы, если быстрые оказываются заблокированными. Блокатор быстрых калиевых каналов 4-аминопиридин, как показано в нашей предыдущей работе [5], вызывает поэтапные изменения длительности СД миелинизированных нервных волокон амфибий: первоначальное увеличение длительности, прекращение роста длительности и, наконец, уменьшение роста длительности СД с переходом в следовую гиперполяризацию. Эти расставленные во времени фазные изменения длительности СД были отнесены за счёт постепенного нарастания (по мере увеличения доли заблокированных быстрых калиевых каналов) медленного калиевого тока. В частности, та СГ, которая возникала под действием 4-аминопиридина, также отнесена за счёт активации медленных калиевых каналов: её величина была тем больше, чем больше по своей площади был вызванный 4-аминопиридином многоспайковый ответ, то есть чем более деполяризованной была мембрана [5]. Как установлено в настоящей работе, СГ, вызванная 4-аминопиридином и NO, по своей величине существенно больше таковой при применении только одного 4-аминопиридина, что является свидетельством в пользу активации NO медленных калиевых каналов.
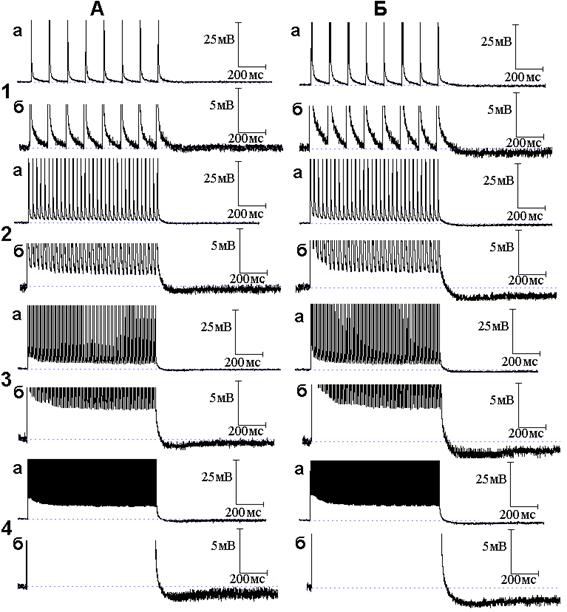
Рис. 3. Следовые потенциалы при ритмической стимуляции нервного волокна в присутствии оксида азота (NO) и 4-аминопиридина (4-АП). Опыт № 610 (продолжение). А - следовые потенциалы при ритмической стимуляции нервного волокна частотой 10 (1, а - б), 50 (2, а - б), 100 (3, а - б) и 300 (4, а - б) Гц после 6 минутного действия 4-АП в растворе Рингера, содержащем NO. Б - то же после 10 минут действия 4-АП на фоне NO
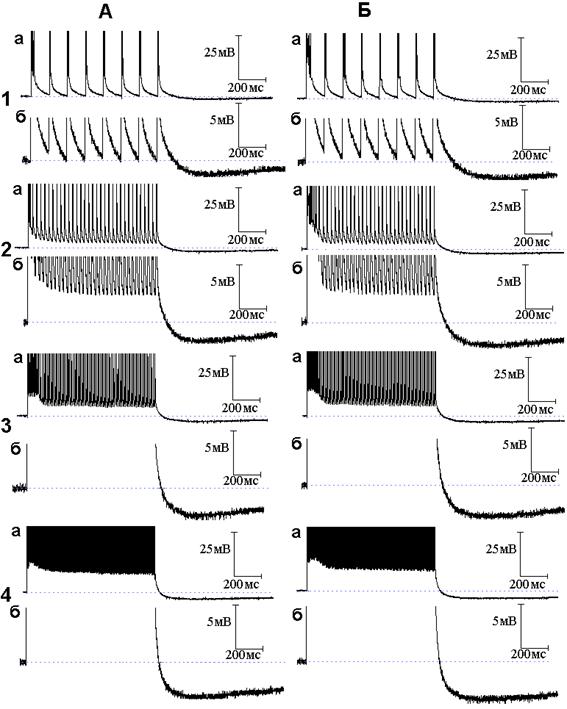
Рис. 4. Следовые потенциалы при ритмической стимуляции нервного волокна в присутствии оксида азота (NO), 4-аминопиридина (4-АП) и тетраэтиламмония. Опыт № 610 (продолжение). А - следовые потенциалы при ритмической стимуляции нервного волокна частотой 10 (1, а - б), 50 (2, а - б), 100 (3, а - б) и 300 (4, а - б) Гц после 2 минутного действия ТЭА в растворе Рингера, содержащем NO и 4-АП. Б - то же после 4 минут действия ТЭА на фоне NO и 4-АП
Выводы
- NO приводит к сокращению длительности СД, а также уменьшению получаемого во время ритмической стимуляции деполяризационного плато и регистрируемой после окончания ритмической стимуляции ПТД.
- В присутствии NO 4-аминопиридин вызывает расширение ПД и увеличение амплитуды СД - подобно тому, как это происходит под действием только одного 4-аминопиридина.
- Вызываемые 4-аминопиридином поэтапные изменения длительности СД (первоначальное увеличение длительности, прекращение роста длительности и уменьшение длительности СД с переходом в СГ) в присутствии NO развиваются за более короткое время. В присутствии NO 4-аминопиридин приводит к генерации СГ, амплитуда и длительность которой существенно больше, чем амплитуда и длительность СГ, вызываемой 4-аминопиридином в отсутствие NO.
- В присутствии блокатора быстрых калиевых каналов 4-аминопиридина NO уже не может активировать быстрые каналы и воздействует на незаблокированные медленные каналы, приводя к усилению медленного калиевого тока и, как следствие, генерации большей по амплитуде и длительности следовой гиперполяризации.
- Совместное действие NO и 4-аминопиридина вызывает возникновение ПТГ большей амплитуды и длительности, чем ПТГ в присутствии только одного 4-аминопиридина.
СПИСОК ЛИТЕРАТУРЫ:
- Зефиров А.Л., Каталымов Л.Л., Усмендеева (Кузнецова) И.В., Халиуллина Р.Р. // Бюл. экспер. биол. - 2001. - Т. 131. - № 5. С. 604.
- Зефиров А.Л., Халиуллина Р.Р., Анучин А.А. // Бюл. экспер. биол. - 1999. - Т. 128. - № 8. С. 144.
- Каламкаров Г.Р., Кулагина О.Г. // Сенсорные системы. - 1999. - Т. 13. - № 3. С. 226.
- Кузнецова И.В., Евстигнеев Д.А., Глухова Н.В. // Фiзiологiчний журнал (Киïв). - 2005. - Т. 51. - № 2. С. 96.
- Кузнецова И.В., Евстигнеев Д.А., Глухова Н.В. // Фiзiологiчний журнал (Киïв). - 2007. - Т. 53. - № 3. С. 61.
- Кузнецова И.В., Евстигнеев Д.А., Глухова Н.В. // Фундаментальные исследования. - 2007. - № 8. С. 57.
- Яковлев А.В. Роль циклических нуклеотидов в реализации эффектов оксида азота (II) на секрецию медиатора и ионные токи двигательного нервного окончания. Автореф. дисс. ... канд. биол. наук. - Казань, 2004. - 17 с.
- Bolotina V.M., Najibi S., Palacino J.J., Pagano P.J., Cohen R.A. // Nature. - 1994. - Vol. 368. P. 850.
- Broillet M.C., Firestein S. // Neuron. - 1996. - Vol. 16. - № 2. P. 377.
- Cayabyab F.S., Daniel E.E. // Am. J. Physiol. - 1995. - Vol. 268. P. 831.
- Poulter M.P., Padjen A.L. // Neuroscience. - 1995. - Vol. 68. - № 2. P. 497.
- Savchenko A., Barnes S., Kramer R.H. // Nature. - 1997. - Vol. 390. P. 694.



