Лекарственные поражения печени (ЛПП) являются одной из серьезных проблем в гепатологии. На долю медикаментозных поражений печени приходится до 9,5% всех регистрируемых побочных реакций и в 15% случаев они заканчиваются летальным исходом. На долю возникновения желтухи приходится 2-6%, а острых гепатитов - 10-20% случаев побочных эффектов [1]. Во фтизиатрии их частота составляет от 15 до 20% и обусловлена необходимостью применения полихимиотерапии в лечении туберкулеза, создающей высокую медикаментозную нагрузку на гепатоциты, осуществляющих метаболизм лекарственных препаратов [5,9,16]. Наиболее часто эффекты встречаются в группах риска, это, прежде всего, пациенты, страдающие патологией печени, принимающие одновременно несколько лекарственных средств (ЛС). Побочные эффекты в 0,2-5% случаев являются причиной летальных исходов, причем четверть смертей в стационаре связана с медикаментозными осложнениями [11].
В основе патогенеза ЛПП лежат нарушения функций митохондрий, развивается тканевой гипоксия с истощением запасов АТФ, избыточным образованием свободных радикалов и активизацией перекисного окисления липидов (ПОЛ) с последующим повреждением клеточных мембран (цитоплазматической, митохондриальной) [15], делая оправданным применение лекарственных препаратов с антигипоксантным и антиоксидантным действием [10,117]. Поражение печени провоцирует появление токсичности лекарственного средства, поскольку снижается интенсивность его метаболизма, нарушается детоксикационная функция печени, возрастает количество свободных радикалов с активацией реакций ПОЛ. На фоне падения синтеза альбуминов возрастает токсичность ЛС, в норме обладающих высоким уровнем связывания с белками плазмы [12].
Т.Г. Кожока (2007) выделил антигипоксанты/антиоксиданты в отдельную группу препаратов - «энергообеспечивающие средства - антигипоксанты», куда включил и сукцинатсодержащие препараты, разработанные на основе янтарной кислоты и/или ее солей в подгруппу «регуляторы энергетического обмена/субстраты энергетического обмена». Их активным компонентом являются янтарная кислота (ЯК) - универсальный энергообеспечивающий интермедиат - продукт пятой и субстрат шестой реакций цикла трикарбоновых кислот Кребса. Мощность системы энергопродуции, использующей сукцинат, в сотни раз превосходит другие системы энергообразования организма [4,7].
Преимущества сукцината (ЯК) в скорости окисления над другими субстратами клеточного дыхания наиболее выражено в условиях гипоксии, когда НАД-зависимый транспорт электронов дыхательной цепи тормозится, а активность сукцинатдегидрогеназы и продукция эндогенного сукцината возрастает [10].
Сукцинатсодержащим антиоксидантом/антигипоксантом является раствор ремаксола, усиливающий скорость анаэробного гликолиза, при этом обеспечивается поставка готового НАД+ и уменьшаются проявления жировой дистрофии гепатоцитов - морфологического проявления ЛПП [3].
Материал и методы
Нами проведена оценка гепатопротекторной эффективности оригинального сукцинатсодержащего раствора «ремаксол» у больных с лекарственными поражениями печени (ЛПП) на фоне антибактериальной терапии туберкулеза органов дыхания. Препарат применялся у впервые выявленных больных легочным туберкулезом (n=61, основная группа - ОГ), из которых 32 (52,5%) составили мужчины. Средний возраст обследованных - 32,5±4,8 года, из них около половины (54,1%) были лица в возрасте до 30 лет. Критериями включения в исследование являлись: возраст от 18 до 60 лет, впервые выявленный инфильтративный или диссеминированный туберкулезный процесс, наличие лекарственного или вирусно-лекарственного поражения печени с уровнем активности аланинаминотрансферазы (АлАТ) более двух максимальных норм. Доминирующей клинической формой туберкулеза был инфильтративный, который регистрировали у
44 (72,1%) больных, при этом распад определялся у половины (51,4%), а бактериовыделение - у 22,9% обследованных.
14 (23,3%) пациентов составили подгруппу, где в качестве сопутствующей патологии определялся хронический вирусный гепатит С (ПГ1).
Больным (70,6%) при лечении специфического процесса использовался 1-й или 3-й режимы химиотерапии с применением препаратов основного ряда - изониазида, рифампицина, стрептомицина, пиразинамида, этамбутола. В остальных случаях применялись режимы 2Б/4 (при наличии предполагаемой или доказанной устойчивости к препаратам основного ряда), а также индивидуальный режим (при явлениях непереносимости основных препаратов), которые требовали назначения резервных препаратов - канамицина, протионамида и фторхинолонов.
Ремаксол применялся курсом в течение 10 дней по 400мл один раз в день внутривенно капельно медленно. Эффективность гепатопротекторной терапии оценивалась по динамике клинических проявлений лекарственной гепатотоксичности, активности индикаторных цитолитических печеночных ферментов и биохимических маркеров синдрома холестаза (с оценкой протеинограммы и типов адаптационных реакций организма). Значимыми считали изменения активности биохимических показателей более чем на 10% от исходного уровня.
Обсуждение результатов
До начала терапии клинические проявления ЛПП определялись у 18 (29,5%) больных (из них - 6,6% больных с ВГ). Доминирующим синдромом был диспепсический (тошнота, рвота, боли и тяжесть в правом подреберье, чувство горечи во рту) - у 23,0% обследованных. В 13,1% случаев он протекал изолированно, в 6,6: - сочетался с астеновегетативным, а в 3,3% - с гепатомегалией. Астеновегетативный синдром (резкая слабость, утомляемость) регистрировался у 9,9% пациентов, в 3,3% он протекал изолированно, в остальных случаях сочетался с диспепсическим.
Исчезновение клинических проявлений ЛПП отмечалось на 3-й день (диспепсический синдром), на 5-6-й день (астеновегетативный синдром), на 8-й день (гепатомегалия). У больных с сопутствующим ВГ сроки купирования клинической симптоматики не отличались.
До начала лечения активность АлАТ в основной группе была повышена в 4,5 раза, а у больных ПГ1 - в 5,4 раза по сравнению с нормой.
По окончании терапии (основная группа больных) снижение на 61,5% от исходного уровня активности АлАТ наблюдалось у 84,8% больных. У 10,9% пациентов отмечено повышение показателя на 76,7% от исходного, а у 4,3% пациентов за время терапии активность фермента не менялась. У больных с сопутствующим вирусным поражением печени (ПГ1) активность АлАТ снизилась на 31,1% у 57,1% пациентов.
Нормализация активности АлАТ после курса терапии (основная группа больных) наблюдалась у 47,8% пациентов, а у 15,2% обследованных показатель не превышал величины 2-х максимальных норм (2N). У больных ПГ1 активность ферментов нормализовалась только в двух (14,2%) случаях. Активность АсАТ изначально повышена в 3,1 раза у 69,2% больных основной группы.
По окончании терапии активность фермента у 77,7% больных основной группы снизилась на 45,5% от исходного уровня. У 8,3% пациентов показатель увеличился на 110%, а у 14% - оставался без изменений. У больных ПГ1 в 57,1% случаев отмечено снижение (на 25,4%) активности АсАТ, а у 14,3% показатель увеличился на 49,3%, в 28,6% оставался без изменений.
Нормализация активности АсАТ по окончании лечения отмечалась у 38,8% больных, ау 41,7% - не превышала уровня 2N. У больных с ВГ нормализации активности фермента отмечено не было, а уровень 2N достигнут в 28,6% случаев.
Средние значения коэффициента де Ритиса, отражающего соотношение активности биохимических маркеров цитолиза, у наблюдаемых больных были в 2,4 раза ниже нормальных значений (рис.1). К окончанию лечения у больных основной группы коэффициент нормализовался (0,9±0,09), у больных ПГ1 он составил 0,67±0,08.
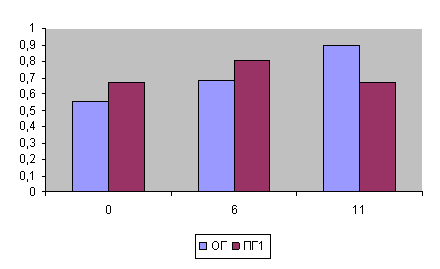
Рис. 1. Средние значения коэффициента де Ритиса у обследованных больных
Увеличение (на 18,6%) коэффициента де Ритиса к 6-му дню лечения наблюдалось у 54,8% больных основной группы, у 13% пациентов показатель не менялся. По окончании терапии показатель возрос (на 55,6%) у 76,0% больных, в то время как у больных ПГ1 его рост наблюдался только в 42,9% случаев.
До начала терапии гипербилирубинемия отмечалась у 9,7% обследованных больных основной группы, и у 3,2% больных 2-й . По окончании терапии у больных основной группы ее частота снизилась до 6,6%, а у больных ПГ1 после окончания терапии гипербилирубинемии не наблюдалось (табл. 1).
Таблица 2. Значения маркеров холестаза у наблюдаемых больных
|
Показатель |
Группы больных. Период обследования |
|||
|
До начала терапии |
По окончании терапии |
|||
|
Общая группа больных (n=61) |
Подгруппа больных с ВГ (n=14) (ПГ1) |
Общая группа больных (n=61) |
Подгруппа больных с ВГ(n=14) (ПГ1) |
|
|
Билирубин общий, мкмоль/л |
12,83± 1,9 |
12,31± 2,1 |
10,69± 1,3 |
9,6± 1,0 |
|
Билирубин прямой, мкмоль/ |
4,28± 0,50 |
4,27±0, 49 |
3,09*± 0,31 |
3,74± 0,39 |
|
Щелочная фосфатаза, Ед/л |
70,8 ±7,4 |
78,7 ±8,2 |
68,7 ±7,2 |
71,9 ±7,3 |
|
γ-глутамилтрансфераза, Ед/л |
102,0± 10,4 |
120,6± 13,7 |
82,9± 9,3 |
98,1± 10,4 |
* - различия в сравниваемых показателях достоверны до и после курса лечения, p<0,05 (t-критерий Стьюдента)
Важным критерием холестаза является прямая (коньюгированная) фракция билирубина (ПБР), синтез которого с глюкуроновой кислотой в гепатоците наблюдается в процессе коньюгации и экскретируется в желчь. При нарушении экскреции происходит увеличение концентрации внутриклеточного прямого билирубина и его обратная диффузия в системный кровоток (внутрипеченочный холестаз).
До начала терапии у больных основной группы увеличение (в 1,3 раза) концентрации ПБР отмечено у 32,3% обследованных, составив 4,28±0,5 мкмоль/л, а у пациентов первой подгруппы в 6,5% случаев (табл.2).
По окончании терапии снижение показателя до 2,98±0,25 мкмоль/л отмечалось у 80,0% больных основной группы и у 20,0% больных ПГ1 (3,11±0,32 мкмоль/л) на 36,4% от исходной величины. Нормализация показателя отмечалась у 42,0% пациентов с гипербилирубинемией.
Одними из наиболее чувствительных маркеров холестатического синдрома является активность секреторных ферментов гепатоцитов - щелочной фосфатазы (ЩФ) и γ-глутамилтрансферазы (ГГТФ), повышение которой при холестазе выявляется в 1,5 раза чаще [12].
Активность ЩФ изначально и на протяжении курса терапии существенно не менялась (табл.2). Повышение ее активности до начала терапии отмечено в 3,2% случаев. Уже к середине терапии показатель находился в пределах нормы. Активность ГГТФ у пациентов основной группы изначально повышенная в 2,1 раза, а у больных ПГ1 в 2,5 раза, имела тенденцию к снижению, составив 82,9±9,3 и 98,1±10,4 ЕД/л соответственно.
Изначально активность ГГТФ повышена у 71,0% больных, но уже к середине лечения она снизилась на 21,6% от исходного уровня у 41,9% пациентов основной группы, и у 9,7% больных ПГ1, на 17,1%. У четверти (25,8%) пациентов ОГ и у 6,5% больных ПГ1 показатель оставался стабильным. К окончанию терапии у больных основной группы отмечено его снижение на 28,1% от исходного у 63,3% пациентов, а у 71,4% больных ПГ1 показатель снизился на 23,0% от исходного фона.
Показательным критерием эффективности является оценка индивидуальной динамики биохимических показателей синдромов цитолиза и холестаза у наблюдаемых больных (табл. 3).
Таблица 3. Индивидуальная динамика биохимических маркеров у больных туберкулезом легких с изолированным ЛПП и ЛПП в сочетании с ВГ
|
Показатель |
Период обследования |
|||||
|
6-й день |
11-й день |
|||||
|
Основная группа больных (n=61) |
Подгруппа больных с ЛПП (n=47) |
Подгруппа больных с ЛПП+ВГ (n=14) |
Основная группа больных (n=61 |
Подгруппа больных с ЛПП (n=47) |
Подгруппа больных с ЛПП+ВГ (n=14) |
|
|
АлАТ, МЕ/л |
-43,55 |
-68,97 |
+39,99 |
-87,92* |
-99,51 |
-23,13 |
|
АсАТ, МЕ/л |
+3,52 |
-39,89 |
+102,76 |
-39,61* |
-44,09 |
-22,09 |
|
Билирубин прямой, мкмоль/ |
-2,22 |
-1,97 |
-3,12 |
-2,96 |
-3,05* |
-2,60 |
|
ГГТФ, Ед/л |
-6,01 |
-7,30 |
-1,59 |
-23,18 |
-23,70 |
-22,53* |
* - различия в сравниваемых показателях достоверны на 6-й и 11-й день терапии, p<0,05
(U-критерий Манна-Уитни)
Активность АлАТ снижается на 68,97 МЕ/л у больных с изолированным ЛПП, в то время как, у больных с ЛПП+ ВГ (к середине терапии) показатель повышается на 39,99 МЕ/л (табл.3). По окончании курса терапии темпы снижения АлАТ у больных с ЛПП превышают в 4,1 раза таковые у больных подгруппы ЛПП+ВГ. Аналогичная тенденция наблюдается в динамике активности АсАТ (-39,89 и +102,76 МЕ/л соответственно), к 11-му дню терапии темпы снижения АсАТ у больных с ЛПП+ВГ отстают в 2 раза от пациентов, имевших ЛПП без ВГ. Концентрация прямого билирубина к 6-му дню, наоборот, в 1,6 раза интенсивнее уменьшается у больных с ЛПП+ВГ. По окончании терапии снижение показателя происходит в 1,2 раза интенсивнее при наличии «чистого» ЛПП. Активность ГГТФ снижается (на 23,18 ЕД/л) у больных обеих подгрупп, однако темпы ее уменьшения в 4,6 раза интенсивнее у больных с изолированным ЛПП.
Таблица 4. Значения и индивидуальная динамика мочевой кислоты (МК) у наблюдаемых больных
|
Показатель |
Группы больных. Период обследования |
|||||
|
До начала терапии |
На 6-й день терапии |
По окончании |
||||
|
Общая группа больных (n=61) |
Подгруппа больных с ВГ (n=14) (ПГ1) |
Общая группа больных (n=61) |
Подгруппа больных с ВГ (n=14) (ПГ1) |
Общая группа больных (n=61) |
Подгруппа больных с ВГ (n=14) (ПГ1) |
|
|
Средняя концентрация МК крови, мкмоль |
477,1 ±53,2 |
503,4 ±55,7 |
489,4 ±51,3 |
546,6 ±59,8 |
547,5 ±57,4 |
593,6±62,3 |
|
Индивидуальная динамика уровня МК крови, мкмоль |
- |
- |
+12,26 |
+43,14 |
+72,30* |
+90,14 |
* - различия в сравниваемых показателях достоверны на 6-й и 11-й день терапии, p<0,05
(U-критерий Манна-Уитни)
При анализе корреляционных связей маркеров цитолиза и холестаза, прослеживается высокая прямая корреляция между АлАТ и АсАТ (r=0,89, p<0,01), АлАТ и ГГТФ (r=0,6, p<0,01), умеренная обратная корреляция (r=-0,31) между АлАТ и прямым билирубином.
Учитывая, что активность ГГТФ является более чувствительным холестатическим маркером, можно говорить о взаимосвязанном снижении синдромов цитолиза и холестаза под влиянием терапии ремаксолом.
До начала лечения повышенный в 1,4 раза уровень МК крови отмечен у 58,1% больных основной группы и у 12,9% больных ПГ1, отражая проявление цитолитического синдрома (катаболизм нуклеиновых кислот за счет распада ядер гепатоцитов). При оценке влияния ремаксола на уровень мочевой кислоты (МК) установлена тенденция к росту на 14,8% ее концентрации на фоне лечения (табл.4). К 6-му дню терапии повышенный в 1,5 раза уровень показателя выявлялся у 61,3% больных ОГи у 19,4% - больных ПГ1, а по окончании терапии уже у 76,7% пациентов основной группы и у 23,3% пациентов ПГ1. Оценивая индивидуальную динамику показателя (табл. 4) необходимо отметить преимущественный рост в 7,2 раза уровня МК к 11-му дню терапии, в сравнении с
6-м днем лечения. При этом индивидуальные сдвиги уровня МК при изолированном ЛПП (ПГ2) по абсолютным величинам меньше, чем у больных с ЛПП+ВГ, составив +3,25 и +66,9 мкмоль (p<0,05, U - критерий Манна-Уитни) на 6-й и 11-й день соответственно.
По окончании терапии у 50,0% пациентов основной группы повышение на 149,4 мкмоль уровня МК сопровождалось снижением на 114,42 МЕ/л активности АлАТ, отмечена умеренная положительная корреляционная связь (r=0,31). У 20,0% больных рост на 102,0 мкмоль уровня МК сопровождался повышением на 88,1 МЕ/л цитолиза. У 23,4% больных наблюдалось одновременное снижение уровня МК (на 96,4 мкмоль) и цитолиза (на 133,2 МЕ/л). У 6,6% пациентов основной группы снижение (на 89,7 мкмоль) уровня мочевой кислоты сопровождалось повышением (на 58,6 МЕ/л) активности АлАТ (r=0,5).
У пациентов с изолированным ЛПП наблюдалась та же тенденция. В 52,2% случаев рост МК (на 28,6%) сопровождался снижением (в 2,8 раза) уровня АлАТ (r=0,42, p<0,05), у 30,4% больных одновременно уменьшались оба показателя.
Таблица 5. Значения биохимических показателей крови у больных с изолированным ЛПП
|
Показатель |
Период обследования |
||
|
До начала терапии |
6-й день |
11-й день |
|
|
АлАТ, МЕ/л |
170,7±18,2 |
144,2±15,1 |
42,0**±4,5 |
|
АсАТ, МЕ/л |
94,4±10,1 |
73,3±8,3 |
48,4**±5,2 |
|
Коэффициент де Ритиса, АсАТ/АлАТ |
0,52±0,5 |
0,64±0,7 |
0,97±1,1 |
|
Билирубин прямой, мкмоль/ |
4,12±0,4 |
3,59±0,4 |
3,11*±0,3 |
|
ГГТФ, Ед/л |
96,6±1,2 |
89,5±9,6 |
78,3±8,4 |
*- различия в сравниваемых показателях достоверны до и после курса терапии, p<0,05 (t-критерий Стьюдента)
** - различия в сравниваемых показателях достоверны до и после курса терапии, p<0,001
(t-критерий Стьюдента)
Рост уровня МК в процессе терапии ремаксолом связан с активацией ферментов дыхательной цепи, увеличением синтеза и потребления макроэргов (прежде всего, АТФ), одним из конечных продуктов метаболизма которых является мочевая кислота. Гиперурикемия отражает общее антигипоксическое действие применяемого сукцинат содержащего раствора, указывая на восстановление, в процессе проводимой коррекции ремаксолом, активности ферментативных каскадов катаболизма пуриновых нуклеотидов именно в ткани печени, поскольку образование мочевой кислоты (как конечного продукта распада пуринов) из гипоксантина (под действием ксантиноксидазы) возможно только в гепато- и энтероцитах и не происходит в других клеточных структурах организма.
Под действием ремаксола (табл. 5) у больных с изолированным ЛПП снижается активность маркеров цитолиза и концентрация ПБР. В отличие от больных ПГ1, активность АлАТ АсАТ, а также концентрация ПБР имели лишь тенденцию к снижению, достигая максимального (в 4,1 раза - АлАТ и в 1,3 раза - ПБР) снижения по окончании терапии (табл.1, 2). Коэффициент де Ритиса у больных с изолированным ЛПП повышается к 11-му дню терапии в 1,9 раза (0,97±1,1), оставаясь у больных 1-й подгруппы без существенной динамики, на фоне снижения в 1,2 раза (98,1±10,4,) активности ГГТФ (табл. 1, 2).
Сравнивая эффективность ремаксола с базовой терапией 5% раствором глюкозы (как субстрата энергетического обмена клетки [6]) показано, что ремаксол более эффективно снижает цитолитический синдром. Так, активность АлАТ под влиянием ремаксола была в 2 раза ниже, чем у больных, получавших раствор глюкозы (табл. 6).
Таблица 6. Активность ферментов и их индивидуальная динамика у больных ЛПП
|
Группа больных, препарат Показатель |
Основная группа Ремаксол (n=61) |
Группа сравнения Глюкоза 5% (n=20) |
|
|
АлАТ,МЕ/л |
До начала терапии |
170,7±18,2 |
123,9±26,4 |
|
По окончании терапии/ индивидуальная динамика |
42,0±4,5/ -99,5 |
80,5*±15,9/ -43,4** |
|
|
АсАТ,МЕ/л
|
До начала терапии |
94,4±10,1 |
101,7±28,1 |
|
По окончании терапии/ индивидуальная динамика |
48,4±5,2/ -44,1 |
64,4±12,5/ -37,4 |
|
|
Коэффициент де Ритиса (АсАТ/АлАТ) |
До начала терапии |
0,52±0,5 |
0,89±0,21 |
|
По окончании терапии/ индивидуальная динамика |
0,97±1,1/ +0,29 |
0,96±0,11/ +0,07** |
|
* - различия в группах достоверны, p<0,05 (t-критерий Стьюдента)
** - различия в группах достоверны, p<0,05 (U-критерий Манна-Уитни)
Конечная активность АсАТ была в 1,3 раза ниже, а индивидуальная динамика уровня фермента у больных, получавших глюкозу, отставала в 1,2 раза. При оценке индивидуальной динамики у больных 1-й группы коэффициент де Ритиса повышался в 4,1 раза интенсивнее, указывая на восстановление соотношения аминотрансфераз (табл. 6).
Сравнивая влияние растворов ремаксола и 5% глюкозы на клиническую картину ЛПП, показано уменьшение на 2-3 дня проявлений диспепсического, астеновегетативного синдромов у больных, получавших ремаксол.
Показатели протеинограммы на фоне введения раствора ремаксола существенно не менялись. Обращает на себя внимание изначально низкий уровень β1-глобулинов. Гипо β1глобулинемия связана со снижением уровня трансферрина, который, являясь прооксидантом и отрицательным глобулином острой фазы, компенсаторно снижается при воспалительных процессах в организме (в частности, при туберкулезной инфекции), что является одной из составляющих ответа острой фазы. Обращает на себя внимание изначально повышенный уровень β2-глобулинов у 40,0% обследованных. К середине курса лечения увеличение процентного содержания белков данной фракции крови регистрируется у 27,8% больных, а к концу терапии только в 5,9% случаев, отражая влияние ремаксола на восстановление соотношения белковых фракций крови.
Наиболее информативным является изучение морфологического состава форменных элементов периферической крови, т.е. лейкоцитарной формулы. Именно в ней отражаются сложные нейроэндокринные и биохимические изменения, происходящие в организме при воздействии на него различных по силе и качеству биологических и фармакологических раздражителей [1].
Выделяют несколько типов адаптационных реакций (АР) организма:
- Реакция стресса (РС), описанная Г. Селье, сопровождается развитием гормональной дисфункции, угнетением функции лимфоидной ткани и снижением резистентности организма.
- Реакция тренировки (РТ) при которой преобладают энергетические процессы с минимальным расходованием пластических субстратов, повышая реактивность организма.
- Реакция активации (РА), сопровождающаяся умеренным физиологическим возбуждением гипоталамических структур, гиперплазией лимфоидной ткани и активными анаболическими процессами, протекающими с накоплением и использованием пластических субстратов.
- Реакция перетренировки (РП), протекающая с преобладанием катаболических процессов, приводящих к снижению резистентности организма.
На основании выделенных типов адаптационных реакций З.И. Костина и Н.А. Браженко предложили их классификацию, основанную на подсчете абсолютного количества лимфоцитов, выделяя 5 типов реактивности - адекватный, гиперреактивный, парадоксальный, гипореактивный и ареактивный [7].
Тип адаптационной реакции организма определяется по абсолютному количеству лимфоцитов периферической крови. РС характеризуется количеством лимфоцитов менее 1,2*109/л, РТ - от 1,21 до 1,5*109/л, РА - от 1,51 до 3,5*109/л, РП - более 3,5*109/л. Необходимо отметить, что РС и РП всегда являются неполноценными. РТ и РА бывают полноценными и неполноценными. Неполноценность последних определяется по наличию в лейкограмме лейкоцитоза, лейкопении, эозинофилии, моноцитоза, палочкоядерного сдвига и токсической зернистости нейтрофилов. Неполноценные РТ и РА (РТН, РАН) свидетельствуют о снижении резистентности организма.
На представленных диаграммах показаны типы адаптационных реакций у больных с лекарственным поражением печени (рис. 2, 3, 4).
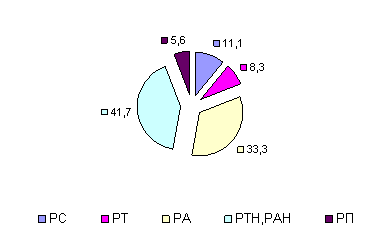
Рис. 2. Исходные типы АР у наблюдаемых больных
У 41,7% пациентов основной группы исходно наблюдались неполноценные реакции активации и тренировки (РА и РТ), отражающие нарушения динамического гомеостаза в организме в ответ на специфический процесс, так и на присоединившиеся гепатотоксические реакции.
У трети пациентов наблюдалась полноценная РА, отражающая нейрогуморальную перестройку и высокий уровень противовоспалительного потенциала организма в ответ на туберкулезную инфекцию.
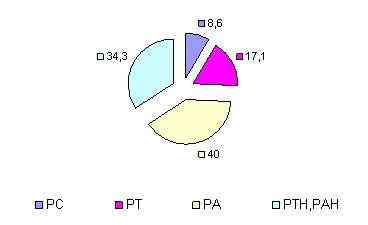
Рис. 3. Типы АР у наблюдаемых пациентов к середине курса лечения ремаксолом
Уже к середине курса терапии ремаксолом у пациентов наметилась тенденция к росту полноценной РА (у 40%) и к снижению (на 7,4%) ее неполноценного варианта (рис. 3). Отмечен рост в 2 раза частоты РТ, свидетельствуя о повышении доли энергетически выгодных процессов в клетках, подготавливающих ткань печени к последующей регенерации.
К концу курса терапии увеличилось на 23,5% число больных с РА, (рис.4), а число больных с РТ снизилась в 2,8 раза, в сравнении с исходным уровнем на фоне снижения на 34,5% неполноценных вариантов РА и РТ.
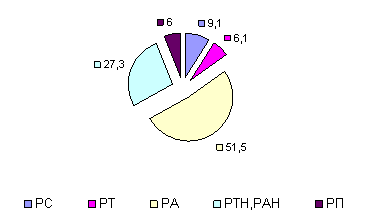
Рис. 4. Типы АР организма по окончании терапии ремаксолом
Только адекватный тип реактивности не является патологическим и определяется наличием полноценных РТ и РА с учетом абсолютного количества лимфоцитов (в пределах 1,0-3,5*109).
Таким образом, увеличение типов РА у больных к окончанию терапии свидетельствует об активном использовании пластических субстратов и усилении анаболических процессов, указывая на усиление репаративных процессов в гепатоцитах, способствуя восстановлению структуры печеночной ткани, снижению встречаемости патологических типов реактивности.
Выводы
- Внутривенное введение раствора ремаксола больным туберкулезом органов дыхания с проявлениями лекарственной гепатотоксичности способствует эффективному снижению клинических симптомов поражения печени (диспепсический и астеновегетативный), уменьшая проявления цитолитического синдрома. Убольных с изолированным лекарственным поражением подобный эффект более выражен, по сравнению с больными с сопутствующими вирусным гепатитом.
- На фоне введения ремаксола отмечено снижение уровня прямого билирубина и тенденция к уменьшению активности гамма-глутамилтрансферазы, что говорит о положительном влиянии препарата на проявления синдрома холестаза.
- На фоне терапии ремаксолом прослеживается тенденция к повышению концентрации мочевой кислоты в крови. Рост уровня метаболита коррелирует со снижением активностью АлАТ, что говорит о восстановлении энергетического метаболизма гепатоцитов и увеличением оборота АТФ, указывая на антигипоксический эффект препарата.
- Ремаксол повышает уровень полноценных типов адаптационных реакций (прежде всего, реакции активации), способствуя росту общей резистентности организма.
СПИСОК ЛИТЕРАТУРЫ:
- Астахова А.В., Лепахин В.К. Неблагоприятные побочные реакции и контроль безопсности лекарств. - М., 2004. - С. 99 - 121.
- Браженко Н.А., Браженко О.Н. Фтизиопульмонология. - М., 2006. - С. 47 - 50.
- Зайчик. А.Ш., Чурилов Л.П. Основы патохимии. - СПб.: Элби, 2000. - С. 57 - 60.
- Зарубина И.В., Шабанов П.Д. Молекулярная фармакология антигипоксантов. - Н-Л, 2004. - С. 17 - 85
- Ерохин В.В., Земскова З.С., Шилова М.В. Патологическая анатомия туберкулеза. - М., 2000. - С. 56 - 60.
- Коваленко А.Л. Фармакологическая активность оригинальных лекарственных препаратов на основе 1-дезокси-1(N-метиламино)-D-глюцитола: Автореф. дис. ... д-ра биол. наук. - СПб., 2005
- Кожока Т.Г. Лекарственные средства в фармакотерапии патологии клетки. - М., 2007. - 136 с.
- Костина З.И., Браженко Н.А. Саркоидоз органов дыхания во фтизиопульмонологии. - СПб., 2002. - С. 15 - 18
- Кукес В.Г., Фисенко В.П., Стародубцев А.К. и соавт. Метаболизм лекарственных препаратов. Под ред. Академика РАМН проф. Кукеса В.Г., чл.-корр. РАМН проф. Фисенко В.П. - М.: Палея-М, 2001. - С. 56 - 68.
- Лукьянова Л.Д. Молекулярные механизмы гипоксии и современные подходы фармакологической коррекции гипоксических нарушений // Фармакотерапия гипоксии и ее последствий при критических состояниях. - СПб., 2004. - С. 36 - 37.
- Молекулярные механизмы нежелательных эффектов лекарственных средств / Под редакцией Пальцева М.А., Кукеса В.Г., Хабриева Р.У. - М., 2005. - С. 9 - 21.
- Никитин А.В. Побочные реакции при противовирусной терапии ВИЧ-инфекции и гепатита С // Антибиотики и химиотерапия. - 2008. - Т. 53. - №3-4. - С. 46 - 49.
- Оболенский С.В. Реамберин - новое средство для инфузионной терапии в практике медицины критических состояний: метод. рекоменд. - СПб., 2002. - 23с.
- Побочные дейсвия антибактериальных химиотерапевтических средств // Противомикробные средства Под редакцией В.Б.Кузина. - Н.Новгород, 2008. - С. 26 - 32.
- Радченко В.Г., Шабров А.В., Зиновьева Е.Н. Основы клинической гепатологии. - СПб., 2005. - С. 306 - 318.
- Руководство по легочному и внелегочному туберкулезу. Под редакцией Ю.Н. Левашева, Ю.М. Репина. - СПб.: ЭЛБИ - СПб. - 2006. - С. 137 - 150.
- Семиголовский Н.Ю. Антигипоксанты в анестезиологии и реаниматологии: автореферат дис. д-ра мед. наук. - СПб, 1997.



