Целиакия (глютеновая энтеропатия, спру европейская, спру нетропическая, идиопатическая стеаторея) - заболевание, сопровождающееся атрофией ворсин слизистой оболочки тонкой кишки, развитием мальабсорбции на фоне употребления в пищу глютенсодержащих продуктов.
Заболевание описано во II веке нашей эры греческим врачом Аретеем (Aretaeus of Cappadocia) и было названо "koeliakos" (греч. - "страдание кишечника") [3], классическое описание клинической картины представил S. Gee [8]. W.K. Dicke впервые связал целиакию с дефицитом пшеничного хлеба (наблюдения выполнены в годы Второй мировой войны) и предложил бесхлебную диету для этих больных [5].
Распространенность целиакии существенно отличается в разных странах мира, в среднем составляя 0,5-1,0% от общего числа населения планеты. Значительный разброс показателей объясняется высокой частотой скрытых и атипичных форм заболевания - 7-10 случаев на 1 диагностированный [10].
Главным инициирующим фактором целиакии являются глютены (группа растительных белков фракций проламинов и глютелинов, содержащихся в злаковых). У генетически предрасположенных людей эти протеины вызывают неадекватную реакцию слизистой оболочки тонкой кишки. Заболевание наследуется по аутосомно-доминантному типу. Чаще всего (91%) повреждаются аллели HLA-DR3 и HLA-B8 (dq6) [20].
Механизмы манифестации заболевания остаются невыясненными. В литературе активно обсуждаются две теории развития болезни - иммунная и токсическая.
По данным J. Gass [7] у больных целиакией наблюдается недостаток ферментов: глутамин-специфической цистеин эндопротеазы и пролил эндопептидазы. Полагают, что в результате нарушения метаболизма в просвете кишки накапливается глютен и его недоращепленные продукты (фракции глиадина), оказывающие прямое токсическое действие на энтероциты, следствием чего является атрофия слизистой тонкой кишки и развитие симптомов целиакии. Эта теория подтверждается полным восстановлением слизистой оболочки тонкой кишки на фоне аглютеновой диеты, эффективностью применяемой в последние несколько лет ферментотерапии [19].
Другая распространенная теория - иммунологическая. После всасывания в слизистой тонкой кишки глиадины подвергаются дезамидированию (фермент - тканевая трансглутаминаза).
В результате мутации в гене HLA-1, дезамидированный глиадин как антиген способен активировать иммунный ответ организма [16].
Через Т-клеточный рецептор (TCR) активируются CD4+, CD8+ Т-лимфоциты, запускается цитокиновый каскад, индуцируется апоптоз энтероцитов [14] и продукция антител (рис 1).
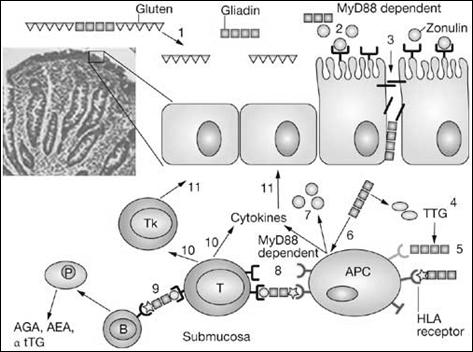
Рис. 1. Стадии развития иммунного ответа при целиакии [8]
Пусковыми цитокинами целиакии являются NF-kB, INF-γ, IL-15. Глиадин опосредованно вызывает фосфолирирование ингибитора NF-kB (Nuclear Factor kappaB), что приводит к активации последнего. NF-kB запускает экспрессию провоспалительных цитокинов и молекул адгезии (рис 2). В результате местно развивается реакция воспаления [9].
INF-γ вызывает выброс ферментов (например, матриксной металлопротеиназы), повреждающих энтероциты, провоспалительных цитокинов, снижение синтеза иммуноглобулина А.IL-15 активирует межэпителиальные лимфоциты. Фракция представлена TCRγδ CD4+, CD8+, CD56+, CD103+ T-лимфоцитами. После активации клетки приобретают цитотоксичность, экспрессируют провоспалительные цитокины (IL-2,-7,-8,-15), индуцируют апоптоз энтероцитов [18].
Межэпителиальные лимфоциты регулируют целостность плотных контактов (tight junction) кишечного эпителия: γ,δ цепи TCR участвуют в фосфорилировании сериновых остатков окклюдина [12]. В результате перестройки цитоскелета повышается проницаемость эпителия и увеличивается проникновение глиадина в собственную пластинку слизистой.
Запускается каскад антителообразования: Т-клетки выступают в роли антиген-презентирующих клеток для В-лимфоцитов, вырабатывающих антитела к глиадину. Образуются перекрестные антитела к тканевой трансглутаминазе, эндомизию.
Антитела к трансглутаминазе имеют сродство к Toll-like рецепторам 4 типа (TLR4) на поверхности межэпителиальных лимфоцитов. Комплексы антиген-антитело вызывают повреждение энтероцитов. На их поверхности начинается экспрессия MICA, MICB - рецепторов, активирующих межэпителиальные лимфоциты. Таким образом местная воспалительная реакция генерализуется. Вместе с тем запускается каскад системных аутоиммунных реакций (тиреоидит, сахарный диабет первого типа, дерматит) и развитие заболевания приобретает молниеносный характер.
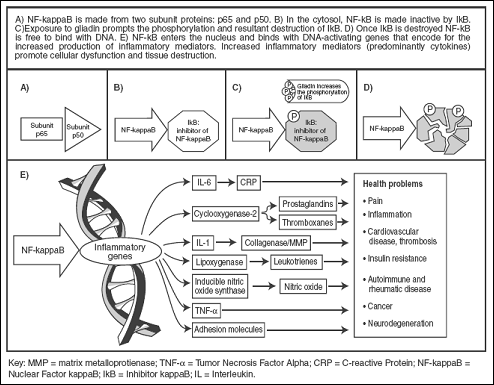
Рис. 2. Запуск цитокинового каскада при целиакии [9]
Диагностика целиакии длительное время была трудна и основывалась на клинических наблюдениях. Значимые симптомы (в приоритетном порядке): хроническая диарея, атаксия, анемия, герпетиформный дерматит, повышение трансаминаз, эпилепсия, бесплодие, периферическая нейропатия, рецидивирующий перикардит, потеря веса, диабет первого типа или патологии щитовидной железы в анамнезе, семейный анамнез целиакии, недостаточность IgA, осеопороз, снижение D-ксилозы, частый кариес [1]. С развитием медицинских технологий широкое применение нашли серологические и генетические методы исследования.
Биопсийное исследование - «золотой стандарт» диагностики целиакии. В 1969 году Европейским обществом гастроэнтерологов приняты диагностически значимые морфологические критерии целиакии: высота кишечных ворсинок менее 200 мкм (норма 270-300 мкм), гипертрофия и увеличение глубины крипт до 250-600 мкм, увеличение числа межэпителиальных лимфоцитов более 40 на 100 эпителиоцитов, лимфо-плазмоцитарная инфильтрация собственной пластинки. В 1990 году при пересмотре в перечень ранее установленных критериев диагноза включена эффективность аглютеновой диеты.
Гистологическая классификация предложена Маршем [13] и предусматривает выделение четырех стадий развития болезни. В 1999 Oberhuber G. с соавт. предложили более детальную градацию III стадии [17]. Используемая в настоящее время версия классификации Marsh приводится ниже.
Marsh I (воспалительная) - структура слизистой оболочки не изменена, наблюдается лимфоцитарная инфильтрация подслизистой, увеличение числа межэпителиальных лимфоцитов на верхушке ворсинок;
Marsh II (лимфоцитарный энтерит) - гиперплазия крипт, укорочение ворсинок, увеличение числа митозов, изменение соотношение крипта/ворсинка меньше 1:3-1:5;
Marsh III (деструкция) - атрофия ворсинок; Marsh IIIA - парциальная атрофия ворсинок, соотношение крипта/вор-
синка меньше 1; Marsh IIIB - субтотальная атрофия ворсинок; Marsh IIIC - тотальная атрофия ворсинок, слизистая оболочка тонкой кишки напоминает слизистую оболочку толстой кишки («кишечник-труба»);
Marsh IV (гипопластическая атрофия) - необратимая атрофия с резким истончением слизистой оболочки тонкой кишки. Наблюдается крайне редко.
В литературе обсуждается мнение, что IV стадия целиакии представлена изменениями, развившимися на фоне Т-клеточной лимфомы - редкого осложнения тяжелого течения заболевания [11, 4]. Предположительно пусковым механизмом развития лимфомы является гиперсекреция IL-15 [15]. В место воспаления привлекаются активированные межэпителиальные лимфоциты (Т-киллеры), из которых строится опухоль [21].
В 2005 г. G.R. Corazza, V. Villanacci предложена принципиально новая трехстадийная система классификации заболевания (рис. 3), в основу которой положены относительные величины (соотношение высоты ворсинок и глубинны крипт) [2]:
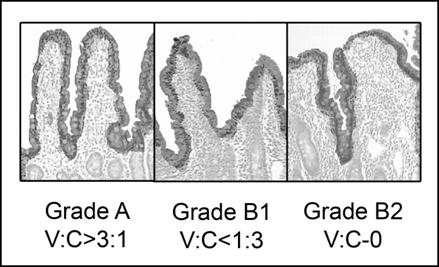
Рис. 3. Классификация целиакии по Corazza [2]
Классификация Corazza не отражает пато- и морфогенеза (стадийности) заболевания, однако простота, лаконичность и удобство использования ее обеспечивают постепенное вытеснение классификации Marsh.
Несмотря на активные исследования патогенеза целиакии, остается немало вопросов. Каков механизм манифестации заболевания? Почему при соблюдении аглютеновой диеты стойкая аутоиммунная реакция подвергается обратному развитию? Как происходит восстановление ультрамикроскопической структуры эпителия? Где грань между воспалительной инфильтрацией собственной пластинки слизистой оболочки и развитием Т-лимфомы? Какую роль в патогенезе заболевания играют межэпителиальные лимфоциты? Возможна ли полноценная заместительная ферментная терапия?
СПИСОК ЛИТЕРАТУРЫ:
- 1. Научно-техническая библиотека [электронный ресурс] / Ревнова М.О., 2001. Целиакия у детей. Учебно-методическое пособие для врачей и студентов медицинских факультетов - электронные данные. - СПб.: 2001 - Режим доступа: http://www.sciteclibrary.ru, свободный. Загл. с экрана.
- Corazza G.R., Villanacci V. // J Clin Pathol. - 2005. - Jun; 58(6): 573-4.
- Cataldo F., Montalto G. // World J Gastroenterol. - 2007. - April 21; 13(15): 2153-2159.
- Daum S., Weiss D., Hummel M., Ullrich R., Heise W., Stein H., Riecken E.O., Foss H.D. Intestinal Lymphoma Study Group. // Gut. - 2001. - Dec; 49(6):804-12.
- Dicke W.K. // Utreacht, The Netherlands: Univ of Utreacht. - 1950.
- Fasano A., Shea-Donohue T. // Nature Clinical Practice Gastroenenterology & Hepatology, - 2005. -2, 416-422doi: 10.1038/ ncpgasthep0259.
- Gass J., Bethune M.T., Siegel M., Spencer A., Khosla C. // Gastroenterology. - 2007. - Aug; 133(2):472-80.
- Gee S. // Saint Bartholomew´s Hospital Reports. - 1888. - 24:17-20.
- Helms S. // Alternative Medicine Review. - 2005. - Sep; 10(3):172-92.
- Holtmeier W., Caspary W.F. // Orphanet J Rare Dis. - 2006. - 1: 3.
- Katoh A., Ohshima K., Kanda M., Haraoka S., Sugihara M., Suzumiya J., Kawasaki C., Shimazaki K., Ikeda S., Kikuchi M. // Leuk Lymphoma. - 2000. - Sep; 39 (1-2):97-111.
- Kucharzik T., Walsh S.V., Chen J., Parkos C.A., Nusrat A. // Am J Pathol. - 2001. - Dec; 159(6):2001-9.
- Marsh MN, Crowe PT. // Baillieres Clin Gastroenterol. - 1995. - Jun; 9(2):273-93.
- Mazzarella G., Stefanile R., Camarca A., Giliberti P., Cosentini E., Marano C., Iaquinto G., Giardullo N., Auricchio S., Sette A., Troncone R., Gianfrani C. // Gastroenterology. - 2008. - Apr; 134(4):1017-27. Epub 2008 Jan 11.
- Mention J.J., Ben Ahmed M., Bègue B., Barbe U., Verkarre V., Asnafi V., Colombel J.F., Cugnenc P.H., Ruemmele F.M., McIntyre E., Brousse N., Cellier C., Cerf-Bensussan N. // Gastroenterology. - 2003. - Sep; 125(3):730-45.
- Molberg, O., McAdam S., Lundin K.E.A., Kristiansen C., Arentz-Hansen H., Kett K. and Sollid L.M. // Eur. J. Immunol. - 2001. - May; 31(5):1317-23.
- Oberhuber G., Granditsch G., Vogelsang H. // Eur J Gastroenterol Hepatol. - 1999. - Oct; 11(10):1185-94.
- Shiner M., Eran M., Freier S., Faber J., Branski D. // J Pediatr Gastroenterol Nutr. - 1998. - Oct; 27(4):393-6.
- Siegel M., Bethune M.T., Gass J., Ehren J., Xia J., Johannsen A., Stuge T.B., Gray G.M., Lee P.P., Khosla C. // Chem Biol. - 2006 - Jun; 13(6):649-58.
- Tighe M.R., Hall M.A., Barbado M., Cardi E., Welsh K.I., Ciclitira P.J. // Tissue Antigens. - 1992. - Aug; 40(2):90-7.
- Yuan C.M., Stein S., Glick J.H., Wasik M.A. // Arch Pathol Lab Med. - 2003. - Mar; 127(3):e142-6.



