Введение. Повреждение тканей приводит к разрыву кровеносных сосудов, что, в свою очередь, является первой ступенью активации тромбоцитов после контакта с коллагеном. Тромбоциты инициируют образование тромба через активацию коагуляционной системы, после образования тромбина фибриноген трансформируется в фибрин и это - первый шаг заживления раны. Препараты фибрина воспроизводят данный процесс и облегчают процессы репарации [10].
Первоначально фибрин и его препараты в стоматологии применяли для ускорения гемостаза после экстракции зубов, особенно при дефектах системы свертывания крови, и для закрытия дефектов костных тканей челюстно-лицевой области [9].
Затем фибриновые клеи стали использовать для прикрепления тканей во время различных видов пластики, вместо шовного материала и для улучшения приживления имплантатов из искусственных и синтетических материалов [4].
Обогащенная тромбоцитами плазма или фибриновый сгусток (БТФС) - это модификация фибринового клея, приготовленная из аутологичной крови и содержащая множество цитокинов. Эти релизы вызывают миграцию и деление всех мезенхимальных (включая хондроциты и мезенхимальные стволовые клетки) и эпителиальных клеток, стимулируют синтез коллагена и матрикса соединительной ткани [8].
Продукты деградации фибрина вызывают миграцию остеогенных клеток и гингивальных фибробластов in vitro и более быструю регенерацию хирургических костных дефектов in vivo в эксперименте. Фибриновые клеи и пленки могут служить своеобразным субстратом для поддержки роста фибробластов и их функций. Таким образом, адгезивные материалы, содержащие фибрин и фибронектин, их мономеры или продукты деградации, ускоряют заживление периодонтальных, в том числе и костных, тканей [7].
После применения БТФС, относительно естественного хода заживления, меньше выражены признаки острого и хронического воспаления в поврежденных тканях, более быстро фаза альтерации сменяется регенераторно-репаративными процессами. Показана целесообразность применения препаратов фибрина для ускорения регенерации тканей и ускорения приживления имплантатов в клинике и эксперименте [1‒3].
Таким образом, в литературе содержится множество противоречивых и взаимоисключающих данных об эффективности использования препаратов фибрина в стоматологии. Однако, несмотря на это, явно недостаточно отражены результаты исследований регенерации костных тканей при лечении повреждений с использованием препаратов фибрина, в частности БТФС, приготовленного из аутологичной плазмы крови с тромбоцитами.
В связи с вышеизложенным морфологическими и радиовизиографическими методами сравнивали процессы регенерации поврежденного участка кости нижней челюсти при естественном ходе заживления и после применения БТФС в эксперименте.
Материал и методы
В качестве модели были использованы самцы крыс линии Wag весом 180-200 г возрастом 6 месяцев. Все манипуляции с животными осуществляли под общим ингаляционным эфирным наркозом в условиях чистой операционной с соблюдением «Правил проведения работ с использованием экспериментальных животных». На каждую точку исследования было не менее 10 животных.
В данном случае было решено остановиться на создании дефекта костной ткани, который в меньшей степени имеет индивидуальные различия (особенности прохождения сосудов и нервов) и практически не смещается при работе мышц. Нижняя челюсть была выбрана вследствие того, что здесь достаточная прочность и ширина кости сочетается с легкостью доступа, кроме того, далее животное не сможет преждевременно избавиться от швов.
Приготовление БТФС. При декапитации нескольких крыс данной линии в стерильные стеклянные пробирки собирали 2-7 мл крови, которую центрифугировали при 2800 оборотах в минуту в течение 12 минут [1, 3]. После этого из пробирок отбирали верхнюю часть (БТФС - богатый тромбоцитами фибриновый сгусток или фибриновый сгусток с тромбоцитами), помещали в стерильные чашки Петри, хранили до нескольких часов в термостате при 37 °С до использования. Непосредственно перед применением стерильными ножницами от БТФС отрезали нужный по размерам фрагмент.
Модель дефекта костной ткани и применения БТФС в эксперименте. Под общим ингаляционным эфирным наркозом, в условиях чистой операционной, при соблюдении правил асептики и антисептики, после обработки кожи спиртом, скальпелем производили разрез кожи длиной 1,5-2 см по нижнему краю нижней челюсти. Тупым способом при помощи распатора отслаивали жевательную мышцу и обнажали поверхность кости нижней челюсти в области ее угла. Стоматологическим бором при определенных оборотах (одинаковый размер, ровные края, контроль глубины, одинаковая скорость вращения и, следовательно, нагрев тканей, возможность охлаждения) делали сквозное круглое отверстие диаметром 2 мм в кости угла нижней челюсти, с полостью рта дефект кости не сообщался. В группе крыс со спонтанным заживлением участка повреждения кости нижней челюсти (контроль) после прикрывания костного дефекта жевательной мышцей ушивали кожную рану непрерывным викриловым швом и снова обрабатывали кожу спиртом. В группе с использованием фибрина в круглый дефект кости пинцетом вводили БТФС, размер которого был незначительно больше диаметра отверстия. После плотного заполнения отверстия кости его прикрывали жевательной мышцей, ушивали кожу викриловым швом и обрабатывали кожу спиртом. Все имплантированные материалы были стерильными.
Животных выводили из эксперимента через 1, 2, 3, 4 и 5 недель после операции. Объектом исследования служила костная ткань нижней челюсти с искусственно созданным дефектом.
Фрагменты нижней челюсти фиксировали в 4 %-м растворе параформальдегида на фосфатном буфере (рН 7,4) не менее 24 часов. После фиксации удаляли кожу, подкожную клетчатку и жевательные мышцы, декальцинировали в растворе «Биодек R» (Bio Optica Milano, Италия) в течение 24 часов, обезвоживали в серии этанола возрастающей концентрации, просветляли в ксилоле и заключали в парафин. Срезы толщиной 5-7 мкм окрашивали гематоксилином и эозином, изучали на световом микроскопе Axioimager М1 (Carl Zeiss, Германия) при увеличении до 1200 раз.
Рентгенологические исследования проводили для наблюдений за репаративными процессами в кости нижней челюсти экспериментальных животных в различные сроки после ее повреждения, использовали препарированные фрагменты нижней челюсти с удаленной кожей и подкожной клетчаткой (рис. 1 а, б), оценивали плотность ткани в самом дефекте и в аналогичном участке контрлатеральной области.
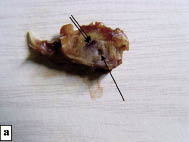
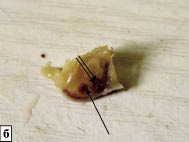
Рис. 1. Макропрепарат нижней челюсти крысы с удаленными жевательными мышцами через 1 неделю после ее повреждения:
а - естественная репарация. Признаков гнойного воспалительного процесса нет. Одной стрелкой указано искусственно созданное отверстие, заполненное кровяным сгустком. Две стрелки - корень центрального резца; б - после применения БТФС. Искусственно созданное отверстие не имеет макроскопических признаков воспаления, заполнено
и находится на уровне окружающих тканей. Одной стрелкой указано искусственно
созданное отверстие, заполненное БТФС. Две стрелки - корень центрального резца
Статистическую обработку результатов проводили на прикладной статистической программе MS Excel (Microsoft, USA), определяли среднее арифметическое и стандартное отклонение. Различия между средними считали достоверными при p ≤ 0,05, использовали критерий Стьюдента.
Результаты исследования
Через 1 неделю после повреждения кости нижней челюсти при спонтанной регенерации было найдено, что отверстие частично заполнено кровью, на некоторых участках в дефекте кости уже присутствовали фрагменты рыхлой волокнистой соединительной ткани и грануляции (рис. 2а). Следует отметить начало образования кости в дефекте (формирование отдельных островков молодой кости и хряща среди грануляций) (рис. 2а).
Через 2 недели отверстие было полностью закрыто молодой костной тканью с большим числом полнокровных кровеносных сосудов по краю дефекта. Среди вновь образованных костных структур также присутствовала хрящевая ткань, особенно в центре искусственного отверстия.
На 3-й неделе отверстие было полностью закрыто вновь образованной костной тканью. О месте операции можно было судить по оставшимся крупным сосудам и хаотично расположенным костным балкам (костная мозоль). К этому моменту появились полностью сформированные полости с костным мозгом.
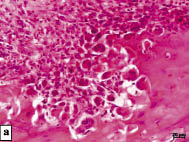
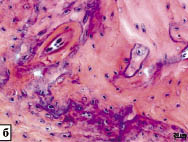
Рис. 2. Регенерация поврежденной кости нижней челюсти при естественном ходе
репаративного процесса. Окраска гематоксилином и эозином:
а - начало образования структур кости на периферии поврежденного участка нижней челюсти спустя 1 неделю после операции; б - хаотично расположенные балки костной ткани в костной мозоли через 4 недели после хирургического вмешательства
Через 4 и 5 недель в большинстве случаев самостоятельного заживления только по следам костной мозоли можно было найти место операции (рис. 2б).
Спустя 1 неделю после повреждения кости и заполнения дефекта БТФС отверстие было полностью заполнено слившимися островками вновь сформированной кости (рис. 3а), то есть регенерация кости после применения БТФС уже к 1-й неделе привела к полному заполнению искусственного дефекта.
В большинстве случаев через 2 недели после повреждения кости и заполнения дефекта БТФС отверстие так же, как и при спонтанной регенерации, было закрыто вновь образованной костной тканью с большим числом полнокровных кровеносных сосудов на периферии дефекта и хрящевой тканью в центре.
Спустя 3, 4 и 5 недель после повреждения кости нижней челюсти и применения БТФС, так же как и без использования фибрина, отверстие было полностью закрыто вновь образованной костной тканью с хаотично расположенными костными балками сформированной костной мозоли и полостями с костным мозгом (рис. 3б).
После статистической обработки данных денситометрии процессов регенерации дефекта кости нижней челюсти крыс при естественном заживлении и после применения БТФС было обнаружено отсутствие достоверных различий плотности тканей в очаге между сравниваемыми группами животных на каждую точку исследования. Однако плотность тканей при естественном ходе репаративных процессов статистически значимо отличалась от здоровой кости на контрлатеральной стороне в течение 3 недель, а на фоне использования БТФС - только на 1-й и 2-й неделях (рис. 4а, б) (таблица), то есть плотность тканей в участке повреждения после применения фибрина была выше и раньше происходила нормализация значения этого показателя.
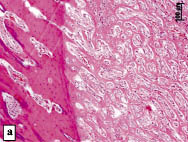
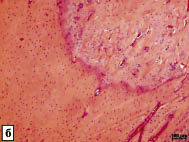
Рис. 3. Репарации поврежденной кости нижней челюсти после применения БТФС.
Окраска гематоксилином и эозином:
а - спустя 1 неделю после операции дефект кости заполнен слившимися островками молодой костной ткани с большим числом сосудов; б - структуры костной мозоли на месте отверстия
в кости нижней челюсти спустя 4 недели после операции
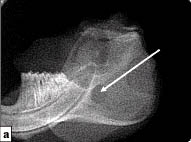
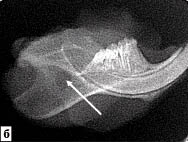
Рис. 4. Участок повреждения кости нижней челюсти операции по данным
радиовизиографического исследования. Искусственно созданное отверстие указано стрелкой:
а - естественный ход регенерации. Через 3 недели дефект кости сохраняется;
б - плотность тканей в дефекте костной ткани после применения БТФС выше
Кроме этого необходимо отметить, что во все сроки наблюдения плотность тканей в патологическом очаге после применения БТФС была несколько больше, чем при естественном ходе репарации (рис. 4а, б), хотя такая разница и была недостоверна. Максимальные различия плотности тканей были отмечены в период со 2-й по 4-й неделю, к 5-й неделе эти различия несколько сглаживаются (см. таблицу).
Плотность кости в дефекте нижней челюсти относительно
окружающих неповрежденных тканей (M ± m)
|
Срок после операции |
Репаративный процесс |
Разность плотности |
|
|
Естественное |
После применения БТФС |
||
|
1 неделя |
0,892 ± 0,053* |
0,913 ± 0,017* |
0,021 ± 0,05 |
|
2 недели |
0,922 ± 0,038* |
0,953 ± 0,021* |
0,031 ± 0,033 |
|
3 недели |
0,914 ± 0,033* |
0,949 ± 0,036 |
0,035 ± 0,051 |
|
4 недели |
0,912 ± 0,059 |
0,942 ± 0,048 |
0,03 ± 0,043 |
|
5 недель |
0,913 ± 0,064 |
0,924 ± 0,063 |
0,011 ± 0,008 |
Примечание: * - величины, достоверно отличающиеся от интактной кости контрлатеральной стороны (р ≤ 0,05); 2, 3 - величины, достоверно различающиеся между собой в данных колонках (р ≤ 0,05).
Обсуждение полученных данных
После повреждения кости нижней челюсти в эксперименте в тканях развивается острая воспалительная реакция. Этот процесс возникает как ответ на прямое повреждение тканей в результате хирургического вмешательства. Со временем стихает воспалительная реакция, вызванная операцией, и начинается восстановление поврежденных тканей.
При повреждении кости нижней челюсти и спонтанном заживлении отверстие сразу после травмы заполняется кровью и там формируется сгусток из фибрина с большим числом эритроцитов. Постепенно этот сгусток лизируется фагоцитами (сначала нейтрофилами, потом макрофагами) и по мере его удаления туда мигрируют остеогенные клетки. За счет функционирования этих остеобластов начинается формирование молодой костной ткани с краев дефекта. Постепенно эти островки молодой кости становятся шире, сливаются, и практически во всех случаях к 2‒3 неделе у крыс происходит полная регенерация кости в искусственно созданном дефекте. Следует отметить, что морфологические данные о регенерации кости к указанным срокам подтверждены результатами денситометрии.
Фибрин в тканях, согласно литературным данным, уменьшает выраженность воспалительного процесса [1‒3] и ограничивает распространение инфекции [5], то есть при введении фибринового сгустка в полость раны, видимо, можно защитить окружающие ткани как от распространения микроорганизмов, так и от излишнего воздействия лизосомальных ферментов фагоцитов. Происходит ограничение деструкции и в связи с этим раньше начинаются регенераторные процессы, в тканях оказывается меньший объем антигенов и детрита, происходит более быстрое очищение раны.
Кроме этого, фибриновый сгусток является матрицей, по которой мигрируют лейкоциты (нейтрофилы), эндотелиоциты и фибробласты [7, 8]. Тромбоспондин-1 из тромбоцитов стимулирует тубулогенез (начальную стадию ангиогенеза) эндотелиоцитами [6].
Мигрируя по фибрину [8], нейтрофилы более быстро достигают всех участков раны, даже покрытых наслоениями гноя и детрита и, таким образом, ткани более быстро очищаются от антигенных веществ (микроорганизмы и тот же детрит). Кроме того, при передвижении по фибриновому сгустку нейтрофилы частично «разжижают» его своими ферментами и даже плотный сгусток становится похожим на сеть.
Фибробласты, располагаясь в фибриновой сети [7, 8], начинают синтез коллагена не только со дна раны, но и из ее полости, таким образом более быстро на месте формируется рубцовая ткань.
Следует отметить, что фибрин не только облегчает миграцию фибробластов, но и сам по себе ускоряет синтез соединительной ткани [1‒3, 8].
Эндотелиоциты, также стимулированные к миграции фибрином [8], более быстро начинают процессы ангиогенеза [6] и вновь образованные сосуды располагаются не только в грануляциях по дну раны, но и в объеме фибриновой сети. Более быстрый рост сосудов в свою очередь облегчает миграцию лейкоцитов из сосудистого русла и синтез компонентов соединительной ткани.
Спустя 1 неделю после операции с последующим заполнением отверстия в кости нижней челюсти БТФС не происходит заполнения дефекта костной ткани кровяным сгустком, нет необходимости тратить время на лизис и элиминацию эритроцитов посредством фагоцитоза. В большинстве случаев уже к этому сроку весь дефект костной ткани был заполнен слившимися островками вновь сформированной кости, то есть регенерация кости после применения БТФС уже к 1-й неделе привела к практически полному заполнению искусственного дефекта.
Ко второй неделе после использования БТФС происходило дальнейшее постепенное заполнение дефекта вновь образованной костной тканью с большим числом полнокровных кровеносных сосудов на периферии и формирование костной мозоли, которая полностью закрывала отверстие кости уже к 3-й неделе, к этому же сроку было отмечено образование в месте хирургического вмешательства полостей с красным костным мозгом. Указанные изменения той или иной степени выраженности сохранялись и в последующие сроки наблюдения.
Основным отличием в данном случае будет являться наличие большого числа эритроцитов в естественном сгустке. Фибрин, присутствующий в нем, также будет облегчать миграцию нейтрофилов, эндотелиоцитов, макрофагов, остеобластов и других клеточных элементов. Однако эритроциты в петлях фибриновой сети будут препятствовать этому процессу. Кроме того, часть потенциала фагоцитов будет расходоваться не только на поглощение детрита, но и на фагоцитоз эритроцитов из сгустка.
Таким образом, на основании вышеизложенного можно заключить, что начало репарационных процессов при применении БТФС проходит интенсивнее, чем при спонтанном заживлении. Отверстие в кости быстрее заполняется островками костной ткани, которые раньше сливаются. Видимо, формирование молодой кости начинается сразу после операции без потери времени на лизис и удаление кровяного сгустка с большим числом эритроцитов.
В связи с тем, что после использования БТФС происходит более интенсивная регенерация участка повреждения кости, по-видимому, целесообразно применение препаратов фибрина, приготовленных из аутологичной крови, для ускорения репаративных процессов костных тканей в стоматологии, хирургии и травматологии.
Работа выполнена при финансовой поддержке программы Фундаментальных исследований Президиума РАН «Фундаментальные науки - медицине» (проект № 21.31 «Разработка технологий управления процессами регенерации костных тканей с применением биодеградируемых полимеров»).
Выводы
1. После повреждения кости нижней челюсти у крыс и естественном ходе регенерации дефект костной ткани заполняется кровью и там формируется сгусток с большим числом эритроцитов. Спустя 1 неделю в участке повреждения кости среди фрагментов кровяного сгустка и грануляций уже присутствуют отдельные островки молодой костной ткани. Через 2‒3 недели отверстие в кости нижней челюсти полностью замещается молодой костной тканью.
2. После операции с последующим заполнением дефекта кости нижней челюсти БТФС не происходит образования кровяного сгустка. Уже спустя 1 неделю весь дефект костной ткани заполнен слившимися островками вновь сформированной кости. Ко второй неделе после использования БТФС отмечено дальнейшее замещение дефекта костной тканью и формирование костной мозоли.
Список литературы
- Майбородин И.В., Колесников И.С., Шеплев Б.В. и др. // Морфологические ведомости. - 2007. - № 3‒4. - С. 116-118.
- Майбородин И.В., Колесников И.С., Шеплев Б.В., Рагимова Т.М. Применение фибрина и его препаратов в стоматологии // Стоматология. - 2008. - Т. 87, № 6. - С. 75-77.
- Майбородин И.В., Колесников И.С., Шеплев Б.В. и др. Морфология подлежащих тканей десны после дентальной имплантации с применением препаратов фибрина // Стоматология. - 2009. - Т. 88, № 1. - С. 9-13.
- Choukroun J., Diss A., Simonpieri A. et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part IV: clinical effects on tissue healing // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. - 2006. - Vol. 101, № 3. - P. e56-e60.
- Choukroun J., Diss A., Simonpieri A. et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part V: histologic evaluations of PRF effects on bone allograft maturation in sinus lift // Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. - 2006. - Vol. 101, № 3. - P. 299-303.
- Kellouche S., Mourah S., Bonnefoy A. et al. Platelets, thrombospondin-1 and human dermal fibroblasts cooperate for stimulation of endothelial cell tubulogenesis through VEGF and PAI-1 regulation // Exp. Cell. Res. - 2007. - Vol. 313, № 3. - P. 486-499.
- McDougall S., Dallon J., Sherratt J., Maini P. Fibroblast migration and collagen deposition during dermal wound healing: mathematical modelling and clinical implications // Philos Transact. A Math. Phys. Eng. Sci. - 2006. - Vol. 364, № 1843. - P. 1385-1405.
- Schwartz-Arad D., Levin L., Aba M. The use of platelet rich plasma (PRP) and platelet rich fibrin (PRP) extracts in dental implantology and oral surgery // Refuat Hapeh Vehashinayim. - 2007. - Vol. 24, № 1. - P. 51-55, 84.
- Spotnitz W.D., Prabhu R. Fibrin sealant tissue adhesive ‒ review and update // J. Long Term Eff. Med. Implants. - 2005. - Vol. 15, № 3. - P. 245-270.
- Valbonesi M. Fibrin glues of human origin // Best Pract. Res. Clin. Haematol. - 2006. - Vol. 19, № 1. - P. 191-203.
Рецензенты:
Бгатова Наталия Петровна, д.б.н., профессор, зав. лабораторией ультрастуктурных исследований НИИ клинической и экспериментальной лимфологии СО РАМН;
Склянов Юрий Иванович, д.м.н., профессор, зав. кафедрой гистологии ГОУ ВПО Новосибирского государственного медицинского университета Росздрава.



